基于肠道菌群探讨水合橙皮内酯对AS抑郁症共病模型大鼠的调节作用
2022-06-14王喆孙波任平黄熙
王喆,孙波,任平,黄熙
(1.南京中医药大学中医学院·中西医结合学院,江苏 南京 210023;2.南京中医药大学附属医院,江苏 南京 210029)
动脉粥样硬化性心血管病(Atherosclerotic cardiovascular diseases,ASCVD)是人类健康头号杀手[1-2]。ASCVD中,83%的患者表现为新常态的共病(即患者同时患有2种以上病,如下呼吸道疾病、关节炎、糖尿病以及胃肠道疾病等)[3-5],其中动脉粥样硬化(Atherosclerosis,AS)与抑郁共病高达40%[6]。AS是一种慢性炎症性疾病,长期摄入高脂饮食(High-fat diets,HFD)会引起血脂异常,人体内循环系统中单核细胞在血管内膜募集是AS形成的最初阶段。随后单核细胞分化为巨噬细胞,通过清道夫受体吞噬修饰的脂质如氧化修饰低密度脂蛋白(ox-LDL),进而引起炎症并形成泡沫细胞。泡沫细胞可触发核转录因子NF-κB信号通路,激活TNF-α、IL-1β和IL-1α等促炎因子,维持局部的炎症环境,募集更多的单核细胞以进一步加重血管内皮炎症,形成负循环。泡沫细胞死亡后形成脂核,并被血管平滑肌增生形成的纤维帽包裹,最终形成了动脉血管斑块。AS引起的全身炎症状态增强了血脑屏障渗透性,外周的促炎因子(TNF-α、IL-1β和IL-6等)穿过血脑屏障作用于大脑,引起中枢神经系统的炎症,影响5-羟色胺(5-Hydroxytryptamine,5-HT)等神经递质的产生,引发认知、记忆障碍和快感缺失等抑郁症的核心症状[7-10],这也是AS与抑郁共病互相影响的重要基础。
肠道菌群被发现与宿主的神经系统和免疫系统存在相互作用[11]。肠道菌群的诸多产物,如5-HT、代谢产物短链脂肪酸(Short-chain fatty acids,SCFAs)等通过肠屏障等途径转运到体内,引起免疫细胞对其形成的信号进行免疫反应,所产生的各种炎症因子(如IL-6、IL-1β、TNF-α等)对远端的器官组织产生影响,又或通过肠神经系统(ENS)等进入中枢神经系统进而影响脑功能[12]。
水合橙皮内酯(Meranzin hydrate,MH)是一种具有抗抑郁作用的化合物[13-15],是柴胡疏肝散的主要药效成分[14],研究发现MH也同时具有抗炎作用[16]。因此,本团队根据AS与抑郁症的发病机理以及肠道菌群对宿主的作用途径,将海马组织和血浆促炎因子水平、血脂水平、主动脉斑块面积、抑郁样行为及肠道菌群结构作为研究指标开展研究。
辛伐他汀因其降脂作用常被用来治疗高脂血症和AS,近年研究发现其在抗炎方面,例如治疗抑郁症等神经炎症疾病时也具有一定效果,因此选用辛伐他汀作为阳性药[17]。柴胡疏肝散按30 g·kg-1的剂量对急性应激抑郁大鼠进行口服给药,并确认发挥抗抑郁疗效,随后分析计算出每30 g柴胡疏肝散含有6.81 mg MH[18],因此最终确定MH 3.5 mg·kg-1和7 mg·kg-1分别为低剂量和高剂量,辛伐他汀7 mg·kg-1作为阳性药物组,空白组采用维持饲料,模型组和药物干预组采用HFD饲养12周建立抑郁症和AS共病模型,对MH疗效进行深入研究。
1 材料与方法
1.1 动物与模型
8周龄SD大鼠6只,雄性,SPF级,体质量(280±20)g,购自南通大学实验动物中心,生产许可证号:SCXK(苏)2019-0001;8周龄ApoE-/-大鼠24只,雄性,SPF级,体质量(280±20)g,购自华东师范大学实验动物中心,生产许可证号:SCXK(沪)2016-0004。大鼠饲养在南京中医药大学实验动物中心屏障设施内,使用许可证号:SYXK(苏)2018-0049。实验动物伦理批准编号:202006A029。
饲养条件:温度(22±2)℃,湿度(55±5)%,噪音≤60 dB,光照/黑暗各12 h,早上7:00-19:00为光照状态。SD大鼠为空白组,给予维持饲料,ApoE-/-大鼠随机分为4组,每组6只,模型组与MH 3.5 mg·kg-1组、MH 7 mg·kg-1组和辛伐他汀7 mg·kg-1组给予HFD 12周。HFD包含:10%猪油、4%奶粉、1.25%胆固醇、0.5%胆酸钠以及84%维持饲料。
1.2 药物
MH(纯度≥98%,成都地奥集团);辛伐他汀片(商品名:舒降之,杭州默沙东,批号:J20180007)。遮光放入密封罐后置于4 ℃冰箱保存。灌胃药物均使用十万分之一天平称取,实验当天超纯水定容配制。给药体积为10 mL·kg-1,实验期间上午9:00开始灌胃,每日1次。
1.3 主要试剂及仪器
TNF-α、IL-1β、IL-6和5-HT ELISA试剂盒(南京奥青生物技术有限公司,批号:ANG-E11040R,ANG-E11024R,ANG-E11064R,ANG-E11128R);AU680全自动生化仪(美国BECKMAN公司);DNA分离试剂盒(美国MOBIO Laboratories公司);PCR试剂盒(大连TaKaRa Biotechnology公司);TopScan HR动物行为学运动轨迹分析系统、动物绝望自动分析系统(美国CleverSys公司)。
1.4 行为学实验
1.4.1 体质量和糖水偏好 实验期间每2周对所有大鼠进行体质量称量并记录,评估大鼠生长情况及调整药物配制。实验期间,每2周进行1次糖水偏好实验。第1天给予每笼大鼠2瓶蔗糖水,自由摄取饲料和蔗糖水进行适应。第2天给予每笼大鼠1瓶蔗糖水和1瓶超纯水,自由摄取饲料和饮用水。第3天为禁食禁水24 h。第4天为测试期,给予每笼大鼠1瓶蔗糖水,记录初始质量为WT1;1瓶超纯水记录初始质量为WS1,测试共1 h,中间30 min时对水瓶位置进行互换,其余测试期间保证环境无干扰。测试结束后,蔗糖水质量记为WT2,超纯水为WS2。计算公式:蔗糖偏好=(WT1-WT2)/[(WT1-WT2)+(WS1-WS2)]×100%(每组分3笼,每笼2只大鼠)。
1.4.2 旷场实验(Open field test,OFT) 上午9:00—11:00开展实验,室温(22±2)℃,保持测试环境清洁无异味。敞箱规格为50 cm×50 cm×50 cm,底板和四壁均为蓝色,每个敞箱仅供1只鼠进行测试。使用TopScan HR记录分析大鼠自发活动,测试时间5 min。最终获得大鼠运动总距离。
1.4.3 强迫游泳实验(Forced swim test,FST) 上午9:00—11:00开展实验,室温(22±2)℃。保持测试桶内清洁无异味。圆桶直径25 cm,高50 cm,桶内水高36 cm,温度(22±1)℃。每个FST圆桶测试1只鼠。使用TopScan HR记录分析大鼠在5 min内的不动时间。
1.5 相关指标检测
1.5.1 血液生化指标检测 取材前12 h禁食,给予0.9%的葡萄糖水进行能量供给。1.5%异氟烷吸入麻醉腹腔采血,检测血清甘油三酯(Triglyceride,TG)、总胆固醇(Total cholesterol,TC)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterin,LDL-C)和高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)水平,血浆TNF-α、IL-1β和IL-6水平,按样本顺序检测并记录结果。
1.5.2 大鼠主动脉油红O染色 大鼠采血死亡剪开胸腔剥离主动脉,将包含主动脉弓的主动脉剪开并剥除结缔组织,清理吸干水分后放入4%多聚甲醛浸泡,密封遮光待检;油红O染色操作步骤:从固定液中取出主动脉,洗净后去除主动脉管壁外脂肪,将主动脉对半剪开(包含主动脉弓),样本浸泡在油红O染色液中10 min,取出后95%酒精漂洗5 min,撑开固定主动脉,拍照。
1.5.3 大鼠大脑海马体5-HT、TNF-α、IL-1β和IL-6水平检测 大鼠采血死亡后断头取出海马体,称取样品,按1∶9稀释后用液氮研磨,依照ELISA试剂盒说明书,按样本顺序检测并记录结果。
1.5.4 大鼠肠道菌群16S rDNA测序 使用灭菌器械将盲肠内容物挤入灭菌离心管中,加入预冷灭菌生理盐水。使用4 ℃低温离心机12 000 r·min-1离心15 min,离心后保留沉淀物和上清液的下层部分,液氮灭活5 min。根据DNA提取试剂盒说明书提取粪便中总DNA,用带有barcode及Premix Taq(TaKaRa)对V4区进行PCR扩增。引物序列为:515F:GTGCCAGCMGCCGCGGTAA,806R:GGACTACHVGGGTATCTAAT。然后PCR扩增产物切胶回收。将纯化的扩增产物进行等量混合,连接测序接头,按Illumina标准流程进行建库,Illumina Hiseq2500平台对构建的扩增子文库进行PE250测序。随后进行拼接,得到拼接序列(Raw Tags)。再对Raw Tags进行质量过滤,最终得到有效的拼接片段(Clean Tags)。
1.6 统计学方法
采用SPSS 26.0对实验数据进行统计分析,GraphPad Prism 8.0进行图表制作。使用单因素方差分析(One-wayANOVA)对计量资料进行统计,使用双因素方差分析(Two-wayANOVA)对数据存在随时间因素变量数据进行统计。
2 结果
2.1 MH对AS抑郁共病大鼠一般情况的影响
如图1所示,整个实验期间,各组大鼠均持续生长和体质量增加。维持饲料饲养空白组SD大鼠平均体质量最低,其余各组体质量表现出更高更平稳的增加趋势,其中第8周、第10周以及第12周,与空白组大鼠相比,模型组大鼠体质量存在显著差异(P<0.05,P<0.01);其中模型组、MH 3.5 mg·kg-1及辛伐他汀7 mg·kg-1在实验末期体质量趋同。
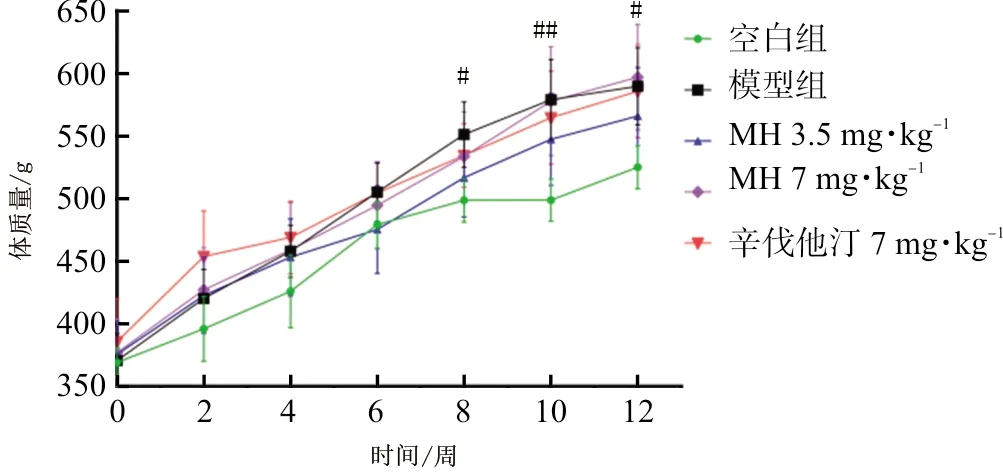
图1 各组大鼠在实验周期内体质量情况
2.2 MH对AS抑郁共病大鼠抑郁行为的影响
2.2.1 MH对AS抑郁共病大鼠糖水偏好的影响 糖水偏好实验中,抑郁大鼠对蔗糖的喜爱丧失,对蔗糖水的摄取减少。因此用糖水偏好实验可反映大鼠的快感缺失和抑郁程度及药物抗抑郁疗效[19]。如图2所示,与模型组相比,第2周MH 7 mg·kg-1组和辛伐他汀7 mg·kg-1组大鼠的糖水偏好率有显著差异(P<0.05);第10周MH 7 mg·kg-1组大鼠糖水偏好率表现为增加(P<0.05),表明药物抗抑郁治疗后,快感缺失症状得到一定程度缓解。
2.2.2 MH对AS抑郁共病大鼠OFT运动总距离和FST不动时间的影响 OFT测试中,大鼠在敞箱的外周区域和中心区域的运动和探索行为(即受试动物的运动总距离)可以反映大鼠的抑郁水平[20]。如图2所示,模型组大鼠探索意愿降低,其运动总距离减少,表现出明显的抑郁样行为(P<0.01);药物治疗后的大鼠,运动总距离出现不同程度增加,表明药物治疗后大鼠的探索意愿提升,抑郁样行为得到改善(MH 7 mg·kg-1组和辛伐他汀7 mg·kg-1组,P<0.01)。上述结果表明长期HFD引起模型组大鼠出现抑郁样表现,MH可显著影响大鼠在OFT测试中探索反应,改善抑郁样行为。
FST测试中,大鼠处在无法逃避的绝望或压力环境中,通过观察大鼠放弃挣扎的时长评价抑郁状态及药物抗抑郁效果[19],即不动时间。如图2所示,与空白组相比,模型组大鼠不动时间延长,呈现抑郁样行为(P<0.01);MH 7 mg·kg-1组、辛伐他汀7 mg·kg-1组不动时间缩短(P<0.01),MH 3.5 mg·kg-1组虽然没有统计学意义,但不动时间有所缩短(P>0.05),结果表明长期HFD引起模型组大鼠呈抑郁样表现,而MH可显著影响大鼠在FST测试的不动时间,改善抑郁样行为。
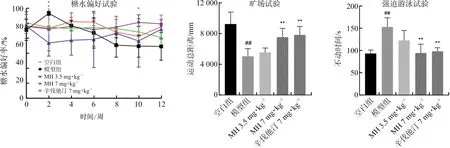
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。±s,n=3~6。
2.2.3 MH对AS抑郁共病大鼠大脑海马体5-HT和IL-1β、IL-6、TNF-α水平的影响 抑郁症的发生被认为与海马5-HT水平下调和中枢神经炎症有关[21]。如图3,与空白组相比,模型组大鼠5-HT水平下调(P<0.01),MH 3.5 mg·kg-1组、MH 7 mg·kg-1组和辛伐他汀7 mg·kg-1组5-HT水平上调(P<0.01)。结果表明长期HFD引起模型组大鼠海马体5-HT水平下调,MH能逆转长期HFD引起的5-HT下调,且高剂量的MH给药效果与辛伐他汀7 mg·kg-1接近。炎症因子水平上,模型组炎症水平上调(P<0.01),此时模型组出现神经炎症,MH 3.5 mg·kg-1组、MH 7 mg·kg-1组和辛伐他汀7 mg·kg-1组促炎因子水平显著下调(P<0.05,P<0.01),表明MH治疗后的大鼠,神经炎症得到缓解,能有效降低海马促炎因子水平,高剂量的MH作用效果与辛伐他汀7 mg·kg-1接近。
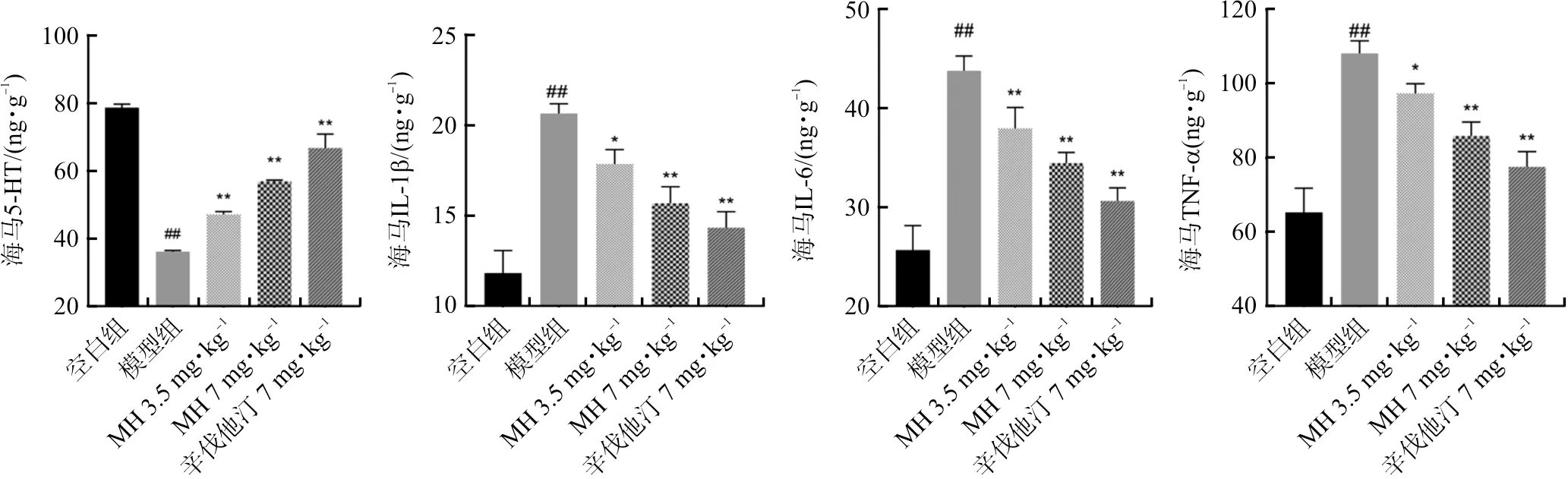
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。±s,n=3。
2.3 MH对AS抑郁共病大鼠动脉粥样硬化的影响
2.3.1 MH对AS抑郁共病大鼠血浆促炎因子水平的影响 长期HFD可诱发脂肪组织代谢性炎症,并逐渐演变为慢性低水平炎症。因此实验末期,需对各组血浆促炎因子IL-1β、IL-6、TNF-α水平进行检测。如图4,与空白组相比,模型组炎症水平上调(P<0.01),表明此时模型组处于全身炎症状态;MH 3.5 mg·kg-1组、MH 7 mg·kg-1组和辛伐他汀7 mg·kg-1组促炎因子水平显著下调(P<0.01),表明MH具有抗炎作用,能有效调节整体炎症水平,且7 mg·kg-1的给药剂量能发挥近乎辛伐他汀的抗炎效果。
2.3.2 MH对AS抑郁共病大鼠血脂水平的影响 血脂水平能够反映全身脂质代谢,可以用于评价模型是否建立以及药物降脂疗效,因此对各组大鼠血清TG、TC、LDL-C和HDL-C水平进行测定。如图4所示,与空白组相比,模型组血清TG、TC、LDL-C水平上调(P<0.01),血清HDL-C水平下调(P<0.01),表明长期HFD引起模型组脂质代谢异常;MH 3.5 mg·kg-1组、MH 7 mg·kg-1组和辛伐他汀7 mg·kg-1组中,血清TG、TC、LDL-C水平均有所降低(P<0.05,P<0.01),HDL-C水平均有所提高(P<0.05,P<0.01),其数据表明MH可逆转HFD引起的脂质代谢异常,但MH 7 mg·kg-1的给药剂量降脂效果不如经典调脂药辛伐他汀。
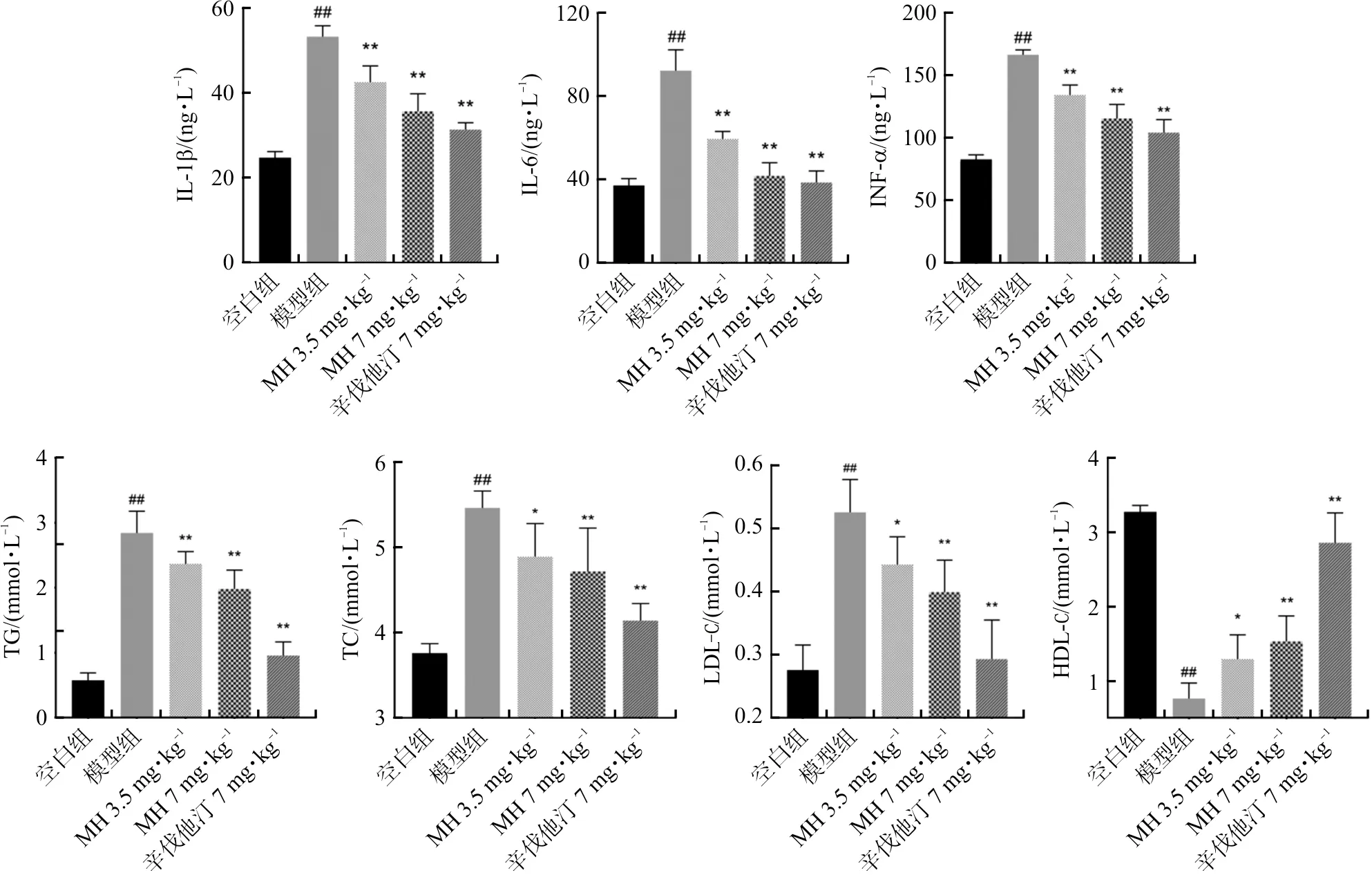
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。±s,n=6。
2.3.3 MH对AS抑郁共病大鼠主动脉斑块形成的影响 主动脉内出现斑块,是AS形成的标志。本研究采用油红O对主动脉进行染色,评价大鼠AS模型与药物抗AS疗效。如图5所示,与空白组大鼠油红O病理染色图相比,模型组在主动脉(含主动脉弓)表现出明显红色斑块(红色斑块为脂质经染料染色形成),斑块面积占整根主动脉近25%,而空白组仅8%。与模型组相比,药物治疗组出现了不同程度的斑块减少,MH 7 mg·kg-1组和辛伐他汀7 mg·kg-1组斑块面积占比下调(P<0.01),MH在7 mg·kg-1的给药剂量下,其疗效接近辛伐他汀,MH 3.5 mg·kg-1组数据虽无统计学意义,但与模型组相比3.5 mg·kg-1MH的给药仍能降低主动脉内形成斑块的面积(P>0.05),结果表明MH能够降低主动脉内斑块的形成。采用Image-Pro plus 6.0软件对所染色病理图片进行数据采集,并使用GraphPad Prism 8.0做统计。
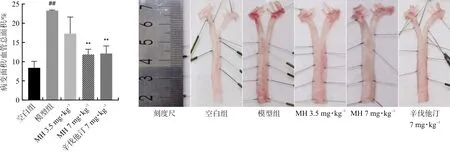
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。±s,n=3。
2.4 MH对AS抑郁共病大鼠肠道菌群的影响
2.4.1 肠道菌群物种α多样性分析 α多样性分析是一项针对样本内部的分析,关注样本内部的多样性。通常利用肠道菌群的稀疏曲线反映信息采集的深度;等级-丰度曲线反映物种组成的丰度和均匀性。如图6A~B,每条曲线最终趋于平缓,表示此次数据采集的信息已足够,呈现的数据真实可靠。随后,进一步分析各组的物种指数估算α多样性。如图6C,与空白组相比,模型组的Shannon_e指数上调(P<0.01),长期HFD改变了模型组大鼠的肠道菌群的多样性;与模型组相比,MH 3.5 mg·kg-1(P<0.05)、MH 7 mg·kg-1(P<0.01)组大鼠经MH治疗后,大鼠的肠道菌群多样性有了不同程度上调,而辛伐他汀7 mg·kg-1组大鼠肠道菌群多样性并没有显著改变。其结果表明,MH可以调整HFD大鼠的肠道菌群的多样性,辛伐他汀在7 mg·kg-1的给药剂量下,对肠道菌群的作用有别于MH。
2.4.2 肠道菌群物种β多样性分析 β多样性分析是针对不同样本的分析,关注样本间的差异性。图6D,每个点代表一个样本,同组样本用同一种颜色表示,通过点与点之间的距离表示物种组成的结构差异性。非度量多维尺度(Non-metric multidimensional scaling,NMDS)中,空白组(K1)和模型组(M2)的样本未出现重叠,有较大程度的分离,表明2组样本的菌群结构差异性较大。经过治疗的大鼠样本表现出一定的聚合倾向,表明MH和辛伐他汀对AS抑郁共病大鼠的肠菌组成具有相似作用。模型组和药物治疗组的β多样性分析表明不同样本间的肠菌结构差异受到HFD和药物干预的影响。
2.4.3 肠道菌群物种的组间显著差异菌和系统进化分析 基于“2.4.1”和“2.4.2”的结果,确认长期HFD和药物能够影响各组大鼠肠道菌群的多样性,随后通过分析不同组之间具有统计学差异的菌群,探究影响模型组大鼠的菌群以及药物作用的菌群。图6E,对2组间进行直接比较。空白组(K1)与模型组(M2),密螺旋体属_2(Treponema_2),普雷沃氏菌属_Ga6A1(Prevotellaceae_Ga6A1_group)和阿克曼氏菌属(Akkermansia)差异有统计学意义。模型组(M2)与MH 3.5 mg·kg-1组(H1),普雷沃氏菌属_9(Prevotella_9),普雷沃氏菌属_Ga6A1(Prevotellaceae_Ga6A1_group),阿克曼氏菌属(Akkermansia)之间的差异有统计学意义。模型组(M2)与MH 7 mg·kg-1组(H2)之间,普雷沃氏菌属_9(Prevotella_9)有显著性差异。模型组(M2)与辛伐他汀7 mg·kg-1组(X1)之间,拟杆菌属(Bacteroides)和普雷沃氏菌属_Ga6A1(Prevotellaceae_Ga6A1_group)之间的差异有统计学意义(P<0.05)。图6F,对各组大鼠肠道菌群结构进行系统进化分析,发现空白组和模型组的肠菌结构相似度高,MH和辛伐他汀虽然对共病大鼠均有治疗效果,但对肠道菌群的结构影响有区别。

图6 MH对AS抑郁共病大鼠肠道菌群的影响
3 讨论
AS相关病症属于祖国传统医学“胸痹”范畴。痰浊内阻是其重要致病因素,痰阻血脉,血滞为瘀,从而影响血液的正常运行输布。心位上焦,主血而藏神,七情内伤导致心血瘀滞或虚损同样也是诱发AS的重要因素。肝主疏泄,条畅一身气机,故而气机的调达和血液的运行也有赖于肝主疏泄的功能。血与气,心与肝相互影响。由于肝失疏泄、心失所养,而易引发郁证,故现代医学的抑郁症可能会与AS以共病形式出现。为进一步探究AS与抑郁共病的治疗,本研究中选用MH作为干预药物。MH是柴胡疏肝散主要吸收入血的成分之一,研究发现其能有效抗炎、抗氧化和抗抑郁[18]。柴胡疏肝散出自《景岳全书》,功能疏肝理气养血,是治疗肝气郁结的代表方剂。现代药理研究表明,柴胡疏肝散可通过调节神经递质、抑制炎症反应,发挥抗抑郁和抗AS的作用[22-23]。因此柴胡疏肝散被广泛应用于治疗多种疾病,如抑郁症[24]、冠状动脉粥样硬化[25]等。故本研究旨在探索柴胡疏肝散的重要吸收成分MH对AS抑郁共病的疗效和药物作用机理。长期HFD饮食会引起血脂异常,进而诱发血管动脉粥样硬化病变。AS病变伴随的外周炎症状态增加了血脑屏障渗透性,促炎因子可穿过血脑屏障作用于大脑,加重中枢神经系统的炎症,神经炎症引起海马功能障碍,而海马功能正常与否对抑郁症有重要意义[26-27]。海马不仅影响记忆和认知,对食物摄入和能量代谢也有着重要作用[28-29]。当海马受到进一步影响时,可引发人体认知功能下降并抑制食物摄入,导致代谢紊乱,引起冠心病、AS等[30-31]。因此,外周炎症和中枢神经炎症是AS和抑郁同时发病的重要基础。本次研究发现模型组除AS典型血脂和斑块改变外,海马促炎因子和外周促炎因子水平均显著上调,海马5-HT水平下调,出现糖水偏好率下降等明显的抑郁样行为。
除了饮食直接引起外周炎症和中枢炎症,肠道菌群也通过肠道有所影响。肠道菌群产生的代谢物(如5-HT和SCFA等)以及死细菌分解的结构成分如脂多糖(Lipopolysaccharide,LPS)、肽聚糖等信号可以引起肠道免疫反应[32],小分子代谢物通过跨细胞和旁细胞等途径从肠腔转移到体内。由于HFD引起外周炎症状态,肠屏障也受到影响增加了通透性,这为大分子的死细菌结构(如LPS等)通过受损的肠屏障向全身转移提供了便利。免疫细胞在接收到LPS等信号后做出免疫反应,产生各种炎症因子,进而引发局部或全身性炎症[33-35]。当LPS进入循环后,与Toll样受体4(Toll-like receptor 4,TLR4)之间的相互作用激活了NF-κB通路,从而导致促炎因子如IL-6、IL-1β和TNF-α的合成增强,继而参与AS和CVDs的发展[36]。循环系统中的促炎因子再通过血脑屏障继续影响中枢神经,引起神经炎症导致神经元功能障碍。研究发现超过40%的抑郁症患者有肠道通透性增加的情况,肠道通透性的增加可能导致肠道的免疫激活,从而影响中枢神经系统。鉴于肠道微生物群对维持肠屏障功能具有重要作用[34,37],可认为肠道菌群的结构改变影响了肠屏障的正常功能从而影响中枢神经介导的抑郁症。此外,肠道菌群通过产生5-HT对中枢神经发挥作用,5-HT是具有重要意义的神经递质,全身约90%~95%的5-HT存在于胃肠道[38]。肠道菌群产生5-HT在穿过肠屏障后,达到外周循环,随后经血脑屏障进入中枢神经系统,共同参与对宿主行为和情绪的调节。
AS与抑郁症的发展改变了肠道菌群的组成和代谢产物。通过组间显著差异菌分析(属水平),普雷沃氏菌属_9(Prevotella_9)、阿克曼氏菌属(Akkermansia)及普雷沃氏菌属_Ga6A1(Prevotellaceae_Ga6A1_group)的丰度水平出现了显著改变,3种菌属与肠道通透性关联,可影响体内肠道与全身的炎症水平。普雷沃氏菌属_9(Prevotella_9)能够产生丙酸盐,其丰度水平与粪便中的丙酸盐呈正相关,研究发现丙酸盐能抑制TNF-α释放,缓解肠道炎症,维持肠屏障完整,减少肠道菌群细胞壁上的内毒素性LPS向体内的转移,存在降低局部或全身炎症的可能[39]。阿克曼氏菌属(Akkermansia)和普雷沃氏菌属_Ga6A1(Prevotellaceae_Ga6A1_group)在本次实验结果中,难以直接评价,阿克曼氏菌属(Akkermansia)丰度增加将引起更多的慢性不可预测轻度应激模型(Chronic unpredictable mild stress model,CUMS)动物的抑郁表现[40],但另一项研究发现阿克曼氏菌属(Akkermansia)增加后能改善代谢综合征[41]。普雷沃氏菌属_Ga6A1(Prevotellaceae_Ga6A1_group)丰度上调也与CUMS动物的抑郁水平正相关,且能引起慢性炎症[42]。前文结果提示成功建立AS抑郁共病模型大鼠,从图6E可以发现,2种菌群的丰度水平与本次研究结果不匹配,结合文献与本实验的造模方式和药物,推测与长期HFD和药物的作用途径有关,需要后续研究。
综上所述,以炎症为中心点,血脂异常和肠菌结构改变为基础,抑郁和AS共存,相互影响,形成一个恶性循环。在这个过程中,MH具有良好的抗炎调脂作用,并通过调整肠道菌群结构,逆转了AS与抑郁的症状,从而缓解AS抑郁共病。
