陆地棉COI家族基因鉴定及在干旱和盐胁迫下的表达分析
2022-06-14李美丽宿俊吉杨永林秦江鸿李鲜鲜杨德龙马麒王彩香
李美丽, 宿俊吉, 杨永林, 秦江鸿, 李鲜鲜, 杨德龙*,马麒, 王彩香*
(1.甘肃农业大学生命科学技术学院,省部共建干旱生境作物学国家重点实验室,兰州 730070;2.石河子农业科学研究院棉花研究所,新疆 石河子 832000;3.新疆农垦科学院棉花研究所,新疆 石河子 832000)
茉莉素(jasmonates,JAs)是具有广泛作用的植物激素,它不仅调控植物生长发育,而且还参与植物生物或非生物胁迫响应[1-2]。冠菌素不敏感蛋白1(coronatine-insensitive 1,COI1)是茉莉素信号途径的关键受体,含有富含亮氨酸重复(leucinerich repeat,LRR)和F-box结构域,最早从拟南芥(Arabidopsis thaliana)中获得[3]。该蛋白能够与SCF(skp-cullin-F-box)型 E3泛素连接酶组成SCFCOI1复合物,构成茉莉素信号转导途径中的核心组分,能够识别茉莉素信号传导途径中的一些调控因子,通过26S蛋白酶体降解,达到调控植物生长发育和抗逆性的作用[4]。在拟南芥中,COI1参与调控叶片衰老[5-8]和顶端优势[9]。在小麦中,TaCOI1参与小麦雄性不育信号调控[10]。此外,水稻OsCOI1的RNAi株系表现出株高、节间长度和籽粒长度的改变,并增加了对咀嚼昆虫的敏感性[11],而油菜中沉默COI1基因表现出蚜虫抗性下降和雄性不育等现象[12]。目前,关于COI1基因功能的研究主要集中在植物的生长发育和生物胁迫方面,而在植物非生物胁迫中的研究甚少。
随着植物基因组信息不断释放,已从小立碗鲜、中华卷柏、云杉、水稻、高粱、毛果杨中分别鉴定到12、7、2、9、8、10个COI基因家族成员[13]。棉花不仅是天然纤维的重要来源,也是重要的抗旱、耐盐碱先锋作物,鉴定分析陆地棉(Gossypium hirsutum L.)COI1家族基因,为改良棉花耐逆性提供重要基因资源。本研究基于最新公布的升级版陆地棉TM-1参考基因组[14],对GhCOI家族成员进行全基因组鉴定,并对其家族成员的理化性质、基因结构、染色体分布、系统进化和共线性关系进行分析,结合干旱、盐、高温和冷胁迫处理转录组数据,鉴定参与非生物胁迫的GhCOI基因,利用荧光定量PCR(qRT-PCR)验证其胁迫表达模式,为陆地棉COI家族基因功能研究奠定基础。
1 材料与方法
1.1 供试材料
本研究所用材料为抗旱、耐盐碱陆地棉品种新石K18,种子由石河子农业科学研究院棉花研究所提供。将新石K18棉花种子用75%乙醇浸泡2 min,用无菌水漂洗至无乙醇味后,再用无菌水浸泡24 h左右,将露白的棉花种子放置于自制水培盒(30 cm×20 cm×15 cm,内置泡沫板24 cm×15 cm,11个孔,孔距7 cm)中进行萌发,挑选长势一致的棉花幼苗,移入1/2改良型霍兰格营养液中进行培养,待棉花幼苗长至4叶期分别用200 mmol·L-1NaCl和 15% PEG-6000 溶液进行胁迫处理,每个处理设置3个生物学重复,并分别在处理0、0.5、1.0、3.0、6.0、12.0和24.0 h进行叶片采样,样本收集后液氮速冻,-80℃保存备用。
1.2 数据来源
棉花全蛋白序列、全基因组序列和基因注释GFF3 文 件 下 载 自 CottonFGD[15](http://www.cottonfgd.org/),拟南芥COI蛋白序列下载自TAIR数据库[16](https://www.arabidopsis.org/index.jsp),陆地棉4种非生物胁迫(盐、干旱、冷和热)转录组数据下载自NCBI SRA数据库(https://www.ncbi.nlm.nih.gov/sra/?term=PRJNA248163)。
1.3 GhCOI基因家族鉴定及蛋白特性分析
根据拟南芥已鉴定出的COI基因及其编码的蛋白序列,利用Pfam[17]数据库(http://pfam.xfam.org/)和Hmmer3.0软件构建隐马氏模型,对棉花全蛋白序列进行检索和去冗余,得到候选蛋白序列,阈值设为e<1.0×10-5。利用在线软件平台PfamScan(https://www.ebi.ac.uk/Tools/pfa/pfamscan/) 和SMART[18](http://smart.embl-heidelberg.de/)对棉花所有候选基因的氨基酸序列结构域进行鉴定,凡含有LRR和F-box结构域的蛋白即为棉花COI基因家族成员,并根据陆地棉COI基因家族在染色体上的定位及亲缘关系远近进行命名。
利用在线工具ExPASy(https://web.expasy.org/protparam/)分析陆地棉GhCOI蛋白的理化性质,包括氨基酸数目(number of amino acids)、分子量(molecular weight)和等电点(pI)等;在亚细胞定位网站 WoLF PSORT(https://wolfpsort.hgc.jp/)对其进行亚细胞定位预测分析。
1.4 GhCOI家族基因染色体定位、系统进化树构建及共线性分析
GhCOI基因染色体信息从基因注释文件中获得,用MapInspect软件绘制GhCOI家族基因在染色体上的位置;利用MEGA7.0软件中的Align by Clustal W工具进行多重序列比对,各参数设定为默认值,采用Neighbor-Joining法构建系统发育进化树,Bootstrap值设定为1 000;采用TBtools软件中One step MCScanX工具对GhCOI家族基因进行共线性及同义替换率/非同义替换率(Ka/Ks)分析。
1.5 GhCOI基因结构和蛋白保守基序的分析
分别从陆地棉全基因组序列和基因注释文件中筛选GhCOI基因家族的DNA和CDS序列,利用Gene Structure Display Server(GSDS)(http://gsds.gao-lab.org/index.php)对GhCOI家族基因进行基因结构分析。利用MEME Suite 5.3.3(https://meme-suite.org/meme/)对GhCOI蛋白进行保守基序预测,motif数为5个,借助TBtools软件对该基因家族的保守基序进行可视化分析。
1.6 GhCOI家族基因顺式作用元件分析
利用TBtools软件Gtf/Gff3 Sequences extractor工具提取陆地棉CDS序列上游2 000 bp序列,通过 PlantCare[19]数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测顺式作用元件。
1.7 GhCOI家族基因表达特征分析
GhCOI家族基因的盐、干旱、冷和热胁迫的转录组数据从NCBI SRA数据库(https://www.ncbi.nlm.nih.gov/sra/?term=PRJNA248163)下载,利用基迪奥生物信息绘图云平台(https://www.omicshare.com/tools/)绘制该家族基因的非生物胁迫表达量热图。
1.8 GhCOI家族基因qRT-PCR验证
筛选含抗逆顺式作用元件且高表达的GhCOI家族基因,利用qRT-PCR进行验证。利用NCBI Primer-BLAST工具(www.ncbi.nlm.nih.gov/tools/primer-blast/)设计qPCR引物(表1),产物片段大小在70~150 bp之间,由上海生工生物工程技术服务有限公司合成。将1.1中所采集的样品用多糖多酚总RNA提取试剂盒(天根生化科技有限公司)提取总RNA,超微量浓度检测仪和琼脂糖凝胶电泳检测其纯度、含量和完整性。采用FastKing gDNA Dispelling RT SuperMix试剂盒(天根生化科技有限公司)合成cDNA。采用SuperReal荧光定量预混试剂增强版试剂盒(天根生化科技有限公司)进行qRT-PCR,用2-ΔΔCT法[20]计算相对表达量。

表1 实时荧光定量PCR引物Table 1 Primer sequence for qRT-PCR
2 结果与分析
2.1 GhCOI基因家族鉴定及理化性质分析
从陆地棉中鉴定得到48个COI基因,根据陆地棉COI基因在染色体上的位置和进化关系将其命名,如表2所示。序列分析(表2)显示,48个GhCOI基因编码的蛋白长度为362(GhCOI4-A05)~702 aa(GhCOI6-A12和GhCOI6-D12);蛋白质分子量在 39.99(GhCOI4-A05)~79.13 kD(GhCOI6-A12)之间;等电点分布在5.50(GhCOI8C-A08)~8.86(GhCOI1-A05、GhCOI1-D06)之间。
对48个GhCOI基因进行亚细胞定位预测,发现该家族基因主要定位在细胞质、细胞核、叶绿体和线粒体(表2),其中43.75%的GhCOI基因定位在细胞核(21个),39.58%的GhCOI基因定位在细胞质中(19个),其他基因则定位在叶绿体或线粒体,表明GhCOI基因主要在细胞质和细胞核中表达。

表2 GhCOI基因理化性质及亚细胞定位预测Table 2 Characteristics and subcellular localization prediction of GhCOI genes

表2 GhCOI基因理化性质及亚细胞定位预测Table 2 Characteristics and subcellular localization prediction of GhCOI genes 续表Continuted
2.2 GhCOI基因的染色体定位
对48个GhCOI基因进行染色体定位,结果(图1)表明:GhCOI基因在染色体上呈不均匀分布,其中染色体 A03、A04、A13、D02和 D13无GhCOI基因分布,染色体 A01、A02、D03、A07、A09、D01、D04、D07和D09各有1个基因分布,其他染色体上GhCOI基因分布数目2~4个不等,此外还发现有42%的GhCOI基因主要分布在染色体的两端。

图1 GhCOI基因在染色体上的分布Fig.1 Chromosome distribution of GhCOI genes
2.3 GhCOI基因的系统发育和共线性分析
2.3.1 系统发育分析 为了研究陆地棉与其他3个棉种及拟南芥COI基因的系统发育关系,分别从 海 岛 棉(Gossypium barbadenseL.)、亚 洲棉(Gossypium arboreumL.)和雷蒙德氏棉(Gossypium raimondiiL.)得到 48、25和 23个COI基因,运用MEGA7.0软件进行聚类分析,结果如图2所示。根据系统发育树中亲缘关系的远近,151个COI基因分为3个亚族:Ⅰ、Ⅱ和Ⅲ,而Ⅰ和Ⅱ亚族又分别可细分为5个不同的亚类,即Ⅰ-1、Ⅰ-2、Ⅰ-3、Ⅰ-4、Ⅰ-5和Ⅱ-1、Ⅱ-2、Ⅱ-3、Ⅱ-4、Ⅱ-5,且不同亚族和亚类所含物种种类和COI基因数量存在一定差异。其中,Ⅰ-3亚类、Ⅱ亚族和Ⅲ亚族均不包含AtCOI基因,且Ⅰ-3和Ⅱ-1亚类包含成员最少(6个),Ⅰ-5成员最多(24个),其他亚类所包含成员数量11~18个不等。

图2 COI基因系统发育分析Fig.2 Phylogeny analysis of COI genes
2.3.2 共线性分析 为了更好地了解GhCOI基因的扩展模式,将GhCOI基因进行了共线性分析,结果(图3)发现:部分GhCOI基因同时与家族内多个基因存在共线性关系,如GhCOI1-A01与GhCOI1-D01和GhCOI1-D05之间有共线性关系,因此共发现62对基因具有共线性关系;48个GhCOI基因全为片段复制,这表明片段复制对该家族的扩大起到了关键作用。

图3 COI基因系统共线性分析Fig.3 Collinearity analysis of COI genes
GhCOI家族基因复制事件的Ka/Ks范围为0.09~0.65,平均值是0.21(数据未列出),所有重复事件GhCOI基因的Ka/Ks值均小于1,说明这些基因均在纯化选择压的作用下进化。
2.4 GhCOI基因结构及蛋白保守域的分析
对GhCOI基因的结构进行分析(图4A),发现21个GhCOI基因无内含子,内含子数最多的基因GhCOI10-A09含有8个内含子,其余基因所含内含子数目1~7个不等。内含子的不均匀分布表明,GhCOI家族基因在进化的过程中可能发生内含子的插入或缺失。
对GhCOI蛋白的保守基序进行预测(图4B),发现48个GhCOI蛋白均含Motif 1和Motif 3,除GhCOI4-A05和GhCOI4-D05外,其余均含有Motif 4,其序列如图4C所示;另外,41.7%(20个)的蛋白含有的Motif结构最多(5个),4.2%(2个)的蛋白含有的Motif结构最少(Motif 1和Motif 3)。
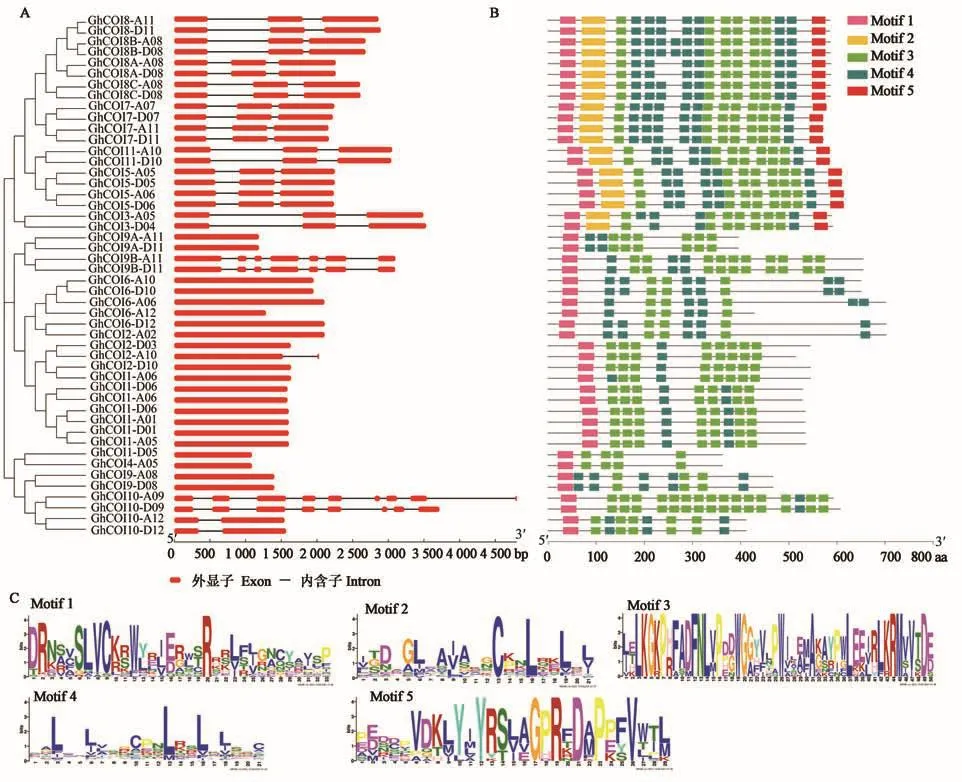
图4 GhCOI家族成员结构特征和保守基序分析Fig.4 Structure and conservative motif analysis of the GhCOIs
2.5 GhCOI基因非生物胁迫相关顺式作用元件预测和表达分析
对48个GhCOI基因上游2.0 kb的启动子序列顺式作用元件进行分析(图5A),在GhCOI启动子区域发现了6种胁迫响应调控元件,即富含 TC 的重复序列(TC-rich repeats)、LTR(lowtemperature re-sponsiveness),GC 基序/ARE(GC-motif/anaerobic induction)、MBS(MYB binding site)和WUN基序(wound element),它们分别与防御/应激、低温、缺氧、干旱和创伤反应相关。不同的GhCOI基因启动子中存在不同类型和数量的调控元件,表明GhCOI基因可能通过多个顺式作用元件共同参与植物的非生物胁迫响应。
对盐、干旱、冷和热4种胁迫下的48个GhCOI家族基因的表达模式进行分析,结果(图5B和5C)发现:该家族基因在NaCl、PEG、热和冷胁迫下,分别发现有66.7%、56.25%、68.8%和27.1%的基因表达量升高,其中,同时响应NaCl和PEG胁迫的高表达基因有20个,同时响应PEG和热胁迫的有25个。
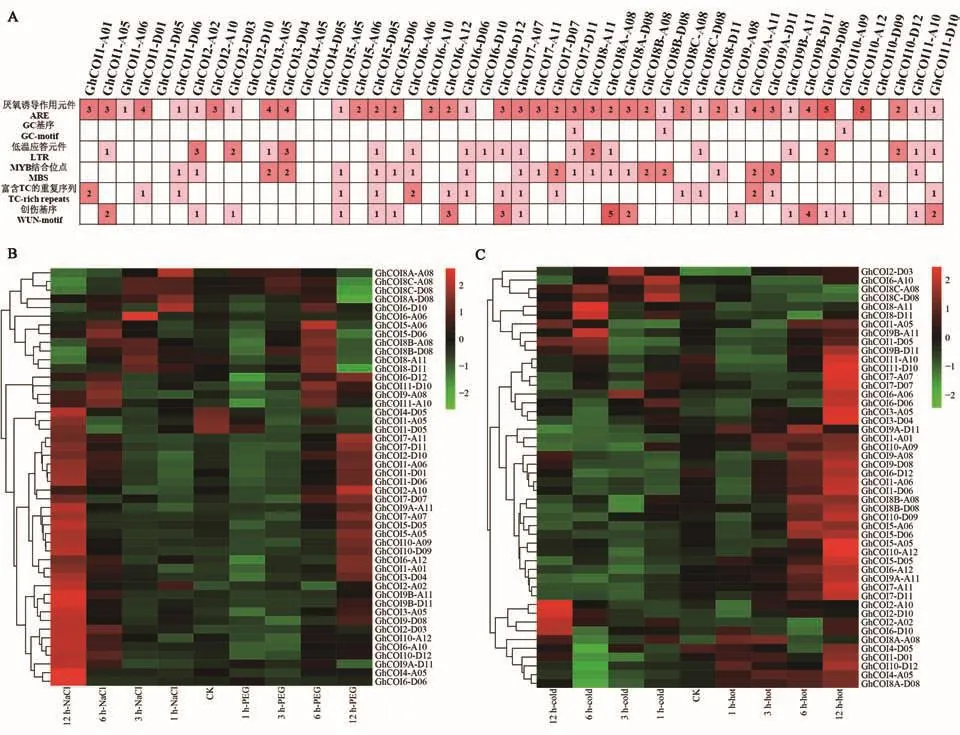
图5 GhCOI基因顺式作用元件预测和在非生物胁迫下的表达Fig.5 cis-acting elements and expression analysis of GhCOI genes
2.6 GhCOI家族基因qRT⁃PCR分析
对含较多抗逆顺式作用元件且同时在PEG和NaCl胁迫下高表达的20个基因进行分析,选出表达较高的9个基因进行qRT-PCR验证,结果如图6所示。NaCl和PEG均能显著诱导GhCOI基因的表达,但不同基因的响应程度存在差异。在NaCl处 理 下(图 6A),GhCOI1-D06、GhCOI3-D04、GhCOI3-A05、GhCOI5-A06和GhCOI10-A09基因表达量显著提高,其中GhCOI5-A06的表达量最高,GhCOI3-A05次之。在PEG胁迫下(图6B),除GhCOI1-D01基因外,其余8个基因均呈现高表达,其中GhCOI1-D01、GhCOI1-D06、GhCOI3-D04、GhCOI3-A05、GhCOI5-A05和 GhCOI5-A06基因的表达量均呈现先增后减再上升的趋势,且GhCOI5-A05表达量最高,GhCOI5-A06次之。由此得出,GhCOI5-A06能同时强烈响应NaCl和PEG两种胁迫。

图6 9个GhCOI基因在NaCl和PEG胁迫下的表达分析Fig.6 Expression analysis of 9 GhCOIs under NaCl and PEG stress
总体来看,GhCOI基因在2种非生物胁迫下的相对表达量都明显上调,与SRA数据库中陆地棉TM-1在盐和干旱胁迫下的转录组数据的表达趋势相吻合。
3 讨论
COI1是茉莉酸信号转导途径的关键调控因子,在植物调控生长发育和响应逆境胁迫方面起重要作用[21]。本研究共鉴定到陆地棉、海岛棉、亚洲棉和雷蒙德氏棉COI基因各48、48、25和23个,前人在拟南芥中鉴定到7个COI基因[13]。拟南芥与棉花COI基因数量的差异表明,随着植物倍性的增加,COI家族基因也在不断的扩增和复制。系统发育分析发现,151个GhCOI蛋白被划分为3个亚族,且拟南芥COI基因主要聚集在Ⅰ亚族中,其中AtCOI1与其他6个成员有明显的聚类分歧,具体表现为Ⅰ-1亚家族中只有AtCOI1,这与段龙飞[13]的研究结果一致。值得注意的是,AtCOI1是茉莉酸调节途径的关键受体基因,GhCOI3-A05和GhCOI3-D04与其聚类进化关系较近,这说明在陆地棉中GhCOI3-A05和GhCOI3-D04可能是参与茉莉酸转导途径的关键候选基因。根据基因结构分析发现,陆地棉中有44%的COI基因无内含子,其余基因含有1~7个不等,这种内含子数量的差异可能是在进化过程中,由于内含子的插入或丢失造成的变化;保守基序分析发现48个GhCOI基因均含有Motif 1和Motif 3,推测它们为该家族的保守性基序。
基因复制被认为是基因组和遗传系统进化的主要驱动力之一[22],片段复制、串联复制和转位事件被认为是3种主要的进化模式。在这些模式中,片段复制和串联复制被认为是植物基因家族扩大的两个主要原因[23]。对陆地棉COI基因共线性分析发现,48个GhCOI基因不均匀的分布于21条染色体上,且均为片段复制,其结果与小麦COI[24]家族基因共线性分析结果一致。基因在染色体上的这种不均匀分布表明基因在进化过程中存在遗传变异[25]。此外,同义替换率和非同义替换率是评价重复事件纯化选择压力的基础,而纯化选择可能是重复基因功能差异的主要驱动力[26]。通过对复制基因对的同义替换率和非同义替换率分析发现,GhCOI基因均在纯化选择压下进行,这可能是促进COI基因能够响应各种逆境胁迫反应的关键。
分析GhCOI基因在不同胁迫下的顺式作用调控元件和表达谱。在GhCOI启动子中发现了6种响应胁迫及防御反应调控元件(低温、干旱、缺氧、防御和创伤),与Bai等[24]在小麦TaCOI家族基因的研究一致,这表明GhCOI和TaCOI基因一样,对不同的胁迫处理和损伤有不同的调控机制。本文进一步研究了GhCOI基因在不同胁迫条件下的表达模式,结果显示该家族基因可响应多种非生物胁迫。例如,在干旱和温度诱导下,GhCOI3-D04、GhCOI3-A05和GhCOI7-A07表达上调,且这些基因均含有1~3个MBS/LTR元件。COI同源基因在不同非生物胁迫下的表达可为该家族的生理生化和基因功能研究提供重要信息。
本研究利用qRT-PCR对部分基因进行表达验证发现,9个被检测GhCOI基因在NaCl和PEG胁迫下均上调表达,其中GhCOI5-A06是能同时响应2种胁迫最强烈的基因,其表达量在NaCl胁迫下是对照的45.96倍,在PEG-6000胁迫下是对照的33.71倍。段龙飞[13]对拟南芥COI基因响应盐和干旱胁迫的研究显示:拟南芥COI基因表达模式不同于棉花COI基因,如AtCOI4在2种胁迫中表达量均量下调趋势,而AtCOI5在盐胁迫下表达量下调,在干旱胁迫下表达量上调。这可能是不同植物在自然界所处生境不同,它们在各自进化过程中一些信号途径的某些节点可能发生了分歧。由此推测,陆地棉GhCOI基因家族在进化过程中,为适应外界环境变化而分化出不同的家族成员[27]。
综上所述,在基因进化过程中,亲缘关系较近的基因结构和保守基序数量、类型都极为相似,且均有共线性关系,而基因复制为基因家族的扩增提供了原动力,并对不同基因执行同一功能提供了可能性。GhCOI基因的系统发育和表达模式将为基因功能提供更全面的理解,为陆地棉GhCOI家族基因响应非生物胁迫调控机制的研究奠定了基础,为棉花抗逆育种提供了潜在的基因资源。今后还需进一步深入研究GhCOI基因如何发挥特殊功能。
