猪肺炎支原体疫苗免疫母猪的研究进展
2022-06-13胡群山王科文
吴 竞,胡群山,王科文
[硕腾(上海)企业管理有限公司,上海 长宁 200050]
猪支原体肺炎(Mycoplasmal pneumonia of swine, MPS)是由猪肺炎支原体(Mycoplasma hyopneumoniae, Mhp)引起的一种以咳嗽、气喘为主要症状的慢性、消耗性传染性疾病,又称为猪喘气病或猪地方流行性肺炎(Enzootic pneumoniae,EP)。猪支原体肺炎的特征为发病率高、死亡率低、对生产性能影响大(生长速度缓慢、平均日增重和饲料转化率降低、出栏时间延长)。猪肺炎支原体通过定殖于气管、支气管和细支气管上皮细胞的纤毛,造成纤毛的损伤和缺失,导致纤毛功能停滞和上皮细胞的破坏,同时抑制先天性免疫反应,中性粒细胞和巨噬细胞的吞噬能力降低,削弱了机体对病原的清除能力,增加了呼吸道对其他细菌和病毒继发感染的易感性,比如猪肺炎支原体通常和猪圆环病毒2型、猪繁殖与呼吸综合征病毒、多杀性巴氏杆菌、胸膜肺炎放线杆菌等混合感染,共同形成猪呼吸道病综合征(Porcine respiratory disease complex, PRDC)[1]。
通常根据临床症状表现时间认为,猪支原体肺炎主要发生在生长肥育阶段,但其实不同品种、年龄、性别的猪均可感染猪肺炎支原体,全球超过70%的猪群感染猪肺炎支原体[2]。在全球各地的猪群中,产房仔猪的阳性率可达到0.5%~13%,断奶仔猪为0~60%,肥育猪为0~100%,母猪为24%~65%,所以猪肺炎支原体无处不在,它的长期存在和流行困扰全球各地养猪业的健康发展,且一旦发生感染,很难彻底清除。
猪肺炎支原体的疫苗接种已被证明是控制猪支原体肺炎的有效工具。控制仔猪早期感染是防控猪支原体肺炎的关键,已有大量的实验室试验和田间试验证明了给仔猪接种猪肺炎支原体疫苗(7~21日龄)可有效控制早期感染,提升保育和肥育猪生产性能表现。但是1~2胎妊娠母猪是非常重要的传染源,很多猪场忽视了后备母猪和年轻母猪的疫苗免疫[1]。因此,本文从母猪在猪支原体肺炎流行病学中的角色、猪肺炎支原体疫苗免疫母猪的理论基础及应用实践3个方面进行讨论,以探讨母猪免疫猪肺炎支原体疫苗的必要性。
1 母猪在猪支原体肺炎流行病学中的角色
1.1 猪肺炎支原体感染的流行病学
家猪和野猪是猪肺炎支原体已知的感染宿主,尽管疾病的临床表现主要出现在生长肥育阶段,但没有明显的基于年龄的易感性差异,在各年龄段猪的鼻腔和气管上皮中都能检测到猪肺炎支原体的定殖。感染猪和易感猪的紧密接触是猪肺炎支原体传播的主要途径,通常是鼻对鼻的接触。猪肺炎支原体可经空气短距离传播,Otake等研究表明[3],在感染猪场的9.2千米之外,还能在空气样本中检测到病原。猪肺炎支原体感染排菌可持续很长时间,感染后240天才不具备感染能力[4]。猪场内猪肺炎支原体持续感染的根源被认为在种猪群,因为连续引进后备母猪促成了猪肺炎支原体在感染母猪和易感母猪之间的传播。此外,由于猪肺炎支原体传播速度慢、感染时间长等特点,促进了其在猪场的循环。在试验条件下,根据不同的研究方法和菌株毒力,推算出的猪肺炎支原体传播率不同,比如在Meyns等、Villarrea等和Ross的研究中,R值(传染数)从0.56~1.47不等[5-7];在Beltlach等的研究中,将1头感染猪肺炎支原体的后备猪和29头猪肺炎支原体阴性后备猪关在一起饲养,8周后,28%(8/29)的阴性后备猪转阳,推算出来的传染率为每头阳性后备猪每周可以感染0.73头新的后备猪[8]。
1.2 母猪胎次和猪肺炎支原体传播的关系
在Calsamiglia等的研究中[9],如图1显示,后备母猪和低胎次母猪相比于高胎次母猪,猪肺炎支原体阳性率更高。在Fano等的研究中[10],也得到了相似的结论,他发现年轻母猪猪肺炎支原体的排毒率为32%,中等胎次母猪的排毒率是23%,高胎次母猪的排毒率是20%。同时,Fano等还证明了母猪胎次和断奶仔猪猪肺炎支原体阳性率存在显著相关性[11]。根据这样的结论,分胎次饲养成为疾病控制策略之一,将后备母猪、一胎母猪与二胎及以上的母猪分开饲养,且将第一胎的后代和二胎及以上的后代分为两个猪群流向,这样二胎以上母猪的后代将得到保护,并表现出更高的生产力。但需要注意的是,母猪的胎次和排毒没有必然的联系,没有科学依据证明猪肺炎支原体有年龄上的易感性差异[12]。
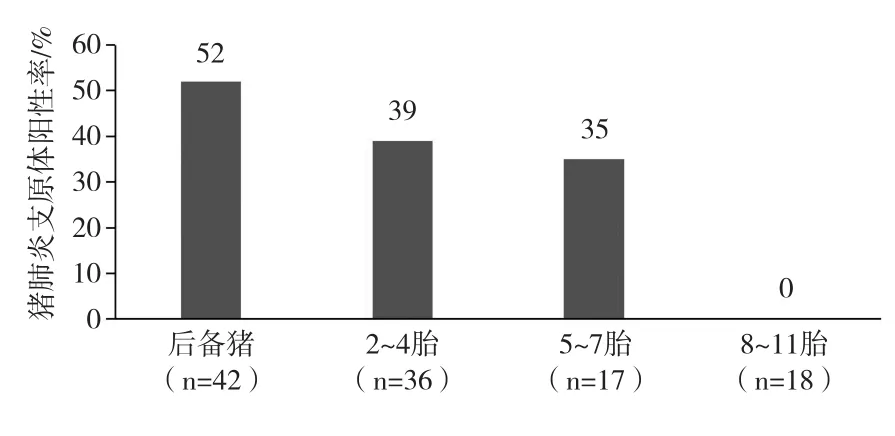
图1 不同胎次母猪的猪肺炎支原体阳性率
1.3 母猪向仔猪传播猪肺炎支原体的方式
猪肺炎支原体经子宫的垂直传播尚未得到证实,通常认为,仔猪第1次与猪肺炎支原体接触发生在哺乳期间,母猪通过鼻分泌物将猪肺炎支原体传染给仔猪。Pieters等评价了母猪断奶时猪肺炎支原体感染状态对断奶仔猪猪肺炎支原体定殖的影响[13],结果发现,如果产房母猪没有猪肺炎支原体感染,那么断奶仔猪的支原体定殖率非常低;而如果产房母猪猪肺炎支原体呈阳性,其仔猪在哺乳后期猪肺炎支原体的阳性率都很高。断奶前仔猪的猪肺炎支原体定殖也跟哺乳期的长短有关。Fano等的研究表明[10],仔猪断奶时的猪肺炎支原体的感染率决定了肥育期的临床表现和疾病严重程度,从图2中看出,断奶时的阳性率越低,上市时肺部病变越少,反之,断奶时阳性率越高,上市时肺部病变评分越高。Sibila等的研究也证明断奶时仔猪猪肺炎支原体的定殖与生长猪的疾病严重程度呈正相关[14]。因此,这些研究说明了猪肺炎支原体控制的核心策略,就是要减少母猪到仔猪的传播和仔猪断奶时支原体的定殖。

图2 断奶时猪肺炎支原体阳性率与上市时肺部病变评分的关系
2 猪肺炎支原体疫苗免疫母猪的理论基础
2.1 疫苗的免疫保护机制
疫苗免疫是控制猪支原体肺炎的有效手段,目前广泛使用的疫苗主要是猪肺炎支原体灭活疫苗。商品化的猪肺炎支原体疫苗能够起到部分保护作用,但这种部分保护作用的机制还不完全清楚。
疫苗免疫后,可检测到血清中和呼吸道灌洗液中抗体水平的提升,提升的程度与疫苗组分、接种方式、免疫程序和动物健康状态有关。通常在免疫后的2~4周可以检测到抗体,且抗体可以在数周到数月内能被检测到。虽然早期研究表明,疫苗诱导的体液免疫和保护不相关,但抗体在保护中的作用仍需更进一步的研究。一般认为,胞内菌(如布氏杆菌、结核分枝杆菌)的获得性免疫保护机制主要是以T细胞为主的细胞免疫,胞外菌(如葡萄球菌、棒状杆菌)的免疫保护主要是有特异性的体液免疫来介导的,但在胞外菌感染的过程中,Th1细胞亚群发挥的免疫应答作用也很重要。有一些其他的研究发现,猪只接种疫苗后,血液中和肺脏组织中的猪肺炎支原体特异性IFN-γ分泌细胞增多,说明局部和系统的Th1免疫反应被激活,细胞免疫在疫苗诱导的免疫保护中也起到重要的作用[15-17]。Marchioro等和Michiels等的研究表明[15-18],和不接种疫苗的试验猪相比,接种猪肺炎支原体疫苗的猪体内TNF-α、IL-6和IL-1β的表达水平较低,这些促炎性细胞因子跟淋巴样增生和肺部病变有关,且在支气管淋巴结中,检测到了更多的IL-10表达,IL-10是一种抗炎症细胞因子。Vranckx等证实了接种疫苗可以减少试验感染猪的支气管相关淋巴组织中的巨噬细胞浸润[19]。这些研究表明,接种猪肺炎支原体疫苗可以影响促炎和抗炎细胞因子的分泌,调节免疫细胞浸润,以减少肺部病变。但炎症反应的降低也可能是细菌定殖减少的结果。因此,Mhp灭活疫苗既可以刺激机体产生体液免疫,也可以提升细胞免疫水平。
有大量的文献和数据证明,用现有的猪肺炎支原体疫苗免疫仔猪效果明显,能够提高动物福利、降低因猪肺炎支原体感染引起的生产性能损失(提高日增重2%~8%、提升饲料转化率2%~5%、降低死亡率)、在更短的时间内达到上市重、减少上市重的差异、减少呼吸道中猪肺炎支原体病原的数量、降低猪群感染水平、减少临床症状(咳嗽)、降低流行率和病变程度、减少治疗费用[1]。当然,疫苗的效果除了跟疫苗本身的质量有关,还跟猪群接种疫苗时的应激程度和其他PRDC病原共感染的程度以及从母体获得的母源免疫力有关。
2.2 母猪免疫后体液免疫的传递
母猪免疫猪肺炎支原体疫苗后,可以通过母乳将母源抗体传递给仔猪,已经在很多研究中得到证实[20-24]。在Bandrick等的研究中[25-26],也证实了仔猪可通过母乳获得母源猪肺炎支原体抗体,而且若将仔猪寄养给另一头母猪哺乳,被寄养的仔猪同样可以吸收寄养母猪来源的抗体;但是对于细胞免疫,只能通过母猪本体传播,母猪的细胞免疫只能传递给自己分娩的仔猪,对于寄养的仔猪,这种细胞免疫的传递则没有被检测到。
2.3 母猪免疫后细胞免疫的传递
尽管细胞免疫在猪肺炎支原体免疫保护中可能起到很重要的作用,但关于母猪是否可以将母源细胞免疫传递给仔猪的研究还不多。在Biebaut等的研究中[27],选取了6头免疫猪肺炎支原体疫苗的母猪和它们母乳喂养的47头仔猪(其中有24头寄养仔猪),疫苗接种在产前6周和产前3周进行;同时从猪支原体肺炎阴性母猪群中选取了3头没有免疫猪肺炎支原体疫苗的母猪和它们的24头仔猪。试验检测了母猪血液、初乳、仔猪血液中由不同T细胞亚群产生的TNF-α、IFN-γ和IL-17A的表达水平。结果显示:母猪免疫猪肺炎支原体疫苗之后,T细胞免疫反应迅速升高,同样,在2日龄仔猪的血液里也能检测到猪肺炎支原体特异性T细胞。相反的是,在对照组中未发现特异性的猪肺炎支原体细胞因子。在该研究中,寄养对猪肺炎支原体特异性IgG和IgA的传递没有影响,这和2.2的研究结果一致,但不同的是,该试验中,母猪免疫猪肺炎支原体疫苗后,寄养猪获得的猪肺炎支原体特异性细胞免疫水平与非寄养猪差异不显著。这个研究证实了细胞免疫的传递,不同的猪肺炎支原体特异性细胞亚群可以从母猪传递给仔猪。寄养对细胞免疫传递的影响还需要更多的试验来证实,而且这种传递的细胞免疫在预防猪肺炎支原体感染时起到的保护作用还有待研究。
3 猪肺炎支原体疫苗免疫母猪的实践
临床中母猪免疫猪肺炎支原体疫苗的频率比较低。欧美市场说明书上标注可以给母猪免疫的疫苗屈指可数,关于母猪免疫猪肺炎支原体疫苗的临床应用研究报道也很少(表1)。但是随着人们逐渐认识到母猪免疫的重要性,给母猪接种疫苗的频率正在增加。

表1 猪肺炎支原体疫苗在母猪上的应用研究
3.1 猪肺炎支原体疫苗免疫母猪的临床应用
在妊娠末期给母猪接种疫苗的目的是减少猪肺炎支原体从母猪向其后代排毒,并通过母源性免疫为仔猪提供保护。Wallgren等的研究表明[21],母猪的血清抗体在妊娠的最后1个月开始下降,因此建议至少在预产期前4周给母猪接种疫苗。母源抗体可以给仔猪提供针对猪肺炎支原体感染的部分保护,减轻病原引起的临床症状和支原体样肺部病变。Morris等发现[20],在猪肺炎支原体母源抗体水平不同的仔猪中,高、中、低水平的母源抗体分别在仔猪63日龄、45日龄和30日龄衰减。Vranckx等[19]和Takeuti等[23]认为母猪免疫能够减少整体猪群的感染压力,降低细菌感染的载量,从而减少对仔猪的传播。Sibila等[14]和Arsenakis等[24]的研究结果显示,在妊娠后期免疫母猪,可以减少仔猪在断奶时猪肺炎支原体的定殖。而且无论是一点式的生产猪群[28]还是多点式生产的猪群[22,29],在妊娠末期给猪群接种疫苗,断奶仔猪感染猪肺炎支原体的数量减少,肥育猪屠宰时出现支原体样肺部病变数量减少。Sibila等在西班牙的一个母猪场[14],取50头分娩前5周的母猪,分为两组,第1组25头免疫猪肺炎支原体疫苗,母猪分娩后,跟踪母猪所产仔猪到出栏屠宰,对照组的25头母猪不免疫,结果显示,经免疫母猪所产的猪在出栏屠宰时肺部病变评分为0分的比例为48%(48/100)、评分为1~5分的比例为41%(41/100)、评分为6~10分的比例为7%(7/100);未经免疫母猪所产的出栏猪屠宰后肺部病变评分为0分的比例为29%(28/98)、评分为1~5分的比例为48%(47/98)、评分为6~10分的比例为19%(19/98),该结果说明了母猪免疫猪肺炎支原体疫苗,可显著减轻肥育猪的肺部病变。但在临床上,免疫母猪所产的仔猪仍可能受到感染,因此有必要在保育和肥育阶段采取其他措施控制猪肺炎支原体感染。在猪肺炎支原体感染压力较大的猪场或当母猪群出现临床症状时,可同时给所有种猪群接种疫苗,使所有的猪群达到稳定统一的免疫力。
3.2 猪肺炎支原体疫苗用于后备母猪驯化
3.2.1 用疫苗驯化后备母猪的意义 大量、频繁地引入未经驯化的后备母猪是母猪场猪支原体肺炎控制困难的一个主要因素,后备母猪的更新对猪肺炎支原体阳性猪场的稳定具有重要的意义[23,30]。后备母猪的免疫结合科学的饲养管理有助于猪只产生对猪肺炎支原体感染的免疫应答[2,31]。如将阴性后备母猪或未知感染状态的后备母猪混入感染猪肺炎支原体的猪群,建议给这部分新引进的后备猪进行猪肺炎支原体疫苗的免疫,因为疫苗免疫可以使得整体猪群的免疫力均一,避免因种猪群免疫力不一致而引起的疾病传播[32],接种疫苗能够提高后备母猪及其后代的免疫应答水平。
在Betlach等的研究结果中[33],将32头3周龄的猪肺炎支原体阴性后备母猪分为4组,第1组4头猪先免疫后攻毒(A4),4头猪只免疫(B4),之后将A4和B4放在一起饲养;第2组4头猪先免疫后攻毒(C4),4头猪不免疫(D4),之后将C4和D4放在一起饲养;第3组4头猪只攻毒(E4),4头猪只免疫(F4),将之后E4和F4放在一起饲养;第4组4头猪只攻毒(G4),4头猪不免疫(H4),之后将G4和H4放在一起饲养。结果显示,攻毒后,A4和C4猪的细菌载量明显少于E4和G4,验证了猪肺炎支原体疫苗在减少细菌定殖方面的作用;每组内的猪混养后,D4、F4和H4猪中都有1~2头感染了猪肺炎支原体,只有B4猪一直保持阴性。这样的结果表明,在实际生产过程中,如果有部分猪只免疫后还是感染了猪肺炎支原体,但若后备猪群整体接种猪肺炎支原体疫苗,那病原菌的传播将会受到限制,群体感染压力减小,说明了猪肺炎支原体群体免疫的重要性。
3.2.2 国外猪场使用疫苗驯化后备母猪的情况 在一项对欧洲养猪场的调查中[34],由18个国家的108位兽医收集了321份猪场调查问卷,主要调查了各个猪场猪支原体肺炎的感染状态、后备猪的健康状态、后备猪的驯化策略以及驯化结果的评估方法等。调查显示,在欧洲,大部分的后备猪来自外部且猪场了解后备猪的健康状态,这部分后备猪大多呈猪肺炎支原体血清阳性,但只有28%的猪场用ELISA的方法再次确认。大多数的猪场都会选择做猪肺炎支原体的驯化,最常用的方法是只接种疫苗(58%),在驯化期间接种1次或2次疫苗最为常见。第2种常见的方法是疫苗接种结合感染猪的自然暴露。在所有采取驯化措施的猪场中,只有25%的猪场验证了驯化的效果,采取ELISA和PCR的方法。而在北美后备猪的驯化同样也被认为是非常重要的。在美国[35]和墨西哥[36]的猪场调查中,分别有72%和75%的猪场设有后备培育舍(gilt development units, GDUs)用来实施猪肺炎支原体的驯化,后备猪的免疫是驯化的主要方式,其他的方式包括猪肺炎支原体的自然暴露,或者两种方式的结合。也有用感染的淘汰母猪或者感染的仔猪接触后备母猪,从而达到驯化的目的[35,37],但考虑到猪肺炎支原体在猪与猪之间的传播速度很慢,所以感染动物与易感动物的比例、感染动物暴露的时间是达到有效暴露的重要参数。
3.2.3 用疫苗驯化后备母猪的免疫程序 对母猪和后备母猪的疫苗免疫,免疫剂量、次数、时间以及疫苗带来的经济效益,目前还没有标准的答案。尽管有许多不同的疫苗免疫接种方案可用,但目前还没有公开研究表明,哪种免疫方案比另一种更有优势。在Garza-Moreno等的一项研究中[38],将180头猪肺炎支原体阴性后备猪引入到猪肺炎支原体阳性母猪场的后备培育舍,试验分为3组,第1组在引入后的第2、4、6、8周分别接种一针猪肺炎支原体疫苗(共4次),第2组在引入后的第2、4周分别接种猪肺炎支原体疫苗(共2次),第3组为对照组,不接种疫苗。结果显示,引入后14周,第1组和第2组的猪肺炎支原体阳性率(3/120,3%)显著低于第3组(27/60,45%);整个试验阶段,第1组和第2组的后备猪血清抗体水平都显著高于第3组,而且第3组从引入后1周到引入后34周的抗体阳性率出现了衰减,说明疫苗免疫比自然感染能够提供更持久的体液免疫保护;第1组和第2组分娩仔猪的抗体水平也显著高于第3组分娩的仔猪。但第1组和第2组在数据上差异不显著,也就是说4次接种和2次接种的驯化方案结果差异不大,因此没有必要接种2针以上的疫苗。
3.3 猪肺炎支原体疫苗用于猪肺炎支原体的净化
净化猪群中的猪肺炎支原体是控制猪肺炎支原体感染最根本的方法,全球各地采取了不同的净化方案,包括了清群/再建群、瑞士减群法(部分清群)、封群和药物治疗、不封群的全群用药方案等。比如在封群和药物治疗方案原则中,关键原则有:确认所有母猪(包括后备母猪)都感染过猪支原体肺炎;封群至少8个月,根据临床观察和实验室检测结果,在确认所有母猪感染猪支原体肺炎后,开始封群,使母猪形成免疫力,并使其停止排毒;每个季度给整个猪群接种猪肺炎支原体疫苗,以提高猪群免疫力;在引入猪肺炎支原体阴性后备猪之前,对整个母猪群和仔猪群进行抗菌药物处理[39]。在不封群全群用药的净化方案中,同样也对母猪进行疫苗接种,这样可以降低呼吸道中猪肺炎支原体的载量、降低猪群感染压力、减少病原体的垂直传播、给仔猪提供免疫力。
4 总结
对猪肺炎支原体感染的控制可通过优化猪场管理方式、饲养环境和生物安全措施来实现,包括全进全出、后备母猪驯化、稳定的猪群免疫、最佳的饲养密度和环境控制等,都可以减少猪肺炎支原体在猪场内的传播。程序性或脉冲式的抗生素给药,可用于猪支原体肺炎的治疗。抗生素可以帮助减少感染,但不能预防感染,同时抗生素最主要的问题是耐药性和残留的风险。疫苗免疫已成为控制猪支原体肺炎的有效手段,在世界范围内已被广泛应用。目前全球绝大多数的商品化疫苗均为灭活疫苗,仅在中国和墨西哥有获批的弱毒疫苗,弱毒疫苗需要在胸腔或肺内注射,受限于操作难度较高,因此目前普及率不高。猪肺炎支原体灭活疫苗免疫的确切机制尚不完全清楚,疫苗不能完全阻断猪肺炎支原体的传播,不能阻止野毒的定殖,对临床肺炎不能提供完全保护,但安全可靠且效果优良的猪肺炎支原体疫苗在一定程度上能减少呼吸道中病原的含量,大幅度减轻猪肺炎支原体感染猪的临床症状和肺部病理损伤程度,提高日增重和饲料转化率,降低治疗成本,有时还能降低死亡率。因此,猪肺炎支原体疫苗得到了广泛的应用。在疫苗接种过程中,需要根据猪群类型、繁育系统、管理模式、感染情况以及生产者的接受程度等,采取不同的疫苗接种策略。
仔猪早期感染是免疫失败的主要原因,而早期感染的最大来源是不稳定的母猪群,尤其是驯化不足的后备母猪,因此要在做好后备母猪的驯化和免疫,使后备母猪产下第一胎之前获得对猪肺炎支原体的抵抗力,并且能减少向仔猪的排菌。除此之外,也建议做好低胎次母猪的免疫,减少仔猪在产房中被母猪早期感染的风险。
