十二指肠灌注色氨酸对绵羊门静脉血浆中褪黑素和色氨酸代谢产物浓度的影响
2022-06-13李凤鸣王彩蝶李晓斌张仕琦张文杰杨开伦
潘 军,李凤鸣,王彩蝶,李晓斌,张仕琦,张文杰,杨开伦*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830035;2.阿克苏职业技术学院,新疆阿克苏 843000)
褪黑素(Melatonin,MT)在机体内具有调控睡眠、增强机体抗氧化能力、提高免疫力、抗菌抗炎、抑制肿瘤和癌细胞等广泛的生物学作用。在畜牧生产中MT具有调控动物繁殖、提高动物产绒量和绒毛质量、提高蛋鸡产蛋性能、降低奶牛体细胞数和乳房炎等作用。目前在畜牧业生产中主要通过改变饲养环境光照周期和时间,埋植、静脉注射、腹腔注射MT及静脉注射、腹腔注射、口服前体物质色氨酸(Tryptophan,Trp)等方式来提高动物机体MT 水平,众多方法中口服或补饲Trp 可能是简便易行的操作方法。不同动物补喂或口服不同水平Trp 是否能提高动物机体5-羟色胺(Serotonin,5-HT)的水平尚存在争议。并且通过不同灌注模式给牛皱胃灌注50 mg/kg 体重(BW)的Trp,发现颈静脉血浆和血清中5-HT 浓度存在较大差异。然而上述Trp 调控机体MT 的研究中测定的均是动物颈静脉血中MT 浓度,颈静脉血主要反映大脑和松果体中合成的MT 回流至颈静脉中,大脑和松果体中MT 的合成具有明显的昼夜节律性。前人研究表明,除松果体外,肠道中也含有大量MT,约为松果体中400 倍。然而肠道中MT 合成是否具有节律性,前体物质Trp 能否提高肠道MT 合成等问题仍需深入研究。本试验旨在揭示Trp 对绵羊肠道MT 浓度的动态变化规律的影响,为畜牧业生产中通过饲喂Trp 的方式调控MT 提供理论基础。
1 材料与方法
1.1 试验材料-色氨酸(新疆阜丰生物科技有限公司)的纯度≥98%。
1.2 试验时间和地点 试验于2019 年11 月2 日至11月20 日在新疆昌吉惠康畜牧有限公司进行,试验期间当地日出时间为08:50—09:05,日落时间为18:50—18:40,外界环境温度为-2~8℃,圈舍内温度为10~15℃。
1.3 试验设计 选用4 只10~12 月龄、体重(37.92±1.35)kg的哈萨克绵羊母羊,先安装十二指肠瘘管恢复2 个月后,再安装肝门静脉血管插管恢复15 d 后,按照自身对照试验设计进行3 期灌注试验,设为对照组(n=4)、1.2 g 灌注组(n=4)、4.8 g 灌注组(n=3)每天分别灌注含0、1.2、4.8 g/d 的Trp 生理盐水溶液700 mL。灌注试验按照从低浓度到高浓度的顺序实施,每次同时用4 只羊灌注1 种浓度,用20 滴/mL 的输液器改装成灌注管,700 mL 灌注溶液每天分2 次灌注,每次灌注时长为(660±20)min,设置灌注速度为9.7 滴/min(即29.17 mL/min)。
1.4 饲养管理 试验绵羊单栏饲养、自由饮水,参照NRC(2007)肉羊饲养标准配制试验羊日粮配方,试验羊日粮配方及营养成分见表1。试验羊按照精粗比5:5 进行饲喂,每只羊每天饲喂精料为600 g/d(粗蛋白质20.48%)、苜蓿青干草为400 g/d(粗蛋白质15.62%)、麦秸为200 g/d(粗蛋白质为5.64%)。粗饲料粉碎至2~3 cm 并按比例混合,每天分别于08:00、20:00 饲喂,并同时进行十二指肠灌注,日粮采用定量饲喂方式进行饲喂,以保证每只羊采食30 min 后料桶无剩料。
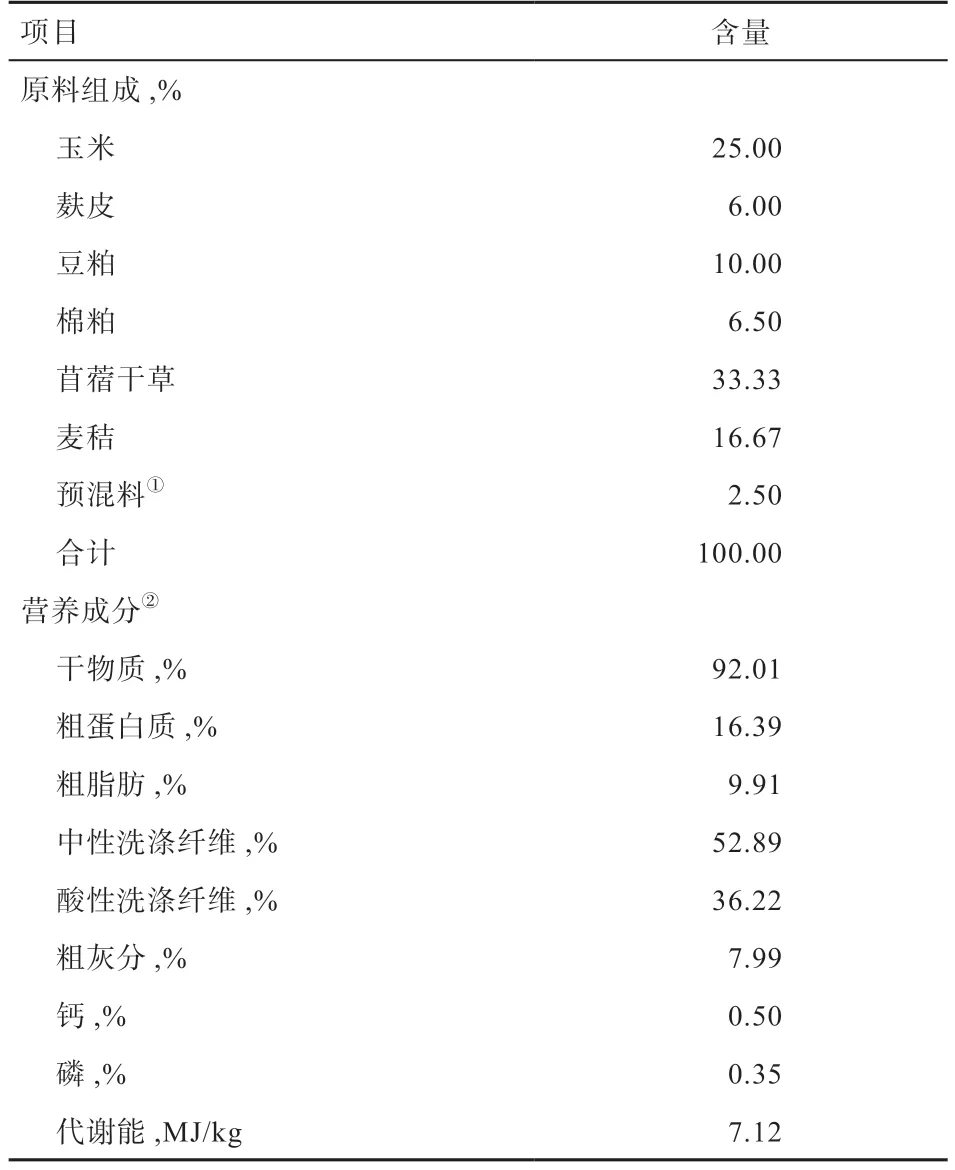
表1 日粮组成及营养成分(风干基础)
1.5 指标测定 试验连续灌注3 d,于第4 天用肝素钠抗凝管采集试验羊肝门静脉全天08:00、09:00、10:00、11:00、12:00、13:00、14:00、17:00、20:00、21:00、22:00、23:00、00:00、01:00、02:00、05:00 共16 个时间点血液,用离心机3 500 r/min 离心15 min,吸取上清血浆到2 mL 冻存管中,置于冰箱-20℃保存待测。试验羊血浆中MT 和5-HT 由北京华英生物技术研究所用酶免法测定,酶联免疫试剂盒为北京华英生物技术研究所产品,酶标仪为华卫德朗DR-200BS。试验羊血浆中Trp和犬尿氨酸(Kynurenine,Kyn)参照Zhang 等方法用高效液相色谱法测定,色谱柱为(150 mm×4.6 mm,5 µm),流动相为15 mmol/L 醋酸钠溶液和乙腈(95:5,v/v),犬尿氨酸测定波长和出峰时间为360 nm,4 min以内,色氨酸测定波长和出峰时间为278 nm,6 min 以内。
1.6 统计分析 试验数据用Excel 进行整理,用SPSS 21.0 软件对各组血浆中MT、5-HT、Trp、Kyn 进行比较均值的单因素ANOVA 分析,差异显著者采用Duncan's 法进行多重比较。
2 结果
2.1 灌注不同剂量Trp 对绵羊门静脉血浆MT 的影响由图1 可知,08:00 饲喂后和20:00 饲喂后,对照组绵羊门静脉血浆中MT 浓度均有提高趋势;4.8 g 灌注组绵羊门静脉血浆中MT 浓度在17:00、20:00、21:00、22:00、23:00、0:00、01:00 均高于对照组(<0.01)。由表2 可知,与对照组相比,1.2 g 灌注组绵羊门静脉血浆MT 的总体均值低于对照组(>0.05),但4.8 g 灌注组绵羊门静脉血浆总体均值高于对照组(<0.01)。1.2 g灌注组绵羊白天门静脉血浆中MT 浓度低于对照组和4.8 g 灌注组(<0.05),但4.8 g 灌注组绵与对照组差异不显著。4.8 g 灌注组绵羊夜间门静脉血浆中MT 浓度高于1.2 g 灌注组和对照组(<0.01),1.2 g 灌注组与对照组差异不显著。由此说明,对照组绵羊门静脉中MT 浓度没有明显的昼夜节律,采食会引起绵羊门静脉MT 浓度提高,4.8 g 灌注组明显提高了绵羊门静脉血浆中MT 浓度和夜间门静脉血浆MT 浓度。
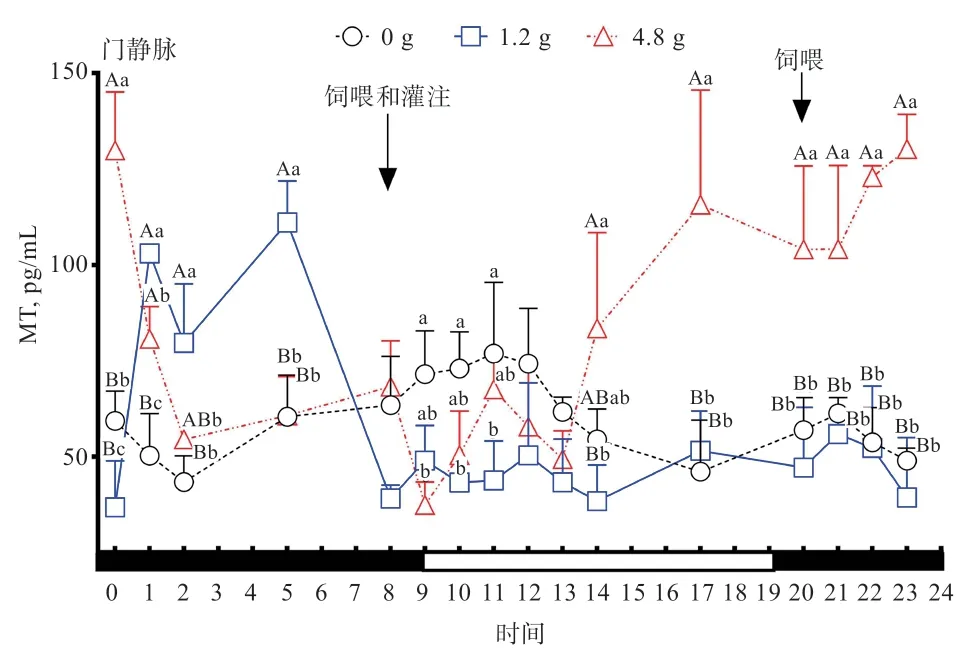
图1 灌注不同剂量Trp 对绵羊门静脉血浆MT 浓度的影响
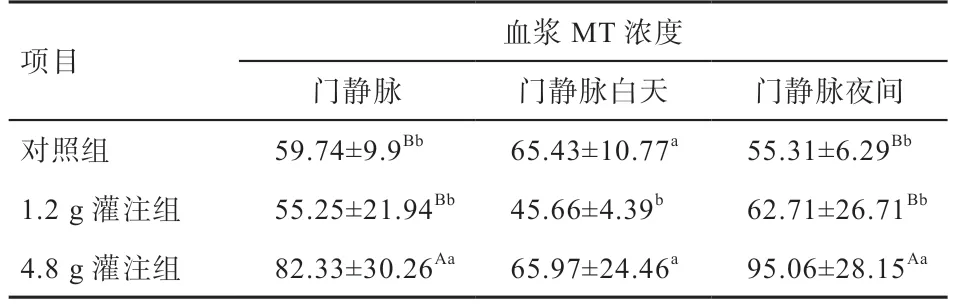
表2 灌注不同剂量的Trp 对绵羊门静脉血浆MT 浓度的影响 pg/mL
2.2 灌注不同剂量Trp 对绵羊门静脉血浆5-HT 的影响由图2 可知,对照组绵羊门静脉血浆中5-HT 浓度表现为10:00—14:00 高 于21:00—05:00(<0.01),对 照组绵羊门静脉血浆中5-HT 浓度没有明显的昼夜节律,白天饲喂后4 h 内有提高趋势;4.8 g 灌注组绵羊门静脉血浆中5-HT 动态时间点浓度在11:00、14:00、17:00、20:00、21:00、22:00、23:00、00:00、05:00 均高于对照组(<0.01)。与对照组相比,1.2 g 灌注组绵羊门静脉血浆总体5-HT 浓度(>0.05)、白天5-HT 浓度均值(<0.05)、夜间5-HT 浓度均值(>0.05)均低于对照组。4.8 g 灌注组绵羊门静脉血浆总体5-HT 浓度、夜间5-HT 浓度均值均高于对照组(<0.01),白天门静脉血浆5-HT 浓度与对照组差异不显著。由此说明,对照组绵羊门静脉中5-HT 浓度表现出白天饲喂后高于夜间,4.8 g 灌注组明显提高了绵羊夜间门静脉血浆中5-HT 浓度。
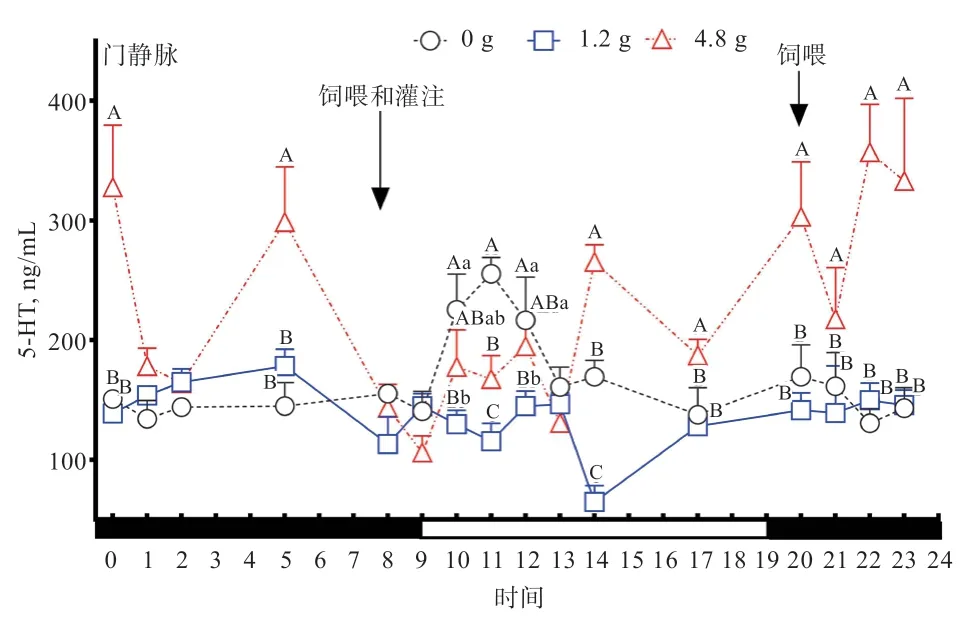
图2 灌注不同剂量Trp 对绵羊门静脉血浆5-HT 的影响
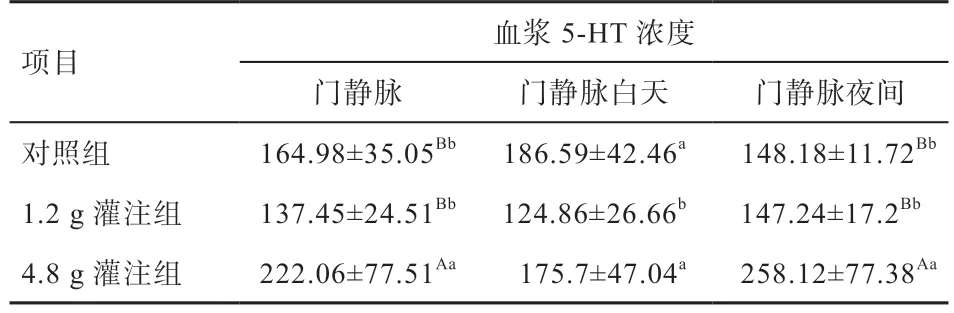
表3 灌注不同剂量的Trp 对绵羊血浆5-HT 的影响 ng/mL
2.3 灌注不同剂量Trp 对绵羊门静脉血浆Trp 和Kyn 的影响 由图3 可知,对照组绵羊门静脉血浆中Trp 浓度无明显的昼夜节律;饲喂Trp 后,无论白天和夜间都表现出绵羊门静脉血浆中Trp 浓度开始降低,在饲喂后4 h开始升高。由表4 可知,1.2 g 和4.8 g 灌注组绵羊门静脉血浆中Trp 总体浓度均高于对照组(<0.01),1.2 g灌注组绵羊门静脉血浆白天和夜间Trp 浓度均值均高于对照组(<0.05),4.8 g 灌注组绵羊门静脉血浆白天和夜间Trp 浓度均值均高于对照组(<0.01)和1.2 g灌注组(>0.05)。白天和夜间门静脉Trp 浓度均随着灌注剂量的增加而增加,白天和夜间的门静脉Trp 浓度无明显差异。由此说明,通过十二指肠灌注Trp 能提高绵羊门静脉血浆中Trp 浓度,并且绵羊门静脉血浆中Trp 浓度随着灌注剂量的提高而随之提高。
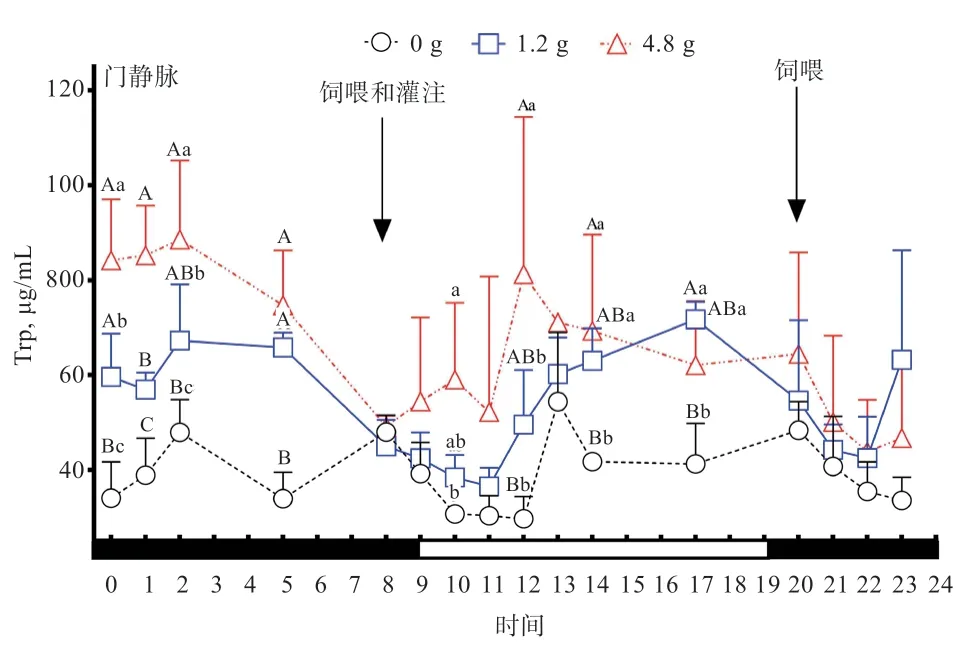
图3 灌注不同剂量Trp 对绵羊门静脉血浆Trp 的影响
由图4 可知,对照组绵羊门静脉血浆中Kyn 浓度无明显的昼夜节律,在全天各个时间段变化幅度都不大。由表4 可知,1.2 g 灌注组绵羊门静脉血浆中Kyn 总体浓度和白天Kyn 浓度均值均高于对照组(<0.05),夜间Kyn 浓度均值高于对照组(>0.05)。4.8 g 灌注组绵羊门静脉血浆中Kyn 总体浓度、白天Kyn 浓度均值和夜间Kyn 浓度均值均高于对照组(<0.01)和1.2 g灌注组(<0.01)。对照组、1.2 g 和4.8 g 灌注组Trp和Kyn 浓度在白天和夜间均无明显差异,门静脉中Kyn 浓度变化规律与Trp 相同。由此说明,通过十二指肠灌注Trp 能提高绵羊门静脉血浆中Kyn 浓度,且绵羊门静脉血浆中Kyn 浓度也随Trp 灌注剂量的提高而提高。
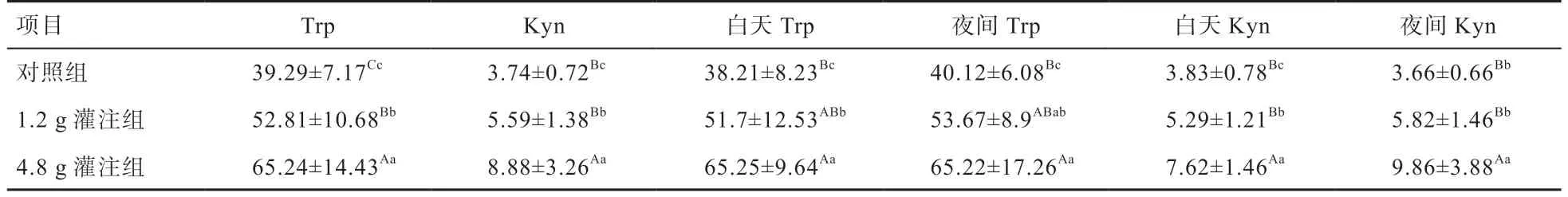
表4 灌注不同剂量的Trp 对绵羊门静脉血浆Trp 和Kyn 的影响 μg/mL
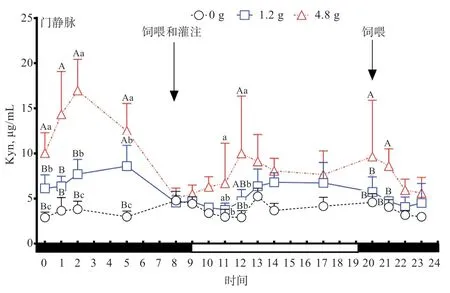
图4 灌注不同剂量Trp 对绵羊门静脉血浆Kyn 的影响
3 讨论
3.1 灌注不同剂量Trp 对绵羊门静脉血浆MT 的影响本试验通过十二指肠灌注Trp 提高了4.8 g 灌注组门静脉血浆中MT 浓度。Trp 是合成MT 的前体物质,Trp在动物机体中首先在色氨酸羟化酶(TPH)的作用下转化成5-羟基色氨酸(5-HTP),因此TPH 在肠道和松果体分布和表达量可能是影响松果体和肠道MT 合成的主要因素。通过静脉注射、口服前体物质Trp均能提高动物颈静脉血液中MT 水平。然而关于增加机体Trp 剂量对人和动物门静脉血浆中MT 的研究极少,大多数研究集中在对机体颈静脉血浆MT 浓度的变化。Ma 等给山羊灌服瘤胃保护性Trp,提高了山羊血清中MT 水平,并且夜间血清MT 水平显著高于白天。Paredes 等给斑鸠饲喂125、300 mg/kg BW 的Trp均能提高白天和夜间斑鸠翅下静脉血清中MT 水平,并且夜间血清中MT 水平明显高于白天。但Herichová 等给鸡饲喂150 mg/kg BW 的Trp 提高了白天松果体中MT 水平,而白天和夜间血浆中MT 水平却没有明显变化。Sánchez 等给大鼠服喂125 mg/kg BW 的Trp 不仅能刺激MT 合成,并且能提高MT 峰值和促进峰值提前。但是,Esteban 等给大鼠服喂300 mg/kg BW 的Trp 仅提高了夜间血浆MT 水平,而白天血浆MT 水平降低。以上结果表明,Trp 调控动物机体MT 合成在不同品种动物之间存在一定差异,不同Trp 剂量水平对动物白天和夜间血液中MT 浓度的影响也不相同,动物血液中MT 浓度并没有随着Trp 剂量的增加而呈现出增加趋势或降低趋势,这一结果与本试验门静脉结果具有相似性。
肝门静脉汇集胃、脾脏、胰腺和肠道静脉进入肝脏的血液,能直接反映肠道吸收营养物质进入肠系膜静脉并最终汇入门静脉的情况。Huether 等给大鼠口服300 mg/kg BW 的Trp 同时结扎大鼠的门静脉,大鼠外周循环血液中MT 的提高幅度显著降低,此外大鼠灌服Trp 后10、20 min 门静脉血浆中MT 水平均约为颈静脉血浆MT 水平的4 倍,由此说明灌注Trp 在肠道中能迅速合成大量的MT。本试验中,1.2 g 组和4.8 g 组灌注剂量分别为32 mg/kg BW 和126 mg/kg BW,1.2 g灌注组门静脉MT 浓度显著低于对照组,但4.8 g 灌注组门静脉MT 浓度显著高于对照组,约为对照组的1.5倍。这种差异一方面可能与灌注剂量、灌注模式有关;另一方面可能与Kyn 合成反应中关键控制酶色氨酸2,3-双加氧酶(Tryptophan 2,3-Dioxygenase,TDO)和吲哚胺2,3-双加氧酶(Indoleamine 2,3-Dioxygenase,IDO)竞争共同底物Trp 有关,最终导致MT 合成途径Trp 代谢产物减少。本试验中,1.2 g 灌注组门静脉白天MT 浓度低于对照组,夜间与对照组无显著差异,白天灌注后MT 浓度较低与TDO 和IDO 竞争底物浓度有关,可能还与灌注初期未达到该2 种酶的饱和度也有关;而夜间门静脉血浆MT 浓度高于白天且与对照组无显著差异,可能与夜间大脑和松果体中合成了大量MT,导致整个机体血液循环系统中MT 浓度升高有关。Bubenik 等研究发现,猪门静脉血液中MT 浓度比肝动脉和后腔静脉高,门静脉血液MT 浓度的升高与采食有关,而与光周期无关,门静脉血液MT 浓度无昼夜节律性。本试验也显示,对照组绵羊门静脉血液MT 浓度无昼夜节律性。
3.2 灌注不同剂量Trp 对绵羊门静脉血浆5-HT 的影响 5-HT 作为大脑的神经递质,参与了大脑中许多功能,Trp 是合成5-HT 和MT 的前体物质。Mateos 等给大鼠连续7 d 口服125 mg/kg BW 的Trp,提高了大鼠白天和夜间颈静脉血浆中5-HT 水平。本试验中,4.8 g 灌注组也提高了门静脉血浆5-HT 浓度。同时,Trp 会引起动物大脑5-HT 水平的显著升高。松果体中5-HT 含量具有白天多夜间少的昼夜节律性,并且在夜间早期5-HT 浓度存在急剧增加的现象。但本试验结果显示,门静脉血浆5-HT 均值在白天显著高于夜间,4.8 g 灌注组增加了绵羊夜间门静脉血浆中5-HT 浓度,但是表现出高低起伏的波动变化。Esteban 等认为,口服Trp 后会增加夜间MT 的合成,而合成MT 的底物5-HT 也会增加。门静脉5-HT主要来源于肠道。Gershon 等报道,肠道黏膜嗜铬细胞中含有大量5-HT,认为在肠道中亚型肠道嗜铬细胞和血清素激活神经元合成了5-HT。此外,不同的灌注模式也会影响5-HT 浓度。每天1 次或2 次灌注同等剂量的Trp 均显著提高了牛颈静脉血清中5-HT 浓度,但对血浆中5-HT 浓度无提高趋势,24 h 持续灌注Trp 对颈静脉血清和血浆中5-HT 浓度提高幅度非常有限。本试验中,1.2 g 灌注组绵羊Trp 灌注量为32 mg/kg BW,灌注方式也是24 h 持续灌注,各个时间点门静脉血浆中5-HT 浓度与对照组相比不仅无提高趋势,反而低于对照组。机体摄入的Trp 除了用于合成蛋白质外,其余Trp 约95% 经Kyn 途径代谢,Trp 转化形成Kyn 过程的第一步反应也是关键性控制步骤由TDO 和IDO 催化完成,TDO 和IDO 的活性会随着Trp浓度的增加而提高,TDO 和IDO 活性的提高会促进Kyn 合成的增加,Kyn 合成增加会与5-HT 合成途径竞争相同的底物Trp,最终导致5-HT 的合成减少。因此,机体中Trp 浓度只有超过了TDO 和IDO 的饱和度,额外的底物才会用于合成5-HT。本试验中,白天开始灌注Trp 后1~4 h,1.2 g 和4.8 g 灌注组血浆中5-HT 浓度均低于对照组,可能与灌注初期未达到TDO和IDO 饱和度有关。
3.3 灌注不同剂量Trp 对绵羊门静脉血浆Trp 和Kyn 的影响 Trp 在动物体内的分解代谢主要有Kyn、吲哚乙酸、5-HT 和MT 共4 条途径,其中3 条途径都分解成为小分子物质。在成年哺乳动物中,机体摄入的Trp主要在肝脏中经Kyn 途径代谢(约95%),1%~2%在小肠中经5-HT 途径转化成MT,2%~3%在肠道和肝脏中转化成吲哚乙酸。在本试验中,增加绵羊肠道中Trp 剂量,绵羊门静脉中Trp 和Kyn 的浓度也增加,并且随着Trp 灌注剂量的增加,绵羊肝门静脉血浆中Trp和Kyn 浓度在白天和夜间均呈现出增加的趋势。给荷斯坦牛皱胃灌注Trp 的研究结果也显示,其颈静脉血浆和血清中Trp 和Kyn 浓度变化具有相似性,Trp 和Kyn浓度随着单次灌注剂量的增加而增加。本试验再次证明了Kyn 是Trp 的主要代谢产物,并由此说明Trp在绵羊肠道中大量被吸收,Kyn 大量被合成,且与昼夜节律无关。肝脏有合成Kyn 的所有酶,90%的Kyn 在肝脏中合成,5%~10% 的Kyn 在肝脏外的其他组织中合成。从本试验门静脉中Kyn 浓度可以看出,合成Kyn 的酶不仅存在于肝脏,在肠道中也存在。
4 结论
本研究结果表明,绵羊门静脉血中MT 的浓度呈现出白昼低、夜间和凌晨高的变化规律,白昼期间的浓度与采食有关,5-HT 浓度的变化规律与MT 相似;Trp灌注量为4.8 g 时显著提高了夜间绵羊门静脉血MT 和5-HT 浓度;绵羊门静脉血浆中Trp 和Kyn 浓度均随着Trp 灌注剂量的增加而提高。
