我国野生燕山葡萄VyUSP1基因抗逆功能的初步验证
2022-06-12高换超许雯雯井朋伟程珊珊侯小进李桂荣
高换超 许雯雯 井朋伟 程珊珊 侯小进 李桂荣
摘要:研究我国野生葡萄燕山葡萄(Vitis yeshanesis ‘Yanshan’)VyUSP1基因在转基因烟草不同逆境下的表达情况,选择从供试材料中克隆所获得的VyUSP1基因,利用重组法构建其载体,并用农杆菌介质为导体转化转基因烟草植株,获得USP转基因烟草植株,然后对转基因烟草植株进行不同逆境处理,并对该基因进行初步的功能研究。结果表明,在不同的逆境条件下,USP转基因烟草均具有一定的抗干旱能力,但是不具備抗寒能力。较高浓度NaCl、甘露醇、PEG-6000以及低温处理会抑制转基因烟草种子的萌发。而在不同浓度NaCl、甘露醇处理下,转基因烟草植株幼苗均比野生型(WT)植株幼苗的表现要好;不同浓度PEG-6000处理对转基因烟草幼苗生长的影响并不明显;但在低温处理条件下,转基因烟草植株幼苗全部死亡。植物在受到外界胁迫时VyUSP1基因的表达会上调,蛋白活性被激活之后,有助于提高植物的抗逆性,增强其环境的适应性,因此USP对逆境胁迫存在一定的抗性。
关键词:燕山葡萄;VyUSP1基因;转基因烟草;逆境胁迫;功能验证
中图分类号:S663.101 文献标志码: A
文章编号:1002-1302(2022)10-0159-07
普遍胁迫蛋白(universal stress protein,USP)是一种普遍存在于植物中的抗逆性相关蛋白,所有蛋白质至少含有1个USP结构域和其他催化基序,在特定的组织、器官和发育阶段或在不同的胁迫条件下差异表达[1-2]。USP属于自磷酸化丝氨酸和苏氨酸的磷酸蛋白,可作为三磷酸鸟苷(GTP)和腺嘌呤核苷三磷酸(ATP)的磷酸供体。
目前,在植物逆境分子生理研究中,都有克隆到USP基因的报道,在水稻、棉花、拟南芥等全基因组测序的情况下,很多物种中都发现并克隆到了USP基因[3-8]。USP在水稻中至少由10个基因编码,在拟南芥中由17个基因编码,并且都位于第5条染色体上。在亚细胞水平上,USP基因被定位存在于细胞质中,能够参与大量的胁迫应答反应[4-5]。Chou等研究发现,当细胞受到外界环境胁迫时,该基因的表达会明显上调,蛋白活性被激活,有助于提高其抗逆性,增强其适应性[6-7]。Udawat等研究发现,USP在海蓬子(Salicornia brachiata)耐盐胁迫中起着至关重要的作用;SbUSP基因主要通过清除转基因烟草细胞内的活性氧,显著提高了烟草的耐盐性[8]。在大豆植物中,黄姗等将克隆得到的大豆GmUSP1基因对其进行不同浓度的NaCl、脱落酸(ABA)、聚乙二醇(PEG)6000胁迫处理,分析发现耐盐品种和感盐品种对胁迫诱导响应时间和表达量存在差异,推测该基因可能参与逆境胁迫的应答调控[9]。Loukehaich从番茄基因组中克隆SlUSP1基因,通过表达模式分析发现该基因在植物中具有组织特异性,在盐、高低温、干旱及ABA逆境条件下候选基因被诱导[10]。赵莘对葡萄VpUSP基因的研究表明,该基因在与白粉病病菌互作过程中具有表达活性[11]。
我国是葡萄属植物的重要起源地之一,具有丰富的野生葡萄属种质资源,对野生葡萄资源抗逆机制的研究有重要意义,但关于葡萄USP基因在抗逆性方面的研究较少。本研究以我国野生燕山葡萄(Vitis yeshanensis ‘Yanshan’)为材料,克隆获得VyUSP1基因,转基因获得USP烟草植株,然后对转VyUSP1基因烟草植株进行不同逆境处理,对该基因抗逆功能开展研究,有助于探讨燕山葡萄中VyUSP1基因的功能,以期为燕山葡萄资源的利用提供一定的理论基础。
1 材料与方法
1.1 试验材料
供试材料为中国野生燕山葡萄、本氏烟草(Nicotiana benthamiana)。
试验地点为河南科技学院园艺园林学院分子生物学实验室;试验时间为2020年3—12月。
1.2 试验方法
1.2.1 燕山葡萄VyUSP1基因在烟草中的功能研究
1.2.1.1 构建植物表达载体pBI121-VyUSP1,将其导入根癌农杆菌GV3101。
(1)步骤1:VyUSP1基因的克隆。
总RNA的提取。采用Trizol方法提取葡萄叶片总RNA;取RNA 1 μg,用1.0%琼脂糖凝胶电泳检测总RNA的完整性,利用核酸蛋白检测仪检测其纯度及浓度。
相关基因片段的扩增。基因扩增体系体积为50 μL:分别加入2 μL模板、引物和dNTP;0.4 μL LA酶;5 μL 10×LA Buffer,最后加入ddH2O补齐50 μL。PCR程序:95 ℃预变性5 min;95 ℃变性 30 s,55 ℃退火1 min,72 ℃延伸1 min,变性至延伸步骤循环30次;72 ℃再次延伸10 min,16 ℃保持10 min,4 ℃保存。
扩增产物与克隆载体pMD18-T连接后转化至大肠杆菌DH5α感受态中,筛选阳性克隆进行测序鉴定。连接pMD18-T体系总体积为10 μL:扩增产物7.5 μL、pMD18-T 0.5 μL、10×T4 ligase Buffer 1 μL、T4 ligase 1 μL。需16 ℃连接2~5 h。转化流程:大肠杆菌DH5α感受态放在冰上4~5 min使其完全溶解之后将连接pMD18-T的连接液加入到感受态管中,静置30 min,42 ℃水浴2 min,取出后立即放冰上2 min。在无菌操作台中向感受态管中加入400 μL液体LB培养基,标记封口后放于37 ℃摇床上,160~200 r/min振荡1 h。取出后12 000 r/min离心2 min,去除部分上清液,剩余菌液吸打均匀,涂在LB固体培养基上,标记封口后在37 ℃条件下倒置培养14 h。
(2)步骤2:构建VyUSP1基因表达载体。
用限制性内切酶XbaⅠ和SmaⅠ酶切重组载体pBI121-G,分别回收目的片段和表达载体片段,用ExnaseⅡ 37 ℃连接30 min后转化至大肠杆菌DH5α感受态中,得到的菌液进行质粒提取后转化到根癌农杆菌GV3101中即可。酶切连接体系总体积为 40 μL:pB121-G 10 μL、BSA 4 μL、1×T Buffer 4 μL、XbaⅠ 1 μL、SmaⅠ 1 μL、ddH2O补齐至 40 μL。此体系37 ℃连接2 h。酶切连接体系总体积为40 μL:载体片段与扩增片段、ExnaseⅡ各0.5 μL、5×CEⅡBuffer 5 μL,ddH2O补齐至40 μL。37 ℃连接30 min。
(3)步骤3:利用农杆菌介导叶盘法转化本氏烟草。
转化流程:从无菌试管苗上分别剪取烟草叶片,切成0.5 cm×0.5 cm的叶块,MS培养基预培养 3 d;挑取单菌落,接种于含卡那霉素(Kan) 60 μg/mL、庆大霉素(Gent) 30 μg/mL 的LB液体培养基中,28 ℃、180 r/min振荡培养过夜;取 200 μL 新鲜菌液接种于20 mL LB培养基中培养至生长对数期,4 ℃、5 000 r/min 离心5 min;收集沉淀,并用MS液体培养基重悬沉淀,并置于28 ℃恒温摇床,200 r/min培育2 h(D600 nm=0.5);将预培养的叶片浸入准备好的农杆菌菌液中培养5 min,取出叶片,置于无菌滤纸上,除去叶盘表面多余的农杆菌菌液;将上述叶盘转入MS培养基,25 ℃黑暗条件下共培养2 d;将共培养后的叶片转入分化培养基MS+1.0 mg/L 6-苄氨基嘌呤(6-BA)+0.3 mg/L 萘乙酸(NAA)+25 mg/L 潮霉素(HygB)+500 mg/L 羧苄西林(Carb),25 ℃ 培养;待芽长到1.5 cm左右时,切下转移到生根培养基MS+0.3 mg/L NAA+25 mg/L HygB+500 mg/L Carb中,进行生根培养。
1.2.1.2 种子逆境胁迫处理
用NaCl、PEG-6000、甘露醇溶液和不同温度处理转基因烟草植株与野生型烟草植株T2种子。NaCl处理:0、150、300 mmol/L NaCl;干旱处理:0、150、300 mmol/L甘露醇;高渗透处理:对照、15%、30% PEG-6000;低温处理:4、-10、-20 ℃处理。然后分别在0~15 d统计种子的发芽率。发芽率=发芽种子数/种子总数×100%。
1.2.1.3 幼苗逆境胁迫处理
用NaCl、PEG-6000、甘露醇溶液和不同温度处理转基因烟草植株与野生型(WT)烟草植株幼苗。NaCl处理:0、150、300 mmol/L NaCl;干旱处理:0、150、300 mmol/L甘露醇;高渗透处理:对照、15%、30% PEG-6000;低温处理:4、-10 ℃处理。统计存活率,存活率=存活幼苗数/幼苗总数×100%。
1.2.2 燕山葡萄VyUSP1启动子功能验证 (1)构建燕山葡萄VyUSP1基因启动子的植物表达载体(所用载体为pBI121)。(2)利用叶盘法转化烟草。(3)转基因烟草植株幼苗的组织器官表达分析及对不同胁迫的响应;对根、茎、叶进行β葡萄糖苷酸酶(GUS)染色:幼苗分别用150 mmol/L NaCl、15% PEG-6000、150 mmol/L甘露醇进行GUS染色。(4)用GUS染色法验证转VyUSP1基因烟草植株成苗对渗透胁迫的响应。
2 结果与分析
2.1 USP启动子GUS染色
不同浓度NaCl处理的转基因烟草2、4、8、12、24 h 5个时间段中2、8、24 h均被染色,而WT幼苗均无染色表现;转基因烟草植株在甘露醇和PEG-6000不同浓度处理中的2、8 h条件下,观察发现转基因植株叶片均被染色;在4 ℃处理中转基因烟草植株叶片在2、4、8、12、24 h 5个时间段的染色情况与WT烟草幼苗的染色情况均无明显变化。根据以上情况综合分析表明,在NaCl处理中转基因植株叶片的染色情况表现比较明显,而其他处理中转基因植株叶片染色情况相对微弱。
2.2 轉基因烟草种子在不同逆境处理下的发芽率
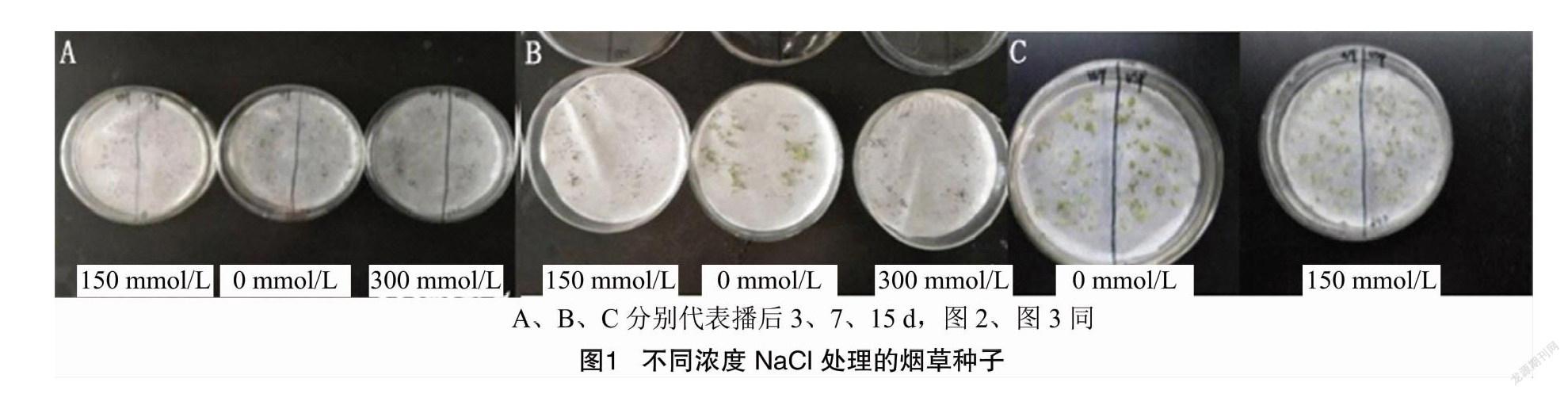
2.2.1 不同浓度NaCl处理对转基因烟草种子发芽率的影响 由图1、表1可以看出,种子播种在添加不同浓度NaCl的MS培养基上,培养0~15 d后,未添加NaCl处理的转基因烟草种子和WT种子发芽率均为100.0%。150 mmol/L NaCl处理3 d后的转基因烟草种子发芽率达到100%,处理7 d后的转基因烟草种子发芽率达到41%,处理15 d后的转基因烟草种子发芽率为33.3%。而300 mmol/L NaCl处理后的转基因烟草种子发芽率从3 d到15 d变化幅度较大,从20.0%降到了0。综上所述,转VyUSP1基因烟草种子在150 mmol/L NaCl处理下,时间越长发芽率越低;随着处理的NaCl浓度升高,转VyUSP1基因烟草种子发芽率也降低,说明盐胁迫浓度过高或者时间过长均对转VyUSP1基因烟草种子发芽不利。
2.2.2 不同浓度甘露醇处理对转基因烟草种子发芽率的影响
由图2、表2可以看出,种子播种在添加不同浓度甘露醇的MS培养基上,培养0~15 d后,未添加甘露醇处理的转基因烟草种子和WT种子发芽率均为100%。150 mmol/L甘露醇处理3 d后的转基因烟草种子发芽率达到100.0%,处理7 d后达到95.6%,处理15 d后为62.2%。而 150 mmol/L 甘露醇处理WT种子0~15 d后发芽率较低。300 mmol/L 甘露醇处理转基因烟草种子0~15 d后发芽率均低于150 mmol/L处理,说明较高甘露醇含量处理会抑制转基因烟草种子的萌发。
2.2.3 不同浓度PEG-6000处理对转基因烟草种子发芽率的影响
由表3可以看出,种子播种在添加不同浓度PEG-6000的MS培养基上,培养0~15 d后,未添加PEG-6000处理的转基因烟草种子和WT种子发芽率均为100%。15% PEG-6000处理3 d后的转基因烟草种子发芽率达到100%,处理7 d后达到26.7%,处理15 d后为20.0%。而15% PEG-6000处理WT种子0~15 d后发芽率较低30% PEG-6000处理转基因烟草种子发芽率均为0,说明较高PEG-6000含量处理会抑制转基因烟草种子的萌发。
2.2.4 低温处理对转基因烟草种子发芽率的影响
由图3、表4可以看出,种子播种在MS培养基上,低温培养0~15 d后,未低温处理的转基因烟草种子和WT种子发芽率均为100%。-10 ℃处理 3 d 后的转基因烟草种子发芽率为33.3%,处理7 d后下降为26.7%,处理15 d为0%。而-10 ℃处理WT种子0~15 d后发芽率均高于转基因烟草种子发芽率。-20 ℃条件下培养转基因烟草和WT种子发芽率均为0,说明温度低会抑制转基因烟草种子的萌发。
2.3 不同逆境处理对转基因烟草幼苗生长的影响
2.3.1 不同浓度NaCl处理对转基因烟草幼苗生长的影响
由图4可以看出,在150 mmol/L NaCl处理下WT植株幼苗和转基因植株幼苗的生长状况均出现了走向衰弱的趋势,但是转基因植株幼苗的生长势较旺盛,其综合情况要比WT植株幼苗的好;在300 mmol/L NaCl处理下WT植株幼苗株型矮小,生长势弱且叶片狭小而转基因烟草幼苗在这3个方面的状况均优于WT幼苗的状况,但两者均有继续生长的趋势。
2.3.2 不同浓度甘露醇处理对转基因烟草幼苗生长的影响
由图5可以看出,在150、300 mmol/L甘露醇2个处理中,转基因烟草植株幼苗的生长状况比WT植株幼苗的表现要好。
2.3.3 不同浓度PEG-6000处理对转基因烟草幼苗生长的影响
由图6可以看出,30% PEG-6000处理转基因烟草植株幼苗和WT植株幼苗均无生长迹象,并且在15%浓度处理下两者差异不明显。
2.3.4 不同低温处理对转基因烟草幼苗生长的影响
由图7可以看出,在4 ℃处理下,转基因烟草幼苗的生长势优于WT幼苗,在-10 ℃低温下,转基因烟草幼苗和WT幼苗全部死亡。
3 讨论与结论
应激蛋白是一种普遍存在于植物中的抗性相关蛋白,一般存在于细胞质中,在植物受到外界胁迫时表达上调,增强植物的抗逆性。葡萄容易受到盐碱、干旱等逆境危害,危害严重的会给葡萄生产造成巨大的经济损失。发掘葡萄种质的抗逆性基因,提高葡萄新品种的抗逆性是解决此问题的有效途径之一。本试验主要研究了我国野生葡萄燕山葡萄VyUSP1基因在转基因烟草不同逆境下的表达情况,结果发现VyUSP1基因比较抗盐和耐旱。陈莹等研究发现,高羊茅(Festuca arundinacea Schreb)逆境胁迫蛋白基因FaUSP的超量表达可以增强菊苣的抗旱能力,推测该基因与抗旱性相关[12]。刘峻玲等研究青杄(Picea wilsonii)PwUSP1基因时,发现在干旱和盐胁迫条件下,PwUSP1通过增强植物的活性氧(ROS)清除能力及抑制膜脂氧化损伤来提高植物对非生物胁迫的耐受性[13]。本试验研究结果均与这些研究结果一致,植物在受到外界逆境刺激后,通过系列信号分子调节相关抗逆基因和蛋白的表达,进而改变自身表观形态和生理生化水平来适应逆境[14-15]。在感觉到外部逆境刺激后,植物将外源信号导入细胞内下游信号通路,包括激活蛋白激酶或磷酸酶,刺激下游靶蛋白,以及植物激素的生物合成,以控制植物的生长发育[16-17]。特别是这些复杂信号交叉网络精确地调节了胁迫反应基因的表达,并保护植物免受外部胁迫[15,18-20]。
本试验以我国野生燕山葡萄为材料,克隆获得VyUSP1基因,利用重组法构建其载体,并用农杆菌介质为导体转化转基因烟草植株,获得USP转基因烟草植株。然后对转基因烟草植株进行不同逆境处理,探究该基因的抗逆性。研究结果表明,在不同的逆境条件下,USP转基因烟草均具有一定的抗干旱能力,但是不具备抗寒能力。较高浓度NaCl、甘露醇、PEG-6000以及低温处理会抑制转基因烟草种子的萌发。而在不同浓度NaCl、甘露醇处理下,转基因烟草植株幼苗均比WT植株幼苗的表現要好;不同浓度PEG-6000处理对转基因烟草幼苗生长的影响并不明显;但在低温处理的条件下,转基因烟草植株幼苗全部死亡。综上所述,USP转基因植株对逆境有一定的抗性,植物在受到外界胁迫时VyUSP1基因的表达上调,蛋白活性被激活,有助于提高植物的抗逆性,增强其环境适应性。
参考文献:
[1]Li W T,Wei Y M,Wang J R,et al. Identification,localization,and characterization of putative USP genes in barley[J]. Theoretical and Applied Genetics,2010,121(5):907 -917.
[2]Wang X F,Su J,Yang N,et al. Functional characterization of selected universal stress protein from Salvia miltiorrhiza (SmUSP) in Escherichia coli[J]. Genes,2017,8(9):224.
[3]Gustavsson N,Diez A,Nystrom T.The universal stress protein paralogues of Escherichia coli are co-ordinately regulated and co-operate in the defence against DNA damage[J]. Molecular Microbiology,2002,43(1):107 -117.
[4]Conrath U. Molecular aspects of defence priming[J]. Trends in Plant Science,2011,16(10):524-531.
[5]Petrov V,Hille J,Mueller-Roeber B,et al. ROS-mediated abiotic stress-induced programmed cell death in plants[J]. Frontiers in Plant Science,2015,6:69.
[6]Chou M X,Wei X Y,Chen D S,et al. A novel nodule-enhanced gene encoding a putative universal stress protein from Astragalus sinicus[J]. Journal of Plant Physiology,2007,164(6):764 -772.
[7]Freestone P,Nystr m T,Trinei M,et al. The universal stress protein,UspA,of Escherichia coli is phosphorylated in response to stasis[J]. Journal of Molecular Biology,1997,274(3):318 -324.
[8]Udawat P,Jha R K,Sinha D,et al. Overexpression of a cytosolic abiotic stress responsive universal stress protein (SbUSP) mitigates salt and osmotic stress in transgenic tobacco plants[J]. Frontiers in Plant Science,2016,7:518.
[9]黄 姗,王伟旗,侯文胜. 大豆Usp1基因的克隆和表达分析[J]. 大豆科学,2012,31(4):546 -551.
[10] Loukehaich R. 广谱胁迫蛋白编码基因(SlUSP1)介导番茄抗旱性的研究[D]. 武汉:华中农业大学,2011.
[11]赵 莘. 中国野生华东葡萄抗白粉病基因(VpUSP)克隆及表达分析[D]. 杨凌:西北农林科技大学,2010.
[12]陈 莹,陈 锡,王 茜,等. 高羊茅逆境胁迫蛋白基因FaUSP的克隆、表达及生物学功能分析[J]. 生物技术通报,2021,37(2):32-39.
[13]刘峻玲,梁珂豪,苗雅慧,等. 青杄PwUSP1基因特征及对干旱和盐胁迫的响应[J]. 北京林业大学学报,2020,42(10):62-70.
[14]Gilroy S,Biaasek M,Suzuki N,et al. ROS,calcium,and electric signals:key mediators of rapid systemic signaling in plants[J]. Plant Physiology,2016,171(3):1606 -1615.
[15]Choudhury F K,Rivero R M,Blumwald E,et al. Reactive oxygen species,abiotic stress and stress combination[J]. The Plant Journal,2017,90(5):856 -867.
[16]Sheikh A H,Eschen-Lippold L,Pecher P,et al. Regulation of WRKY46 transcription factor function by mitogen-activated protein kinases in Arabidopsis thaliana[J]. Frontiers in Plant Science,2016,7:61.
[17]Akimoto-Tomiyama C,Tanabe S,Kajiwara H,et al. Loss of chloroplast-localized protein phosphatase 2Cs in Arabidopsis thaliana leads to enhancement of plant immunity and resistance to Xanthomonas campestris pv. campestris infection[J]. Molecular Plant Pathology,2018,19(5):1184 -1195.
[18]Sewelam N,Kazan K,Schenk P M. Global plant stress signaling:reactive oxygen species at the cross-road[J]. Frontiers in Plant Science,2016,7:187.
[19]Nejat N,Mantri N.Plant immune system:crosstalk between responses to biotic and abiotic stresses the missing link in understanding plant defence[J]. Current Issues in Molecular Biology,2017,23:1 - 16.
[20]沈彥辉,陈宏坤,高璐阳,等. 灰葡萄孢Bctre1的基因组定位、蛋白质结构预测及表达分析[J]. 山东农业科学,2020,52(3):13-18.
