外源海藻酸钠对镉胁迫下黄瓜幼苗镉吸收及生长的调控效应
2022-06-12王庆安陈碧华赵戴军
王庆安 陈碧华 赵戴军


摘要:土壤镉的严重污染,使得食品安全生产受到严重威胁。目前,海藻酸钠被稳定、无毒、广泛地应用于农业领域,应用海藻酸钠治理重金属水污染的效果显著,但用海藻酸钠治理土壤镉污染的研究鲜有报道。以黄瓜为试验材料,研究添加外源海藻酸钠条件下黄瓜对镉胁迫的抵御响应。结果表明,当海藻酸钠水溶液、氯化钙水溶液添加量为100 mL/kg时,对黄瓜幼苗镉吸收的缓解效果最佳,黄瓜幼苗的株高、叶片数、总根长、根表面积、根尖数、地上部鲜质量、地上部干质量、地下部干质量分别较CK增加了20.63%、8.99%、15.79%、15.31%、16.24%、13.02%、33.26%、20.34%,黄瓜幼苗根、茎、叶中的Cd2+质量分数分别较CK减少了27.37%、26.78%、10.72%。研究结果说明,将海藻酸钠水溶液和氯化钙水溶液混合添加能够通过限制Cd2+的运输而减轻镉胁迫的危害。
关键词:海藻酸钠;镉胁迫;黄瓜;镉吸收;氯化钙;生长调控
中图分类号: X53;S642.201 文献标志码: A
文章编号:1002-1302(2022)10-0145-06
当前我国镉污染土壤面积已达2万hm2,并有逐渐恶化的趋势[1]。河南省新乡市大棚菜田土壤中重金属镉污染达到了6级,已经构成了严重污染[2]。镉是我国蔬菜的主要重金属污染物,秦皇岛市、上海市、长沙市、保定市、温州市等地蔬菜中重金属镉超标率分别达到12.2%、13.3%、51.0%、89.0%、50.0%[3]。我国黄瓜中的重金属镉含量达到 0.43 mg/kg[4],远远高于GB 2672—2017《食品安全国家标准 食品中污染物限量》中规定的蔬菜镉限量指标0.2 mg/kg。由此可见,如何在镉污染土壤上进行蔬菜的安全生产是当前亟待解决的关键问题。
海藻酸钠是一种稳定、无毒、成膜性或成球性优良的材料[5],被广泛应用于食品、医药、纺织、农业等领域[6]。一方面,由于海藻酸钠分子中含有 —COO- 基团,当向海藻酸钠水溶液中添加二价阳离子时,G单元中的Na+会与这些二价阳离子发生交换[7],使海藻酸钠溶液向凝胶态转变。另一方面,海藻酸钠对重金属离子有很强的吸附作用。田文等研究发现,改性海藻酸钠纤维对水溶液中镉离子(Cd2+)的最大吸附量为253.83 mg/g[8]。薛超等研究发现,海藻酸钠与改性聚丙烯腈基碳纤维对水溶液中Cd2+的最大吸附量为162.8 mg/g[9]。李国清等研究发现,海藻酸钠-腐殖酸钠吸附法对Cd2+的去除率大于95.6%,对Cu2+的去除率大于99.6%[10]。
用海藻酸钠治理重金属水污染的报道较多,且效果显著[11],但目前鲜有将海藻酸钠用于土壤镉污染治理的研究报道。本研究以蔬菜种植面积较大的黄瓜为试验材料,研究不同添加方式、不同添加量的海藻酸钠对镉胁迫下黄瓜幼苗镉吸收的影响。旨在通过海藻酸钠自身的吸附作用及其与氯化钙的协同作用减少黄瓜幼苗對重金属镉的吸收利用,从而减缓镉污染土壤对黄瓜幼苗的危害,达到土壤镉污染修复治理的目的。
1 材料与方法
1.1 试验材料
供试黄瓜种子为新津春4号,由宁阳县鲁明种子有限公司提供。
海藻酸钠,购自山东西亚化学股份有限公司;无水氯化钙,购自天津市凯通化学试剂有限公司;氯化镉,购自国药集团化学试剂有限公司。
1.2 试验方法
本试验于2019年3月在河南科技学院园艺园林学院进行,盆栽试验采用基质栽培,基质按草炭、蛭石、珍珠岩体积比=3 ∶1 ∶1配制,基质用氯化镉进行镉胁迫,胁迫质量分数为20 mg/kg,详见表1。将基质搅拌均匀,使其含水量达到70%,再将基质装入规格为10 cm×9 cm的营养钵中。将黄瓜种子进行温汤浸种,于55 ℃搅拌15 min后放置在常温水中浸种4 h,然后将种子播种到营养钵中进行培养。
1.2.1 生长指标的测定 待黄瓜幼苗长至2张真叶时,分别用卷尺、游标卡尺、手持叶绿素仪(SPAD-502)测定每株黄瓜幼苗的株高、茎粗、叶片数及叶绿素含量,总根长、根表面积、根系平均直径、根体积和根尖数等根系形态参数[12]。
1.2.2 黄瓜幼苗镉含量的测定 用Optima 2100 DV电感耦合等离子体发射光谱仪测定样品中的镉含量[12]。
1.3 数据分析
数据采用Excel 2010、SPSS 21.0统计软件分析。
2 结果与分析
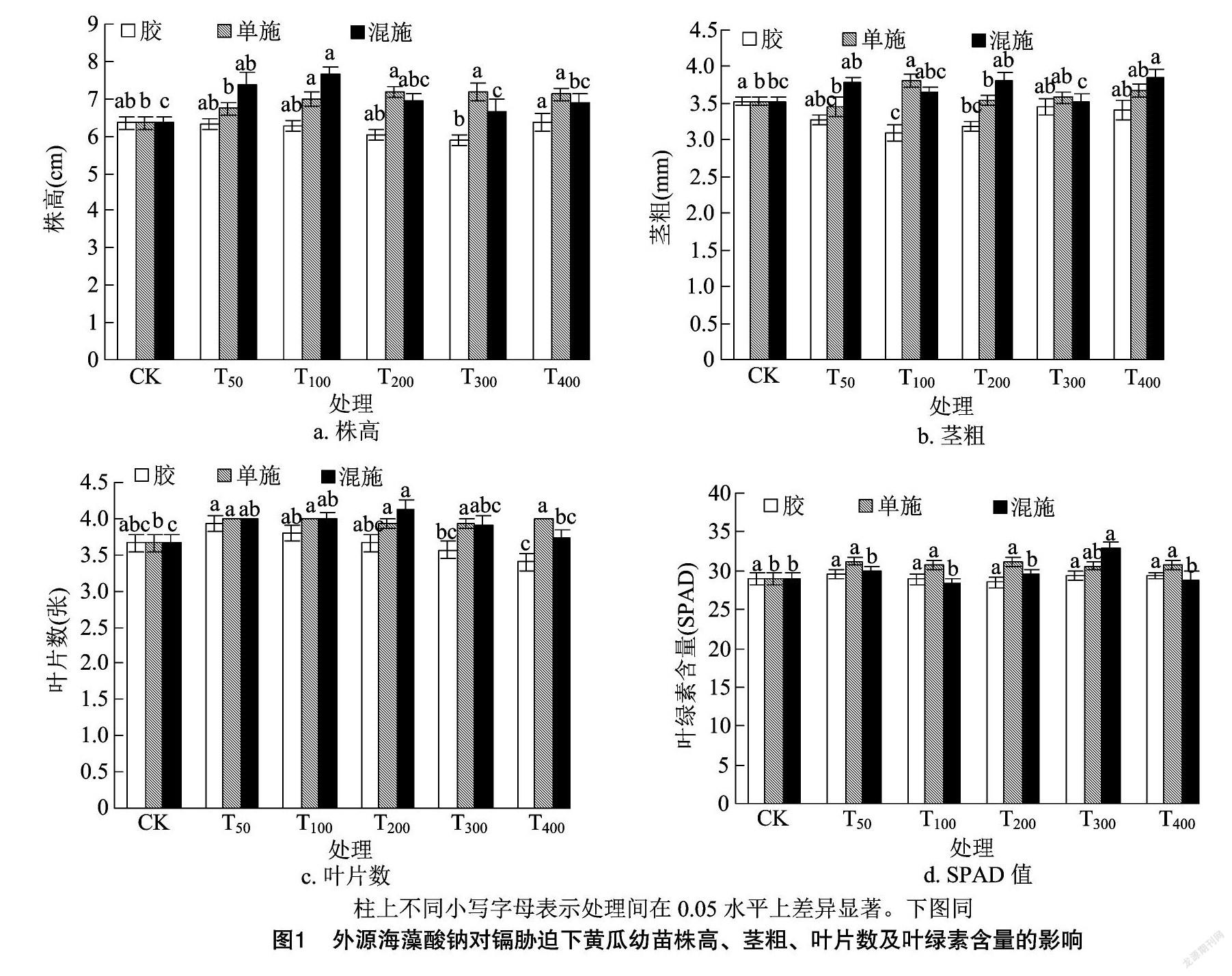
2.1 外源海藻酸钠对镉胁迫下黄瓜幼苗株高、茎粗、叶片数及叶绿素含量的影响
由图1-a可知,海藻酸钠水凝胶处理对黄瓜幼苗株高的影响差异不显著;在T100、T200、T300、T400的海藻酸钠单施处理下,黄瓜幼苗株高均较CK显著增加(P<0.05);在T50、T100的海藻酸钠水溶液与氯化钙混施处理下,黄瓜幼苗株高达到显著增加水平(P<0.05)。由图1-b可知,在T100、T200的海藻酸钠水凝胶处理下,黄瓜幼苗的茎粗分别较CK降低了12.46%、9.75%,且差异达到显著水平(P<0.05);在T100的海藻酸钠单施处理下,黄瓜幼苗的茎粗达到最大值,较CK增加了7.93%,且差异达到显著水平(P<0.05);在T400的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗的茎粗达到最大值,较CK增加了9.35%,且差异达到显著水平(P<0.05)。由图1-c可知,在T50、T100的海藻酸钠水凝胶处理下,黄瓜幼苗的叶片数较CK分别增加了7.08%、3.54%;在各海藻酸钠水溶液单施处理下,黄瓜幼苗叶片数的增加均达到显著水平(P<0.05);在T200海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗的叶片数达到最大值且与CK间的差异达到显著水平(P<0.05)。图1-d显示,随着海藻酸钠水凝胶的增加,黄瓜幼苗中的叶绿素含量变化不显著;在T50、T100、T200、T400的海藻酸钠单施处理下,黄瓜幼苗叶绿素含量较CK均显著增加(P<0.05);T300的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗的叶绿素含量达到最大值,较CK增加了13.95%,差异达到显著水平(P<0.05)。
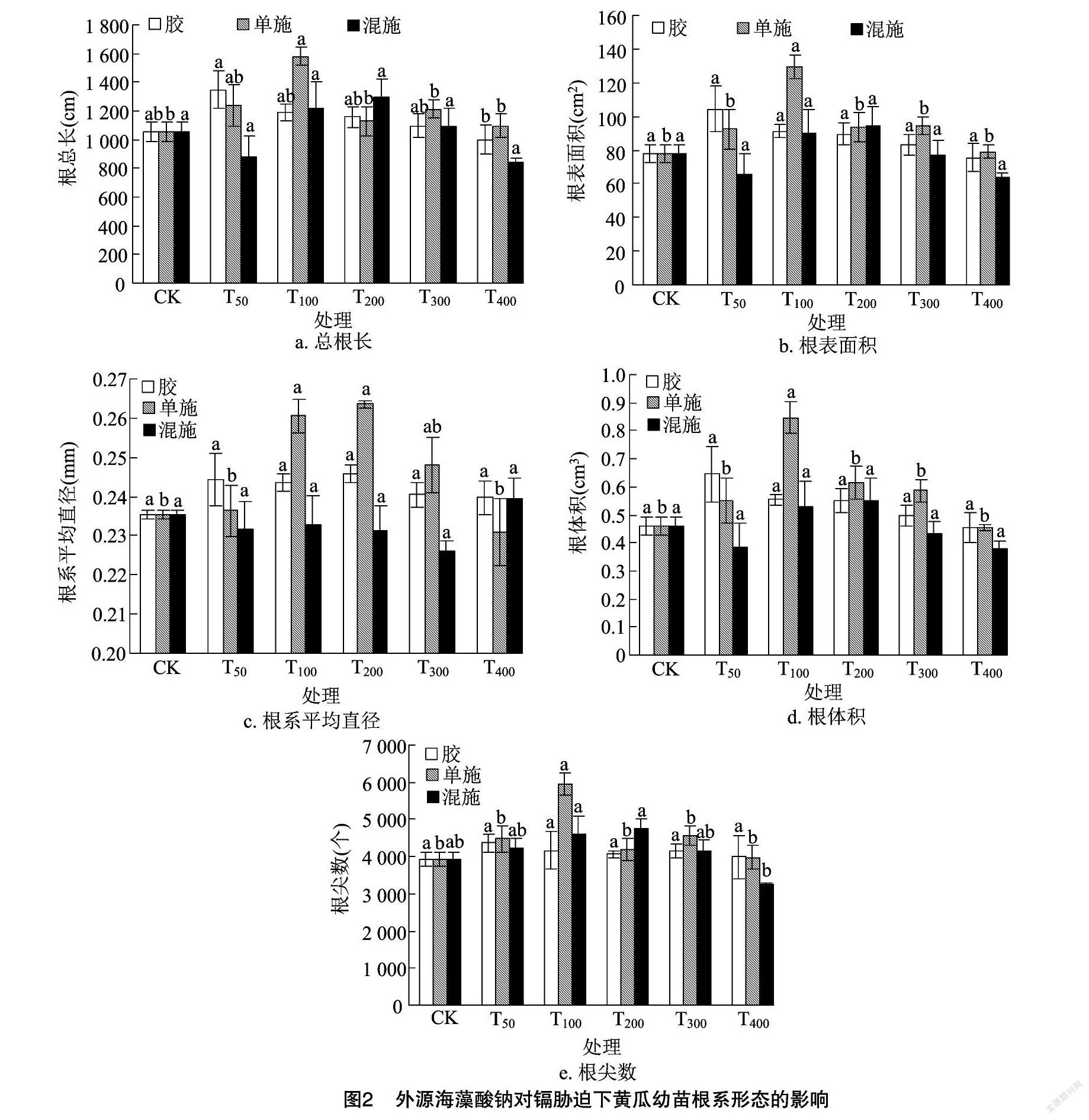
2.2 外源海藻酸钠对黄瓜幼苗根系形态的影响
由图2-a可知,在T50的海藻酸钠水凝胶处理下,黄瓜幼苗的总根长较CK增加了27.88%;在T100的海藻酸钠单施处理下,黄瓜幼苗的总根长较CK增加了49.91%,差异达到显著水平(P<0.05);在T200的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗的总根长达到最大值,较CK增加了22.61%,差异达到显著水平(P<0.05)。由图2-b可知,在T50的海藻酸钠水凝胶处理下,黄瓜幼苗的根表面积较CK增加了33.81%;在T100的海藻酸钠水溶液单施处理下,黄瓜幼苗的根表面积较CK增加了66.11%,差异达到显著水平(P<0.05);在T100、T200的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗的根表面积较CK分别增加了15.31%、21.24%。由图2-c可知,在T200的海藻酸钠水凝胶处理下,黄瓜幼苗的根系平均直径达到最大值,较CK增加了4.46%;在T200的海藻酸钠水溶液单施处理下,黄瓜幼苗的根系平均直径较CK增
增加了11.98%,差异达到显著水平(P<0.05);各海藻酸钠水溶液与氯化钙溶液混合处理间的差异均不显著。由图2-d可知,在T50的海藻酸钠水凝胶处理下,黄瓜幼苗的根体积较CK增加了40.37%;在T100的海藻酸钠水溶液单施处理下,黄瓜幼苗的根体积较CK增加了84.26%,差异达到显著水平(P<0.05);在各海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗根体积的差异不显著(P<0.05)。由图2-e可知,在T50的海藻酸钠水凝胶处理下,黄瓜幼苗的根尖数达到最大值,较CK增加了10.65%;在T100的海藻酸钠水溶液处理下,黄瓜幼苗的根尖数较CK增加了50.90%,差异达到显著水平(P<0.05)。
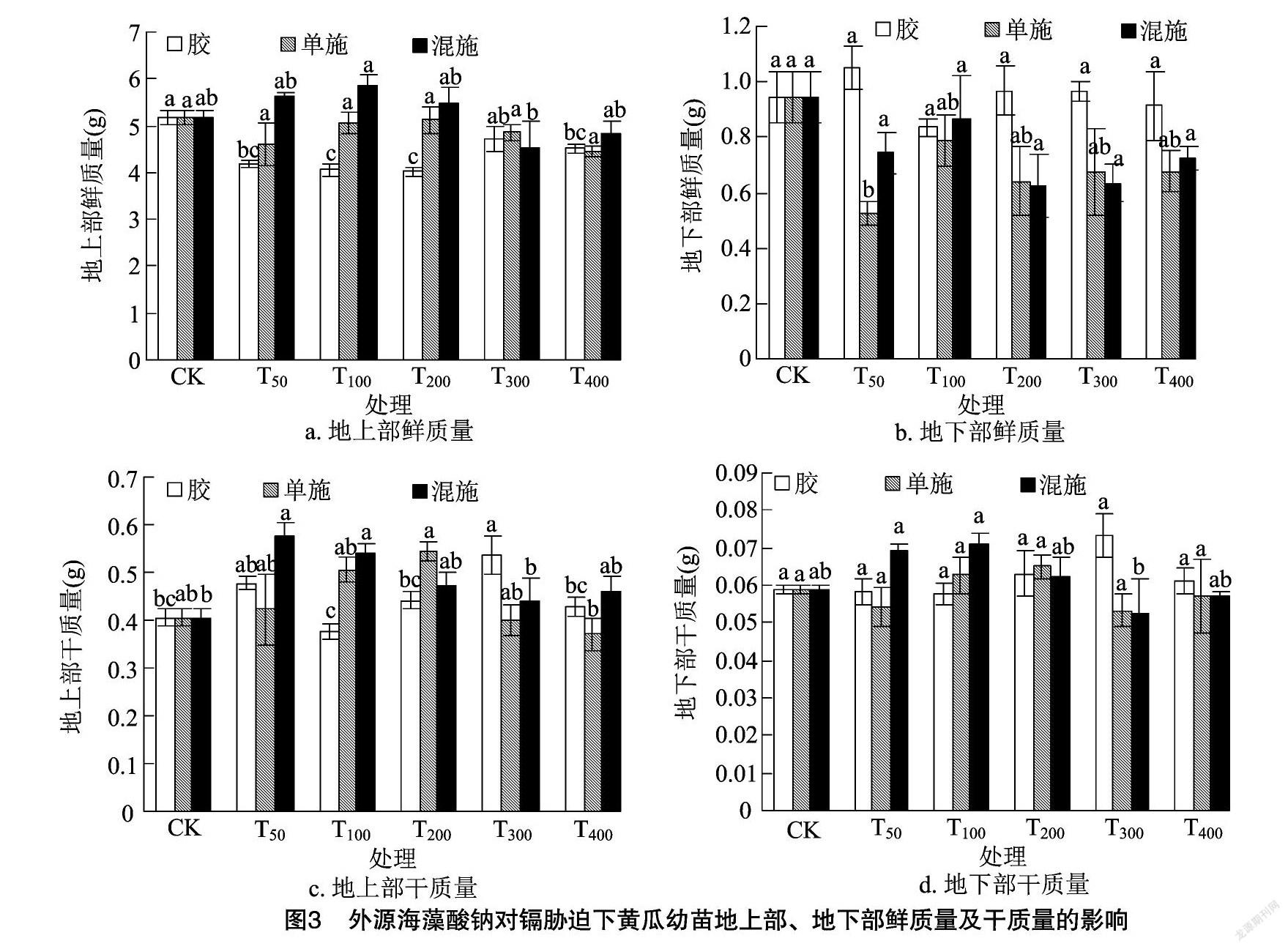
2.3 外源海藻酸钠对镉胁迫下黄瓜幼苗地上部、地下部鲜质量及干质量的影响
由图3-a可知,在T50、T100、T200、T400的海藻酸钠水凝胶处理下,黄瓜幼苗的地上部鲜质量较CK显著降低(P<0.05);在海藻酸钠水溶液的各添加量处理下,黄瓜幼苗的地上鲜质量较CK有所降低,但差异不显著;在T100的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗的地上部鲜质量达到最大值,但与CK间差异不显著(P>0.05)。由图3-b可知,在T50的海藻酸钠水凝胶处理下,黄瓜幼苗的地下部鲜质量较CK增加了11.33%;海藻酸钠水溶液、海藻酸钠水溶液与氯化钙溶液的各添加量处理的地下部鲜质量较CK都有所减少,海藻酸钠水溶液在T50处理下地下部鲜质量达到最低值,与CK相比差异达到显著水平(P<0.05)。由图3-c可知,在T300的海藻酸钠水凝胶处理下,黄瓜幼苗的地上部干质量较CK增加了31.94%,与CK相比差异达到显著水平(P<0.05);海藻酸钠水溶液的各添加量处理的黄瓜幼苗地上部干质量较对照有所增加但是差异不显著(P>0.05);在T50、T100的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗地上部干质量分别较CK增加了41.38%、33.26%,差异均达到显著水平(P<0.05)。由图3-d可知,在海藻酸钠水凝胶、海藻酸钠水溶液及海藻酸钠水溶液与氯化钙溶液的各添加量处理下,黄瓜幼苗的地下部干质量较CK均有一定的增加,但是差异不显著(P>0.05)。
2.4 外源海藻酸钠对镉胁迫下黄瓜幼苗Cd2+积累的影响
由图4-a可知,随着海藻酸钠水凝胶添加量的增加,黄瓜幼苗根中Cd2+的质量分数差异不显著;在T400的海藻酸钠水溶液处理下,黄瓜幼苗根中Cd2+的质量分数较CK增加了33.46%;在T300的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗根中Cd2+的质量分数最大,在T50和T100的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗根中Cd2+的质量分数较CK分别减少了22.06%、27.37%。由图4-b可知,在T300的海藻酸钠水凝胶处理下,黄瓜幼苗茎中的Cd2+质量分数达到最小值,与CK间的差异达到显著水平(P<0.05);在T300、T400的海藻酸钠水溶液处理下,黄瓜幼苗茎中Cd2+的质量分数分别较CK增加了24.74%、19.31%,差异均达到显著水平(P<0.05);随着海藻酸钠水溶液与氯化钙溶液添加量的增加,黄瓜幼苗茎中Cd2+的质量分数呈现先下降后上升的趋势,在T100处理下,黄瓜幼苗茎中Cd2+的质量分数达到最小值,在T50、T100、T200處理下,黄瓜幼苗茎中的Cd2+质量分数分别较CK降低了12.54%、26.78%、22.03%,且差异均达到显著水平(P<0.05)。由图4-c可知,在T200、T300、T400的海藻酸钠水凝胶处理下,黄瓜幼苗叶中Cd2+的质量分数较CK分别减少了19.00%、42.78%、22.89%,差异均达到显著水平(P<0.05);在T100的海藻酸钠水溶液处理下,黄瓜幼苗叶中Cd2+的质量分数达到最小值,T100、T200、T400处理下黄瓜幼苗叶中Cd2+的质量分数分别较CK减少了17.78%、16.94%、16.56%,且差异均达到显著水平(P<0.05);在T50的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗叶中Cd2+质量分数达到最小值,T50、T100处理下黄瓜幼苗叶中的Cd2+质量分数分别较CK减少了21.67%、10.72%,但是差异没有达到显著水平。
3 讨论
在盐胁迫条件下,植株相关生理指标的高低可直接反映植株耐盐胁迫能力的强弱[13]。本试验结果表明,在T50、T100的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗的株高相比于海藻酸钠水凝胶和海藻酸钠水溶液2种添加方式均有增加,表明在T50、T100的海藻酸钠水溶液与氯化钙溶液混合处理下,对黄瓜幼苗受到的镉胁迫具有缓解作用。叶绿素含量能表示植物在胁迫条件下光合作用的强弱[14],本研究结果表明,在添加海藻酸钠水凝胶、添加海藻酸钠水溶液和海藻酸钠水溶液与氯化钙溶液混合添加3种添加方式下,黄瓜幼苗的叶绿素含量差异不显著,表明叶绿素含量的高低并不能直接反映植株受到镉胁迫后生长状况的好坏。根系对地上部生长有重要影响,更能反映植物受到的镉胁迫程度[15]。本试验结果表明,在添加海藻酸钠水凝胶、添加海藻酸钠水溶液和海藻酸钠水溶液与氯化钙溶液混合添加3种添加方式下,黄瓜幼苗的总根长、根表面积、根平均直径、根体积和根尖数均呈现先上升后下降的趋势,这与张瑛等的研究结果[16-18]基本一致,且除根系平均直径外均在T50、T100、T200处理下达到最大值,表明海藻酸钠的3种添加方式均能促进镉胁迫下黄瓜幼苗根系的生长。生物量降低是镉胁迫下植物最敏感的生理响应,本试验结果表明,在T50、T100的海藻酸钠水溶液与氯化钙溶液混合的处理下,黄瓜幼苗的地上部鲜质量、地上部干质量、地下部干质量相比于海藻酸钠水凝胶和海藻酸钠水溶液2种添加方式均有所增加,表明T50、T100的海藻酸钠水溶液与氯化钙溶液混合处理能缓解黄瓜幼苗受到的镉胁迫作用。
植物体内的重金属含量和积累量是评价植物修复效果好坏的最直接指标[19],本研究结果表明,在T50、T100的海藻酸钠水溶液与氯化钙溶液的混合处理下,黄瓜幼苗根、茎、叶中的Cd2+质量分数相比于海藻酸钠水凝胶和海藻酸钠水溶液2种添加方式均有减少,表明T50、T100的海藻酸钠水溶液与氯化钙溶液混合处理能缓解黄瓜幼苗受到的镉胁迫作用。随着海藻酸钠和氯化钙添加量的增加,黄瓜幼苗根系的Cd2+质量分数也逐渐提高,这与施辰阳等的研究结果[20]一致。
4 结论
综合分析可知,外源海藻酸钠水溶液与氯化钙溶液混合添加比海藻酸钠水凝胶、海藻酸钠水溶液2种添加方式能更有效地缓解黄瓜幼苗受到的镉胁迫作用。在T100的海藻酸钠水溶液与氯化钙溶液混合处理下,黄瓜幼苗的株高、叶片数、根总长、根表面积、根尖数、地上部鲜质量、地上部干质量、地下部干质量分别较CK增加了20.63%、8.99%、15.79%、15.31%、16.24%、13.02%、33.26%、20.34%,黄瓜幼苗根中Cd2+质量分数、茎中Cd2+质量分数、叶中Cd2+质量分数分别较CK减少了27.37%、26.78%、10.72%。表明T100的海藻酸钠水溶液与氯化钙溶液混合处理能更好地缓解黄瓜幼苗受到的镉胁迫作用。
参考文献:
[1]Hsu S H,Wang S L,Huang J H,et al. Effects of rice straw ash amendment on Cd solubility and distribution in a contaminated paddy soil under submergence[J]. Paddy and Water Environment,2015,13(1):135-143.
[2]陈碧华,杨和连,李新峥,等. 新乡市大棚菜田土壤重金属积累特征及污染评价[J]. 土壤通报,2012,43(4):967-971.
[3]孙婕妤,刘艳秋,李佰林. 植物对镉的耐性机制以及对镉污染土壤修复的研究进展[J]. 江苏农业科学,2018,46(7)12-19.
[4]李书幻,温祝桂,陈亚茹,等. 我国蔬菜重金属污染现状与对策[J]. 江苏农业科学,2016,44(8):231-235.
[5]George M,Abraham T E. Polyionic hydrocolloids for the intestinal delivery of protein drugs:alginate and chitosan-a review[J]. Journal of Controlled Release,2006,114(1):1-14.
[6]王春霞,张娟娟,王晓梅,等. 海藻酸钠的综合应用进展[J]. 食品与发酵科技,2013,49(5):99-102.
[7]Russo R,Malinconico M,Santagata G. Effect of cross-linking with calcium ions on the physical properties of alginate films[J]. Biomacromolecules,2007,8(10):3193-3197.
[8]田 文,王 晓,马 春,等. 改性海藻酸钠纤维对镉离子的吸附性能分析[J]. 大连工业大学学报,2016,35(3):221-225.
[9]薛 超,祁佩时,刘云芝. 海藻酸钠-改性碳纤维复合材料对水中Cd2+的吸附研究[J]. 环境污染与防治,2016,38(11):52-55.
[10]李国清,罗生全. 海藻酸钠-腐殖酸钠吸附法处理重金属废水的研究[J]. 集美大学学报(自然科学版),2007,12(3):226-231.
[11]Huang Y,Wang Z Q. Preparation of composite aerogels based on sodium alginate,and its application in removal of Pb2+ and Cu2+ from water[J]. International Journal of Biological Macromolecules,2018,107(PtA):741-747.
[12]趙戴军,陈碧华,郭卫丽,等. 镉胁迫下海藻酸钠与氯化钙混合添加对黄瓜幼苗镉吸收的影响[J]. 西北农业学报,2020,29(3):398-406.
[13]张振华,刘 强,宋海星,等. K+、Ca2+和Mg2+对不同水稻(Oryza sativa L.)基因型苗期耐盐性的影响[J]. 中国农业科学,2010,43(15):3088-3097.
[14]龚 佳,倪细炉,李 健. NaHCO3胁迫对宁夏4种灌木生长及光合特性的影响[J]. 西北林学院学报,2017,32(2):8-15.
[15]陈亚慧,刘晓宇,王明新,等. 蓖麻对镉的耐性、积累及与镉亚细胞分布的关系[J]. 环境科学学报,2014,34(9):2440-2446.
[16]张 瑛,刘秀梅,张志浩,等. 磁化水处理对镉胁迫下欧美杨幼苗光合及生长特性的影响[J]. 中国生态农业学报(中英文),2019,27(2):305-313.
[17]李继光,朱 恩,李廷强,等. 氮对镉胁迫下东南景天根系形态及镉积累的影响[J]. 环境污染与防治,2007,29(4):271-275.
[18]任艳芳,何俊瑜,周国强,等. 镨对镉胁迫下水稻幼苗根系生长和根系形态的影响[J]. 生态环境学报,2010,19(1):102-107.
[19]王兴伟,刘子芳,范 燕,等. 混种黑麦草和三叶草对假繁缕镉积累的影响[J]. 四川环境,2017,36(2):1-6.
[20]施辰阳,沙旭明,马丹丹,等. 基于外源硅处理下刺柏对重金属镉污染土壤的修复治理研究[J]. 杭州师范大学学报(自然科学版),2019,18(1):46-52.
