γ-干扰素释放试验在潜伏结核感染治疗效果评价中的应用价值
2022-06-12童涌钟剑峰童照威
童涌 钟剑峰 童照威
[摘要] 目的 探討γ-干扰素释放试验(IGRA)在潜伏结核感染(LTBI)治疗效果评价中的应用价值。方法 采用回顾性分析,选取2020年1—5月浙江省湖州市中心医院收治的结核感染患者作为研究对象,随机抽取LTBI 30例作为试验组,进行预防性抗结核治疗(TPT)。随机抽取肺结核患者30例作为对照组,进行规范抗结核治疗。比较两组治疗开始时、治疗后3个月的IGRA值。结果 治疗开始时,试验组的IGRA值为(329.53±255.34)pg/ml,对照组的IGRA值为(451.84±260.59)pg/ml,两组的IGRA值比较,差异无统计学意义(P>0.05)。治疗3个月时,试验组的IGRA值中位数为[13.50(10.00,70.00)]pg/ml,对照组的IGRA值中位数为[52.15(12.75,110.35)]pg/ml,试验组的IGRA值低于对照组,差异有统计学意义(P<0.05)。试验组的IGRA值阴转15例(50.0%),对照组IGRA值阴转8例(26.7%),两组的IGRA阴转情况比较,差异无统计学意义(P>0.05)。组内比较,对照组和试验组治疗后的IGRA值均较前下降,差异有统计学意义(Z=5.872;Z=5.360,P<0.001)。结论 在LTBI中,IGRA值变化的程度优于普通肺结核病人。IGRA的动态变化可为LTBI治疗效果评价提供依据。
[关键词] γ-干扰素释放试验;潜伏结核感染;肺结核;预防性治疗
[中图分类号] R52 [文献标识码] B [文章编号] 1673-9701(2022)13-0090-04
[Abstract] Objective To explore the application value of interferon gamma release assay (IGRA) in the evaluation of the curative effect of latent tuberculosis infection (LTBI). Methods In a retrospective analysis, patients with tuberculosis infection who were admitted to Huzhou Central Hospital, Zhejiang Province from January to May 2020 were selected as the study subjects, and 30 patients with LTBI were randomly selected as the experimental group to receive preventive anti-tuberculosis therapy (TPT). Another 30 patients with tuberculosis were randomly selected as the control group to receive standard anti-tuberculosis treatment. The IGRA values at the beginning of treatment and 3 months after treatment were compared between the two groups. Results At the beginning of treatment, the IGRA value of the experimental group was (329.53±255.34) pg/ml, and that of the control group was (451.84±260.59) pg/ml, with no statistically significant difference in the IGRA value between the two groups (P>0.05). After 3 months of treatment, the median value of IGRA in the experimental group was (13.50 [10.00, 70.00]) pg/ml, while the median value of IGRA in the control group was (52.15 [12.75, 110.35]) pg/ml, and the value of IGRA in the experimental group was lower than that in the control group, with a statistically significant difference (P<0.05). In the experimental group, 15 patients (50.0%) had negative IGRA, while in the control group, 8 patients (26.7%) had negative IGRA, with no statistically significant difference in the negative IGRA between the two groups (P>0.05). Within the group, IGRA values of both the control group and the experimental group were decreased after treatment, and the differences were statistically significant (Z=5.872; Z=5.360, P<0.001). Conclusion In LTBI, the degree of change in the IGRA value is better than that in normal tuberculosis patients. The dynamic changes of IGRA provide a basis for the evaluation of the LTBI therapeutic effect.
[Key words] Interferon gamma release assay (IGRA); Latent tuberculosis infection (LTBI); Tuberculosis (TB); Prophylactic treatment
结核病是由结核分枝杆菌(mycobacterium tuberculosis,MTB)感染引起的传染病[1],我国结核病的年发病数为82.3万例[2],仅次于印度、印度尼西亚,位居全球第三位[3]。普通人群在无防护的情况下,日常接触活动性肺结核患者有肺结核传播的风险[3-4]。除了极少数免疫低下人群感染MTB会立刻发病[5],绝大多数的MTB感染者会进入潜伏感染状态[6]。
潜伏结核感染(latent TB infection,LTBI)是指机体感染MTB并产生持续的免疫应答,但是没有活动性结核的临床症状的一种状态[7]。当普通人群感染了MTB后,免疫力低下时可进展为结核病。LTBI数量是庞大的[8]。根据WHO数学模型估计,全球约有19亿人感染结核病[9]。对LTBI人群开展预防性抗结核治疗(tuberculosis preventive treatment,TPT)[10],可使发病风险降低60%-90%。
γ-干扰素释放试验(inter gamma release assay,IGRA)用来测定γ-干扰素(gamma interferon,IFN-γ)判断受检者是否感染MTB,是否存在LTBI。目前IGRA已成为国内外结核诊疗指南推荐的重要实验室检测方法[11-12]。但动态评估外周血IGRA值在国内外研究中尚存在不足。
1 资料与方法
1.1 一般资料
本实验采用回顾性分析法。随机选择2020年1—5月浙江省湖州市中心医院感染科收治的LTBI患者30例作为试验组,肺结核患者30例作为对照组。纳入标准:①LTBI需要IGRA检测阳性,排除肺部及其他部位结核依据;肺结核符合肺结核的诊断标准[13-15];②无难以控制感染;③肝功能丙氨酸转氨酶、门冬氨酸转氨酶、总胆红素在正常值上限2倍以内;④血常规绝对中性粒细胞计数≥1.5×109/L,血小板≥100×109/L,肾功能肌酐、尿素氮在正常范围内,尿常规、心功能正常;⑤无不能耐受抗结核化疗的其他情况。排除标准:①患者拒绝参与临床试验研究;②单纯诊断为肺外结核者;③合并严重心脑肝肾并发症者;④肺结核病情严重拒绝治疗者。
试验组男16例,女14例;年龄19~78岁,平均(52.90±22.62)岁;病程0~1年,平均(0.45±0.20)年。对照组男14例,女16例;年龄18~76岁,平均(61.07±18.99)岁;病程0~2年,平均(0.50±0.33)年。两组患者的年龄、性别、病程等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
本次研究开展前已得到湖州市中心医院医学伦理委员会批准,并与所有受试对象签署医学人体试验知情同意书。
1.2 使用药物及规格用法
异烟肼(isoniazide,H)(杭州民生药业有限公司;国药准字H33021636;规格:0.1 g×100片×1瓶;剂型:片剂;剂量:0.3 g)。
利福平(rifampicin,R)[浙江医药;国药准字H33020235;规格:0.15 g×10粒×10板;剂型:胶囊;剂量:0.45 g(<50 kg)或0.60 g(>50 kg)]。
乙胺丁醇(ethambutol,E)[杭州民生药业有限公司;国药准字H33021602;规格:0.25 g×100片/瓶;剂型:片剂;剂量:0.75 g(<50 kg)或1.00 g(>50 kg)]。
吡嗪酰胺(pyrazinamide,Z)(沈阳红旗制药有限公司;国药准字H21022354;规格:0.25 g×100片/瓶;剂型:片剂;剂量:1.5 g)。
左氧氟沙星(levofloxacin,Lfx)[第一三共制药(北京)有限公司;国药准字H20040091;规格:0.5 g×4片/盒;剂型:片剂;剂量:0.5 g]。
1.3 临床治疗方案
1.3.1 试验组 IGRA患者TPT方案根据《2020世界卫生组织结核病整合指南之预防性治疗》[7]选择,进行规范治疗,TPT治疗方案:每日1次H+R,治疗3个月。
1.3.2 对照组 肺结核患者根据《基层医疗卫生机构人员结核病防治培训教材》的要求,进行规范治疗[16]。①肺结核(异烟肼敏感或未知):强化期2个月(痰菌不阴转3个月),H+R+Z+E;继续期4个月,H+R;②肺结核(异烟肼耐药):6~9RZE+Lfx(或6~9RZE);结核性胸膜炎:2HRZE/7~10HRE:强化期使用HRZE方案治疗2个月,继续期使用HRE方案治疗7个月(重症患者,继续期延长3个月,治疗方案为2HRZE/10HRE);气管支气管結核、肺结核合并肺外结核:2HRZE/10HRE。
1.4 IGRA试剂及方法
采用厦门万泰凯瑞生物技术有限公司生产的结核分枝杆菌特异性细胞免疫反应检测试剂盒(化学发光法)。①采集:采用静脉穿刺术采集样本,只能使用肝素抗凝的真空管采集。②分装:在16 h内将采集的全血分装到“N”“T”“P”三个培养管中。每种培养管加入全血1.0 ml,分装前需要将采集的全血样本颠倒混匀3次以上。③培养:将培养管轻柔颠倒5次后迅速放入37℃温箱培养(22±2) h,培养过程中保持培养管直立。④离心:培养后全血以3000~5000 r/min离心10 min,取血浆进行检测。⑤检测:将样本加入结核分枝杆菌特异性细胞免疫反应检测试剂盒,放入Caris系统进行检测。⑥结果判断:记录Caris系统显示结果。
1.5 观察指标及评价标准
①开始时,对试验组和对照组进行IGRA检测,评价两組的IGRA值及差异。IGRA值<14 pg/ml判断为阴性。②治疗3个月时,对试验组和对照组进行IGRA检测,评价两组的IGRA值及差异。IGRA值<14 pg/ml判断为阴性。
1.6 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料符合正态分布以均数±标准差(x±s)表示,采用t检验,非正态分布资料以中位数[M(P25,P75)]表示,采用秩和检验。计数资料以[n(%)]表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
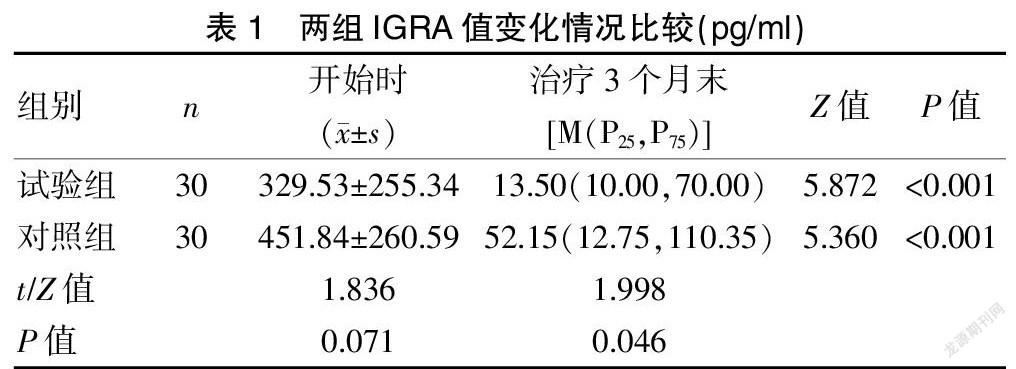
治疗开始时,试验组IGRA值为(329.53±255.34)pg/ml,对照组IGRA值为(451.84±260.59)pg/ml,两组对比,差异无统计学意义(t=1.836,P=0.071)。治疗3个月时,试验组IGRA值中位数为[13.50(10.00,70.00)]pg/ml。对照组IGRA值中位数为[52.15(12.75,110.35)]pg/ml,两组的IGRA值对比,差异有统计学意义(Z=1.998,P=0.046)。试验组的IGRA值阴转15例(50.0%),对照组的IGRA值阴转8例(26.7%),差异无统计学意义(χ2=3.445,P=0.063)。
试验组治疗前后对比,差异有统计学意义(Z=5.872,P<0.001)。对照组治疗前后对比,差异有统计学意义(Z=5.360,P<0.001)。见表1。
3 讨论
据估计,全球约有23%的人口感染MTB,我国约3.6亿人感染MTB,是全球22个结核高负荷国家之一,也是全球结核潜伏感染负担最重的国家之一[6]。潜伏感染人群是一个巨大的患者库,5%~10%的潜伏感染者会在一生中发生结核病。这些新发结核病可进一步传播更多正常人,产生更多的新发感染者,为国家传染病防控带来更大挑战。因此作为结核病“前期”过程--LTBI的及时有效治疗是结核病防控的关键。WHO认为,LTBI的干预是实现终止结核病策略目标的关键和优先事项,对医务人员和具有LTBI风险者特别重要[17]。在短期内疫苗研发暂未出现进展的情况下,TPT无疑是实现结核病消除的重要措施。在抗结核的细胞免疫反应中,主要参与的细胞是CD4+和CD8+T细胞。巨噬细胞中结核杆菌通过MHC Ⅱ类分子的抗原提呈给CD4+T细胞,被早期细胞因子如IL-12、IL-18等诱导向Th1型细胞分化。这种CD4+T细胞能够产生大量IFN-γ等细胞因子,激活巨噬细胞。同时IFN-γ可上调巨噬细胞表面MHC Ⅰ类、MHC Ⅱ类、协同刺激分子CD80/86等分子的表达,促进诱导型一氧化氮合酶的产生,激活巨噬细胞的氧依赖性和氧非依赖性杀菌系统。使巨噬细胞获得杀灭胞内寄生菌的能力。同时抗原呈递能力进一步加强,从而扩大抗结核的免疫效能。总的来说,CD4+T细胞及其产生的IFN-γ等细胞因子对机体抗结核感染起着重要作用[18]。
IGRA是检测结核分枝杆菌(MTB)特异性抗原刺激T细胞产生的r-干扰素以判断是否存在MTB感染。传统的PPD试验受卡介苗接种的干扰及机体免疫状态的影响,其作为MTB感染的诊断价值受到限制。IGRA的优势在于其不受卡介苗、非结核分枝杆菌感染的影响。近年来,IGRA在LTBI诊断方面的优势得到证实[19-21]。但关于提高高风险人群的LTBI检测效能、评估再感染风险、优化现有检测策略等研究仍然存在不足。尤其LTBI因其无明确临床症状作为指导,TPT治疗效果评价依然存在困难。本实验通过IGRA值的动态变化与肺结核患者治疗后动态变化进行对比,以期评价IGRA值对TPT治疗效果的评价价值。
本研究中,实验开始时,试验组与对照组的IGRA值比较,差异无统计学意义[(329.53±255.34)pg/ml vs.(451.84±260.5)pg/ml,P=0.071)]。可见,LTBI患者与肺结核患者外周血IGRA值均出现高表达状态。
经治疗后,对照组中肺结核患者治疗开始时与治疗3个月后比较,IGRA值显著下降(Z=5.360,P<0.001),这与国内外研究相仿[22-23]。试验组中LTBI患者治疗开始时与治疗3个月后比较,IGRA值显著下降(Z=5.872,P<0.001)。可见,同肺结核患者一样,LTBI患者经TPT治疗后,IGRA值明显下降。IGRA值可间接评价患者治疗效果。3个月末时,试验组的IGRA值优于对照组,差异有统计学意义(Z=1.998,P=0.046),考虑经治疗后,LTBI患者的IGRA值下降更加明显。IGRA阴转率方面,两组均未见有明显统计学差异(χ2=3.445,P=0.063)。
本研究比较相同的LTBI及肺结核患者抗结核治疗前后两个IGRA值的结果,选择用TPT方案和规范抗结核方案治疗前后重复测定IGRA,以期探索IGRA对LTBI治疗的价值,虽然本实验样本量小且随访时间比较短,但仍然看到抗结核治疗后,LTBI及肺结核患者IGRA值均呈现显著下降。且LTBI患者下降更加明显,但IGRA阴转率未表现出明显优势。
综上所述,在LTBI中,IGRA值变化的程度优于普通肺结核病人。IGRA动态变化可为LTBI治疗效果评价提供依据。
[参考文献]
[1] 中国防痨协会.耐药结核病化学治疗指南(2019年简版)[J].中国防痨杂志,2019,41(10):1025-1073.
[2] 中华人民共和国国家卫生健康委员会疾病预防控制局.2019年12月全国法定传染病疫情概况[EB/OL](2020-01-31).http://www.nhc.gov.cn/jkj/s7923/202001/ab5cbab3f8bc46c08cc7b6c4aef85441.shtml.[2020-04-30]
[3] World Health Organization. WHO consolidated guidelines on tuberculosis module 4: Treatment, drug-resistant tuberculosis treatment[M].Geneva: World Health Organization,2020.
[4] 李國红,苗润青,杨伟丽,等.2009—2017年北京市平谷区肺结核流行特征分析[J].临床药物治疗杂志,2019, 17(4):731-737
[5] 王飞,李海芹,李春红.老年矽肺合并肺结核患者抑郁的危险因素及针对性干预对策[J].河北医药,2019,41(6):929-932.
[6] Houben RM,Dodd PJ. The global burden of latent tuberculosis infection: A re-estimation using mathematical modelling[J].PLoS Med,2016,13(10):e1002 152.
[7] Geneva World Health Organization 2020. WHO operational handbook on tuberculosis module 1-prevention tuberculosis preventive treatment[DB/OL].https://apps.who.int/iris/bitstream/handle/10665/331525/9789240002906-eng.pdf[2020-09-14].
[8] Mancuso JD,Diffenderfer JM,Ghassemieh BJ,et al. The prevalence of latent tuberculosis infection in the United States[J].Am J Respir Crit Care Med,2016,194(4):501-509.
[9] Knight GM,McQuaid CF,Dodd PJ,et al. Global burden of latent multidrug-resistant tuberculosis: Trends and estimates based on mathematical modelling[J].Lancet Infect Dis,2019.19(8):903-912.
[10] Geneva World Health Organization 2020.WHO consolidated guidelines on tuberculosis module 4: Treatment-drug-resistant tuberculosis treatment[DB/OL].https://www.ncbi.nlm.nih.gov books/NBK558570/pdf/Bookshelf_ NBK558570 pdf.[2020-09-14].
[11] 伍仕敏,项杰,周虹,等.γ-干扰素释放试验在肺结核和肺外结核诊断中的应用[J].武汉大学学报(医学版),2013,34(3):403.
[12] Geneva: World Health Organization. WHO Framework for the evaluation of new tests for Tuberculosis infection[EB/OL].https://www.who.int/news/item/29-07-2020-framework-for-the-evaluation-of-new-tests-for-tuberculosis-infection.[2020-09-14].
[13] 中华人民共和国国家卫生健康委员会办公厅.中国结核病预防控制工作技术规范(2020版)[S].国卫办疾控函〔2020〕279号.2020-04-02.
[14] 国家卫生和计划生育委员会.肺结核诊断:WS 288-2017[S/OL].(2017-11-09)[2020-06-10].http://www. nhc.gov.cn/ewebeditor/uploadfile/2017/12/20171212154852389.pdf.
[15] 国家卫生和计划生育委员会.结核病分类:WS 196-2017[S/OL].(2017-11-09)[2020-06-10].http://www. nhc.gov.cn/ewebeditor/uploadfile/2017/12/20171212154717348. pdf.
[16] 成诗明,周林.《基层医疗卫生机构人员结核病防治培训教材》[M].北京:人民卫生出版社,2019.
[17] Santos AP,Silva DR,Mello FCQ. In the time of strategies to end tuberculosis,prevention is better than treatment[J].Bras Pneumol,2020.46(2):e20 200 017.
[18] Chackerian AA,Perera TV,Behar SM. Gamma interferon producing CD4+ T lymphocytes in the lung correlate with resistance to infection with Mycobacterium tuberculosis[J].Infection & Immunity,2001,69(4):2666-2674.
[19] Lempp JM,Zajdowicz MJ,Hankinson AL,et al. Assessment of the Quanti FERON-TB Gold In-Tube test for the detection of Mycobacterium tuberculosis infection in United States Navy recruits[J].PloS One,2017,12(5):e0177 752.
[20] Colgan K,Anderson J,Maycock A,et al. Latent tuberculosis may be missed by current screening practices: Analysis of interferon-gamma release assay results from a paediatric refugee clinic[J].J Paediatr Child Health,2019, 55(7):826-832.
[21] Nasri MJ,Pormohammad A,Goudarzi H,et al. Latent tuberculosis infection in transplant candidates: A systematic review and meta-analysis on TST and IGRA[J].Infection,2019,47(3):353-361.
[22] Park IN,Shim TS. Qualitative and quantitative results of interferon-γ release assays for monitoring the response to anti-tuberculosis treatment[J].Korean J Intern Med,2017, 32(2):302-308.
[23] 余美玲,郭卉欣,王云霞,等.肺結核患者体内结核病相关免疫细胞因子的动态变化[J].中华结核和呼吸杂志,2015,38(8):584-588.
(收稿日期:2021-08-17)
