贝母素甲影响肝癌细胞生物学行为研究
2022-06-10陈万松
陈万松,熊 伟,熊 书
(重庆三峡医药高等专科学校基础医学部,重庆 404120)
肝癌是一种发生于肝脏的恶性肿瘤,具有极高的死亡率。目前,治疗肝癌主要有手术治疗、化疗、放疗、中药治疗和生物治疗等方法,其中手术治疗、放疗、化疗效果远远不尽人意。中药治疗可以改善患者体征,减轻放化疗的毒副作用,提高生存率和生存质量。贝母是贝母属植物的鳞茎,干燥入药,是川产道地贵细药材之一,因其独特的化痰止咳、清热润肺和散结消痈效果而驰名。贝母的主要活性单体为皂苷、糖苷、甾体生物碱和萜类等[1]。现代药理研究显示,贝母中的生物碱贝母素甲具有抗肿瘤活性,可抑制多种肿瘤细胞的生长[2-3]。综合结果表明,贝母素甲可作为一种全新的抗癌候选药物,但是贝母素甲对肝癌细胞的抑制活性尚未见报道。通过研究贝母中贝母素甲抑制肝癌细胞的增殖、生长及相关机制,以期为后续应用于临床提供可靠的药理依据。
1 材料与方法
1.1 材料
A组:含1 μmol/L贝母素甲的培养基;B组:含2.5 μmol/L贝母素甲的培养基;C组:含5 μmol/L贝母素甲的培养基;D组:含7.5 μmol/L贝母素甲的培养基;E组:含10 μmol/L贝母素甲的培养基。
1.2 仪器
CO2培养箱(德国Heraeus公司生产);倒置荧光显微镜(日本Olympus公司生产);多孔酶标仪(美国Bio-RAD公司生产);流式细胞仪(美国B D公司生产)。
1.3 实验方法
1.3.1 MTT法评价贝母素甲对肝癌HepG 2细胞增殖的影响
96孔板培养HepG 2细胞24 h后去培养基,A、B、C、D和E组每孔分别加入含不同浓度的贝母素甲培养基100 μL,对照组每孔加入不含贝母素甲的培养基100 μL,空白组每孔只加不含细胞与贝母素甲的培养基100 μL,每个组设8个复孔。接种完毕后,分别培养24 h、48 h和72 h,弃上清,每孔再加入5 mg/mL MTT溶液20 μL,37℃、5% CO2孵育4 h。每孔再加入三联液100 μL,37℃混匀后过夜放置。将蓝紫色产物formazan溶解,酶标仪570 nm测定吸光度值。
1.3.2 贝母素甲对肝癌HepG 2细胞周期的影响
将对数生长期的HepG 2细胞贴壁生长至70%融合,置于无血清的RPMI-1640培养基中饥饿培养4 h,再分别加入含1 μmol/L、2.5 μmol/L、5 μmol/L、7.5 μmol/L和10 μmol/L的贝母素甲培养基处理72 h,以未加药物处理的组为对照组。HepG 2细胞离心后,70%乙醇固定杀死细胞,4℃下放置4 h,加入RNaseA去除RNA,37℃水浴30 min,加入800 μL PI染色液,流式细胞仪488 nm波长检测。
1.3.3 贝母素甲对肝癌HepG 2细胞凋亡的影响
将对数生长期的HepG 2细胞贴壁生长至70%融合,更换无血清的RPMI-1640培养基饥饿培养4 h,再分别加入含1 μmol/L、2.5 μmol/L、5 μmol/L、7.5 μmol/L和10 μmol/L的贝母素甲培养基处理72 h,以未加药物处理的组为对照组。根据Annexin V-PI 凋亡试剂盒操作,流式细胞仪检测。
2 实验结果
2.1 体外MTT法评价贝母素甲对肝癌细胞HepG 2增殖的影响
贝母素甲对HepG 2细胞的影响见表1。结果显示:药物刺激后,C、D和E组与对照组相比有明显差异;随着贝母素甲浓度的增大,其对细胞的抑制作用逐渐加强,提示高浓度的贝母素甲对HepG 2细胞有一定的毒性作用。除此之外,药物处理时间越长,对肝癌细胞的影响越大。
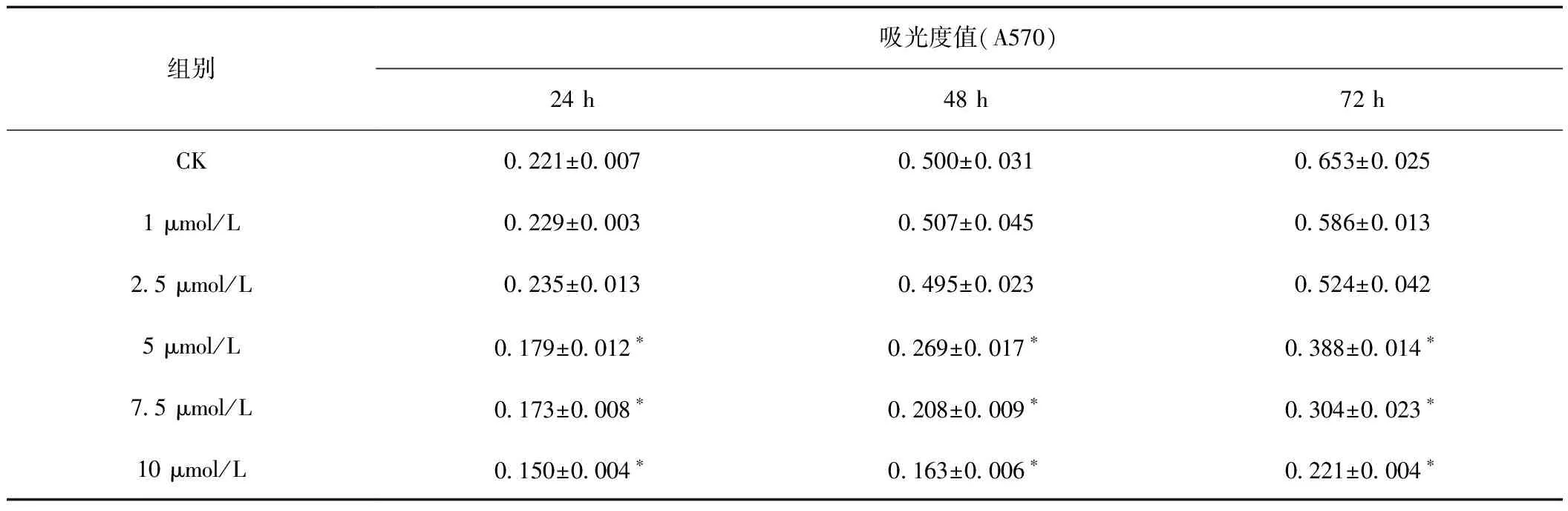
表1 不同浓度贝母素甲对肝癌HepG 2细胞增殖的影响Tab.1 Effects of different concentrations of Peimine on proliferation of hepatocellular carcinoma HepG 2 cells
2.2 贝母素甲对肝癌HepG 2细胞周期的影响
经过定量分析的结果显示,1 μmol/L、2.5 μmol/L、5 μmol/L贝母素甲3个处理组细胞周期分布与对照组相比,G0G1期与S期均没有明显改变(P>0.05),7.5 μmol/L和10 μmol/L贝母素甲处理组细胞G0G1期占比显著多于对照组(60.83±3.50%,63.53±2.43% vs 49.86±3.50%,P<0.05)而7.5 μmol/L和10 μmol/L贝母素甲处理组处于S期的占比显著少于对照组(表2)。表明≥7.5 μmol/L贝母素甲处理HepG 2细胞使G0G1占比增加,表明细胞被阻滞在G0G1期,进而使细胞的分裂被阻止。
2.3 贝母素甲对肝癌HepG 2细胞凋亡的影响
早期凋亡分析发现,5 μmol/L、7.5 μmol/L和10 μmol/L贝母素甲早期凋亡百分比依次增大。晚期凋亡分析表明,对照组、2.5 μmol/L、5 μmol/L、7.5 μmol/L和10 μmol/L贝母素甲组晚期凋亡百分比依次增大,从2.5 μmol/L贝母素甲组开始后的4组早期凋亡百分比均与1 μmol/L贝母素甲和对照组有显著性差异,说明贝母素甲浓度的增大会增加细胞的早期凋亡(表3)。晚期凋亡中,7.5 μmol/L和10 μmol/L贝母素甲与前面几组有显著性差异,说明≥10 μmol/L贝母素甲出现较强的毒性,诱导细胞发生凋亡和坏死。

表2 不同浓度贝母素甲对肝癌HepG 2细胞周期的影响Tab.2 Effects of different concentrations of Peimine on cycle of hepatocellular carcinoma HepG 2 cells

表3 不同浓度贝母素甲对肝癌HepG 2细胞凋亡的影响Tab.3 Effects of different concentrations of Peimine on apoptosis of hepatocellular carcinoma HepG 2 cells
3 讨论
1983年,Mosmann创立了MTT比色法并第一次应用IL-2等细胞因子处理大鼠淋巴细胞瘤细胞并研究对其增殖的影响[4],随后迅速推广,广泛用于细胞实验[5]。贝母素甲是一种生物碱,对肺癌细胞有所抑制,但是对于肝癌细胞暂未有所记载。研究贝母素甲对HepG 2细胞增殖的影响,不仅能为临床上温和的方式治疗肝癌有所帮助和补充,还能够为研究其对HepG 2细胞周期、凋亡、迁移等方面作浓度参考。实验发现,高浓度的贝母素甲对HepG 2细胞有一定的毒性作用。
G0/G1期是细胞分裂的重要时期,当G0/G1期细胞占比降低,则处于细胞分裂期的细胞降低,从而引起S期和G2/M期细胞的数量降低,导致细胞周期阻滞或延长,DNA合成不足,影响细胞代谢、生长、增殖等,最终诱发凋亡机制,导致细胞凋亡。结果表明,贝母素甲使HepG 2细胞周期阻滞在G0G1期,从而阻止细胞分裂。
Annexin V/PI双染法是一种常见的细胞凋亡荧光检测方法。Annexin V与磷脂酰丝氨酸(phosphatidylserine,PS)有较强的亲和力,但PS存在于细胞膜内侧,只有在细胞发生早期凋亡时才会翻转到外侧,Annexin V能与外翻的PS结合[6]。碘化丙啶(Propidium Iodide,PI)是一种核酸染料,只有在细胞凋亡晚期和细胞坏死时才能进入细胞,使细胞核染色。Annexin V是早期反应而PI 是晚期反应,因此两者结合使用可区分不同时期的凋亡现象。结果表明,贝母素甲诱导HepG 2细胞发生凋亡和坏死。
