SGLT2抑制剂联合二甲双胍治疗早期糖尿病肾病的疗效及安全性
2022-06-10王华敏
黄 岩 王华敏
(首都医科大学附属北京朝阳医院怀柔医院肾内科,北京 101499)
糖尿病(diabetes mellitus,DM)已成为危害人类的重大疾病之一,我国成人的患病率为12.8%[1]。全球DM的患病人数在几十年内增长了1倍[2]。糖尿病肾病(diabetic kidney disease,DKD)是DM导致的一种慢性肾脏病(chronickidney disease,CKD),表现为持续的尿白蛋白排泄增加,和(或)肾小球滤过率进行性下降,并最终发展为尿毒症。目前全球有30%~50%的终末期肾病(end-stage renal disease,ESRD)是由DM导致的[3]。钠-葡萄糖协调转运蛋白2(sodium-dependent glucose transporters 2,SGLT2)抑制剂是一类新型的降糖药物,可通过抑制肾脏近曲小管SGLT2活性,减少葡萄糖的吸收,从而发挥降糖作用。近年来一些大型的临床随机对照试验(randomized controlled trials,RCT)显示了SGLT2抑制剂在2型糖尿病(T2DM)高危进展患者中的心肾保护作用。二甲双胍(MET)及SGLT2抑制剂均已被列为DM管理的一线治疗方案[4]。但SGLT2抑制剂联合MET在早期DKD中的应用效果尚不明确。本研究通过探讨CANA联合MET治疗早期DKD临床效果,为临床治疗DKD提供更有效的治疗方案。
1 资料与方法
1.1 研究对象 选取2019年3月至2021年5月在我院接诊的106例早期DKD患者作为研究对象。纳入标准:①符合2020年美国糖尿病协会(American Diabetes Association,ADA)制定的DM诊断标准[5],依据2012年KDIGO指南及中华医学会内分泌学分会专家共识[6]提出的DKD分期标准,选取糖尿病肾病G1、G2期患者。②签订知情同意书。排除标准:①严重感染、急性心力衰竭、呼吸衰竭、AKI等应激状态。②有认知、语言功能障碍者,有精神病史者。③合并原发或继发性肾脏病患者。按照随机数字表法将分为对照组和观察组。观察组53例,病程7~20个月,平均(13.74±2.33)个月;年龄34~67岁,平均(50.34±3.33)岁;女28例,男25例。对照组53例,病程8~20个月,平均(14.23±2.11)个月;年龄35~66岁,平均(51.23±3.24)岁;女24例,男29例。两组一般资料有可比性(P>0.05)。本研究获医院伦理会批准。
1.2 治疗方法 两组患者均进行DKD常规治疗,包括饮食干预、运动指导、降糖、ACEI或ARB控制血压降尿蛋白等治疗。对照组采用二甲双胍(中美上海施贵宝制药有限公司,国药准字号H20023370,规格0.5 g/片),每次0.5 g,每日3次,餐后即刻口服。试验组采用卡格列净(阿斯利康制药有限公司,批准文号J20170040规格:100 mg/片),每次100 mg,每日1次,晨起空腹口服并联合二甲双胍治疗,口服方式同对照组,连续治疗6个月。
1.3 观察指标 记录患者的收缩压(SBP)、舒张压(DBP),测量身高(单位cm)、体质量(单位kg),计算体质量指数(body mass index,BMI)。晨起空腹抽静脉血,测定糖化血红蛋白(HbA1c)、空腹血糖(FPG)、三酰甘油(TG)、低密度脂蛋白(LDL-C)、尿酸(UA)、尿素氮(BUN)、血肌酐(SCr)。抽血当日测定早餐后2 h血糖(2hPG)、测定24 h尿蛋白定量(24h-Upro)。记录患者治疗期间不良事件的发生率(泌尿系感染、低血糖)。根据Scr水平,计算内生肌酐清除率(creatinine clearance rate,Ccr)Ccr=[(140-年龄)×体质量/(72×Cr)(男性)或(140-年龄)×体质量×0.85]/(72×Cr)(女性)。
1.4 统计学方法 应用SPSS 26.0进行数据统计分析,符合正态分布的计量数据采用(±s)表示,组间比较应用t检验或校正t检验。不符合正态分布的数据M(P25,P75)表示,采用非参数秩和检验。计数资料采用[n(%)]表示,应用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后SBP、DBP、BMI的比较 治疗前两组患者SBP、DBP、BMI比较,差异无统计学意义(P>0.05);两组治疗后的SBP、DBP、BMI均低于治疗前,观察组治疗后的SBP、DBP、BMI均低于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 两组患者治疗前后SBP、DBP、BMI比较(±s)

表1 两组患者治疗前后SBP、DBP、BMI比较(±s)
注:与同组治疗前比较,aP<0.05。
2.2 两组治疗前后HbA1c、FPG、2hPG比较 治疗前两组患者HbA1c、FPG、2hPG比较,差异无统计学意义(P>0.05);两组治疗后的HbA1c、FPG、2hPG均低于治疗前,且观察分组治疗后的HbA1c、FPG、2hPG均低于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组治疗前后HbA1c、FPG、2hPG的比较(±s)

表2 两组治疗前后HbA1c、FPG、2hPG的比较(±s)
注:与同组治疗前比较,aP<0.05。
2.3 治疗前两组患者TG、LDL-C、UA比较 治疗前两组患者TG、LDL-C、UA比较差异无统计学意义(P>0.05);两组治疗后的TG、UA均低于治疗前,差异有统计学意义(P<0.05),两组患者治疗后LDL-C比较差异无统计学意义(P>0.05)。见表3。
表3 两组治疗前后TG、LDL-C、UA的比较(±s)

表3 两组治疗前后TG、LDL-C、UA的比较(±s)
注:与同组治疗前比较,aP<0.05。
2.4 两组治疗前后SCr、24h-Upro、Ccr比较 治疗前两组患者SCr、24h-Upro、Ccr的比较,差异无统计学意义(P>0.05);两组治疗后的SCr、24h-Upro均低于对照组,差异有统计学意义(P<0.05)。观察组治疗后的Ccr高于治疗前,差异有统计学意义(P<0.05)。见表4。
表4 两组治疗前后SCr、24h-Upro、Ccr的比较(±s)
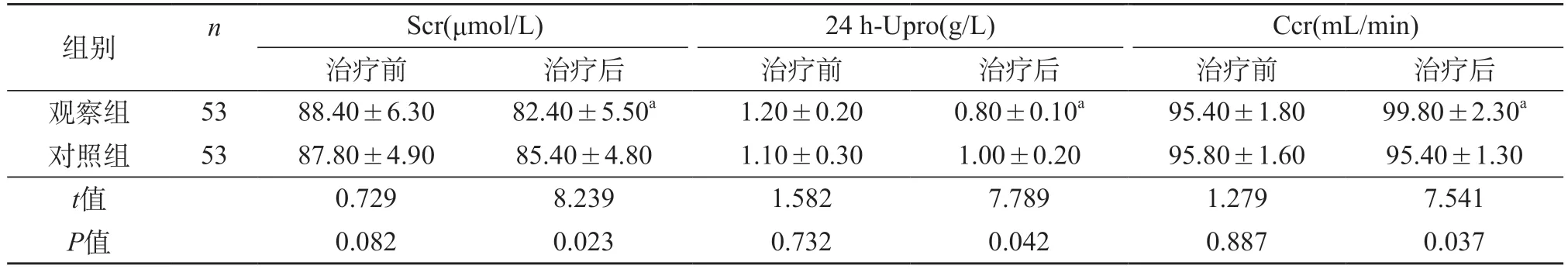
表4 两组治疗前后SCr、24h-Upro、Ccr的比较(±s)
注:与同组治疗前比较,aP<0.05
2.5 两组治疗后不良事件发生率比较 两组治疗后,观察组发生低血糖7.55%(4/53),泌尿系感染5.66%(3/53),对照组低血糖发生率1.89%(1/53),泌尿系感染发生率3.77%(2/53)。两组不良事件发生率比较差异无统计学意义(P>0.05)。
3 讨 论
过去导致我国CKD的主要原因是慢性肾小球肾炎,但随着DM患者发病人数的升高,导致CKD的疾病谱也发生着变化。一项在全国三级医院开展的关于3 530万住院患者的病因分析结果显示,目前CKD的主要发病原因为慢性肾小球肾炎,已超过了DKD。我国近20年的透析统计数据显示糖尿病肾病在终末期肾病的构成比逐年升高[7]。DKD发展到终末期需要进行肾脏替代治疗,这将为国家和家庭带来沉重的经济负担和压力。因此对于DKD的有效防治具有极其重要的价值。糖尿病肾病防治专家共识[8]中明确提到了DKD进展的主要危险因素,有效的控制血糖、控制体质量、控制血压、调节血脂等综合的管理,在防治DKD进展中发挥着重要的作用。
本研究主要评估了CANA联合MET在DKD早期患者中的临床疗效及安全性。本研究结果显示,与单用MET药物治疗相比,CANA联合MET明显降低了HbA1c、FPG、2hPG,这与既往的研究结果一致。成年人每日通过肾小球过滤180 g葡萄糖,其中90%的葡萄糖通过肾小管的S1和S2段钠葡萄糖转运蛋白介导吸收,糖尿病患者中的钠葡萄糖转运蛋白属于高表达状态,SGLT2抑制剂通过降低TmG及降低肾糖阈值,增加葡萄糖排出,从而降低空腹血糖及餐后血糖。另外,SGLT-2抑制剂还可通过促进分泌胰高血糖素和生成内源性葡萄糖生成,从而起到降低血糖的效果[9-10]。
本研究显示了SGLT2抑制剂CANA不仅降血糖效果显著,还可以有效降低患者的体质量。一项多中心的随机对照双盲前瞻性的研究[11],显示了SGLT2抑制剂不仅改善了血糖控制效果,并带来了体质量减轻的额外好处,本研究的结果与之相似。高尿酸血症也被列为CKD进展的危险因素之一,故对血尿酸的控制也能有效降低CKD的进展风险。美国学者的研究[12]显示了SGLT2抑制剂可以降低10%~15%的尿酸,其机制是尿糖排泄增多,致使葡萄糖蛋白9分泌尿酸以换取葡萄糖的重吸收。同样学者List等[11]的一项多中心随机对照双盲的研究,也证实了SGLT2抑制剂降尿酸的效果。Weber等[13]学者的一项随机、对照、双盲的研究中,SGLT2抑制剂CANA治疗组的患者收缩压较对照组多下降了4.28 mm Hg。目前CANA降低血压的机制被认为与渗透性利尿作用有关[14]。在调节血脂方面,CANA能升高HDL-C和升高LDL-C水平,并降低TG水平[15]。而CANA导致LDL-C的增高机制可能与葡萄糖排泄量增加以及渗透性利尿作用引起的血液浓缩有关[16]。但目前CANA增加HDL-C的机制尚不十分清楚。本研究也观察到了使用CANA轻度引起的LDL-C升高,但两组比较无统计学意义,分析其原因考虑与样本量不足,观察时间短等因素有关。
众所周知,DKD肾脏损伤中重要的机制就是肾小球的持续高滤过,SGLT2抑制剂可通过抑制近端肾小管葡萄糖和钠离子的重吸收,钠离子浓度增加,致密斑进行球管反馈,从而收缩入球小动脉,导致囊内压力下降[17],这同样也解释了在使用SGLT2抑制剂之后导致GFR短暂性下降的原因[18]。
据文献报道CANA可以增加女性泌尿系统的感染[19]。分析其机制可能与尿糖的增加为微生物的繁殖提供了有利的条件。本研究结果显示,CANA具有良好的耐受性。与单用MET相比,CANA联合MET在不良事件发生率与对照组无统计学意义,这与既往的研究结果相似。
本研究存在一定的局限性,首先本研究属于单中心的研究,样本量有限。其次仅观察了100 mg CANA后联合MET的疗效,未能观察到不同剂量对患者疗效的影响,后续仍需要有更深入的、大规模、多中心、前瞻性的随机对照研究来证实,为以后的CKD的防治提供更多的循证医学证据。
综上,SGLT-2抑制剂在延缓DKD发生发展的主要病理生理机制包括:渗透性利尿、尿钠排泄增加,降低血浆容量;降低肾小球内压、减轻尿蛋白。CANA通过降低血糖、减轻体质量、降低血压、影响血脂等方面,进而降低DKD进展的风险。CANA联合MET治疗早期DKD,能够取得良好的临床效果。
所有作者均声明无利益冲突。
