缺血性脑卒中全基因组关联研究提示阳性基因位点与睡眠行为的交互作用
2022-06-10杨若彤王梦莹李春男王小文吴俊慧王斯悦王伽婷陈大方胡永华
杨若彤,王梦莹,李春男,于 欢,王小文,吴俊慧,王斯悦,王伽婷,陈大方,吴 涛,胡永华
(北京大学公共卫生学院流行病与卫生统计学系,北京 100191)
睡眠健康对一个人的总体健康和幸福感影响重大,近年来,有关睡眠的流行病学研究主要聚焦于睡眠时长,既往研究发现睡眠时长过长或过短、睡眠质量低下与缺血性脑卒中(ischemic stroke,IS)的发生风险较高相关[1-2],而在中国人群当中,短睡眠是否增加IS风险仍存争议[3-4]。睡眠效率(通常定义为总睡眠时间与卧床时间之比)近年来在失眠研究和治疗中有重要作用[5],睡眠效率的改善已成为评估失眠治疗疗效的金标准,睡眠效率可以客观反映睡眠质量。已有研究发现睡眠效率与高血压等心血管疾病发生风险呈负相关[6-7],但与IS风险的关联证据很少,尤其缺乏亚洲人群研究报道[8]。有证据表明,长期的昼夜节律紊乱与血压升高、睡眠质量降低有关,可能是心血管疾病的危险因素[9]。入睡时间过早或过晚与心血管疾病发生风险增高有关[10],但入睡时间与IS风险的关系尚未见充分研究报道。另外,已有研究表明遗传因素可能是睡眠障碍和脑血管事件易感性的基础[11],但目前睡眠-基因交互作用与IS的关联研究主要集中在欧洲人群[12],中国人群研究证据较为缺乏。因此,本研究旨在探索包含睡眠时长、睡眠效率和入睡时间3个维度的睡眠行为和全基因组关联研究(genome-wide association studies, GWAS)提示IS阳性基因位点与IS风险的关联,以及睡眠-基因交互作用与IS风险的关联。
1 资料与方法
1.1 研究对象
研究对象来自2013—2017年北方农村地区居民常见慢性非传染性疾病的家系队列研究完成的调查[13],调查现场为北京市房山区9个乡镇。研究对象纳入标准:(1)汉族;(2)年龄≥18岁;(3)签署知情同意书。排除标准:(1)有重大疾病或严重慢性病者,如恶性肿瘤、严重肝肾疾病等;(2)不能配合调查者;(3)关键睡眠信息(睡眠时长、入睡时长、上床时间)缺失者,总睡眠时长>24 h或<1 h者。本研究开始前已经北京大学生物医学伦理委员会审查批准(IRB00001052-13027),所有调查对象均签署知情同意书。
1.2 研究内容和方法
1.2.1调查内容与资料收集
本研究调查内容包括问卷调查、体格检查和血生化检测。采用标准调查问卷收集研究对象的一般人口学资料(性别、年龄、家系编号、婚姻状况、教育程度、家庭年收入)、行为生活习惯(吸烟、饮酒、体力活动、蔬菜水果摄入量)、疾病史(高血压、糖尿病、冠心病)、家族史(父母、同胞和子女)和用药史等信息。体格检查(身高、体质量等)及血生化检测指标(糖化血红蛋白、空腹血糖、总胆固醇水平等)由经统一培训的专业人员进行。详细检测方法见基于本研究人群的既往研究[14]。基因多态性检测:采用英国LGC公司的KASP检测技术对基因多态性进行高通量的基因型分型:(1)对所选基因位点进行引物设计;(2)引物合成;(3)PCR 扩增反应;(4)利用 BMG PHERAstar仪器(Servier公司,法国)检测荧光信号并查看分型情况,若分型不充分则继续扩增,直至分型完全;(5)从Kraken软件导出分型结果。
1.2.2变量来源和定义
1.2.2.1睡眠行为 通过问卷调查进行收集,本研究的睡眠行为定义为:睡眠时长(h)为调查对象自报时长;睡眠效率(%)为睡眠时长与卧床时间(睡眠时长+入睡时长)之比;实际的入睡时间通过结合自报上床时间和入睡时长进行推算。结合美国睡眠协会的建议和既往研究[3,8,10,15],将睡眠时长7.0~8.9 h,睡眠效率≥80%,入睡时间在22:00—22:59定义为健康的睡眠行为,作为参照组进行后续分析。
1.2.2.2缺血性脑卒中确诊 现场调查结束后,由工作人员根据调查中获得的IS患者就诊信息到相应医院查阅脑卒中患者病历,摘抄入院和出院诊断,并记录各种辅助检查结果(包括头颅CT和/或MRI检查、经颅多普勒超声检查、颈动脉超声检查、颈椎放射影像检查、心电图、彩色多普勒超声心动图检查等)。对未能获得病历资料的患者进行电话随访和入户随访,进一步获得患者的影像学检查结果等资料。由北京大学第三医院神经内科医生根据患者病历资料、影像学检查以及辅助检查结果进行确诊。
1.2.2.3缺血性脑卒中基因位点 基于既往GWAS研究的结果进行选择[16-34],纳入在全基因组水平上与IS有关联的基因位点;排除人类单体型图计划公布的中国人群较小等位基因频率(minor allele frequency, MAF)<0.1的位点;排除连锁不平衡检验R2>0.8的位点中效应较低者;最终保留27个单核苷酸多态性位点(single nucleotide polymorphism,SNP)。
1.2.2.4协变量 (1)吸烟:平均每天吸烟1支及以上,或采用其他吸烟方式吸入相当于1支纸烟的烟草量,持续半年及以上;(2)饮酒:每天饮用一个标准杯的酒精(10 g)或饮用相当于10 g酒精量的其他类型酒精饮料,持续半年及以上;(3)足量运动:从事重体力/中等体力劳动和高强度/中等强度体育运动的总时长每周≥150 min的适度运动,或每周≥75 min的剧烈运动或相等的组合,或每周至少5 d适度运动,或每周一次剧烈运动;(4)2型糖尿病:糖化血红蛋白百分比≥6.5%,或空腹血糖浓度>7.0 mmol/L,或有降糖药物规律服用史,或自报有糖尿病临床诊断病史;(5)高血压:3次血压测量值中,取第2次和第3次血压测量值的平均值,满足收缩压≥140 mmHg或舒张压≥90 mmHg,或有降压药物规律服用史,或自报有高血压临床诊断病史;(5)冠心病:自报有冠心病病史;(6)体重指数(body mass index, BMI):BMI=体质量(kg)/身高(m)2;(7)家族史:父母、同胞或子女中存在患病史。
1.3 统计学分析
对IS患者与非患者的一般人口学特征进行描述性分析。连续性变量以均数±标准差表示,正态分布者采用t检验进行组间差异比较,非正态分布者采用Wilcoxon秩和检验进行组间差异比较。分类变量以频数(百分比)表示,对无序分类变量采用卡方检验,对有序多分类变量采用卡方趋势检验。采用广义线性模型分析3种睡眠行为与IS的相关性,计算比值比(odds ratio,OR)及其95%置信区间(confidence intervals,CI),多因素模型调整性别、年龄、家系编号、婚姻状况、教育水平、家庭年收入、吸烟、饮酒、体育活动、蔬菜水果摄入、冠心病病史、2型糖尿病病史、高血压病史、BMI、总胆固醇水平及家族史(模型二)。采用广义线性模型分析GWAS提示阳性IS基因位点与研究人群IS的关联,模型调整性别、年龄和家系编号(模型一)。在本调查人群中仍与IS存在阳性关联的位点,将进一步纳入睡眠和基因交互作用分析中。根据每个基因位点上携带致病等位基因数量进行分层,采用广义线性模型对睡眠行为与IS进行关联分析。在上述模型中加入基因和睡眠行为的2阶乘积项,得到睡眠-基因交互作用与IS的关联效应。采用R3.6.0软件进行分析,双侧检验,P<0.05认为差异有统计学意义。
2 结果
2.1 基本特征
共纳入研究对象4 648人,平均年龄(58.5±8.7)岁,男性占45.4%。IS患者1 316人,平均年龄(60.8±8.3)岁,男性占55.3%。相比于非IS患者,IS患者中男性、吸烟、高血压、冠心病及卒中家族史占比更高(P均<0.05),初中及以上教育程度、饮酒、足量运动、2型糖尿病、糖尿病及冠心病家族史占比更低(P均<0.05)。相比于非IS患者,IS患者长时间睡眠、低睡眠效率及早睡占比更高(P均<0.05,表1)。

表1 研究对象基本特征
2.2 睡眠与缺血性脑卒中的关联
研究未观察到睡眠时长与IS风险的显著关联(OR=1.04,95%CI:0.99~1.10,P=0.085,表2),在仅调整性别、年龄、家系编号的模型一中,相比于睡眠时长7.0~8.9 h,睡眠时长≥9 h的IS风险是其1.22倍(95%CI:1.04~1.43,P=0.016)。

表2 睡眠行为及其分组与缺血性脑卒中的关联
睡眠效率越高,IS风险降低(OR=0.18,95%CI:0.06~0.53,P=0.002),相比于睡眠效率≥80%,睡眠效率<80%的IS风险为其1.47倍(95%CI:1.03~2.10,P=0.033)。
相较于在22:00—22:59之间入睡,入睡时间在22:00之前的IS风险是其1.26倍(95%CI:1.04~1.52,P=0.017),而23:00之后入睡的IS风险无明显变化(P>0.05)。
2.3 GWAS提示阳性基因位点与缺血性脑卒中的关联
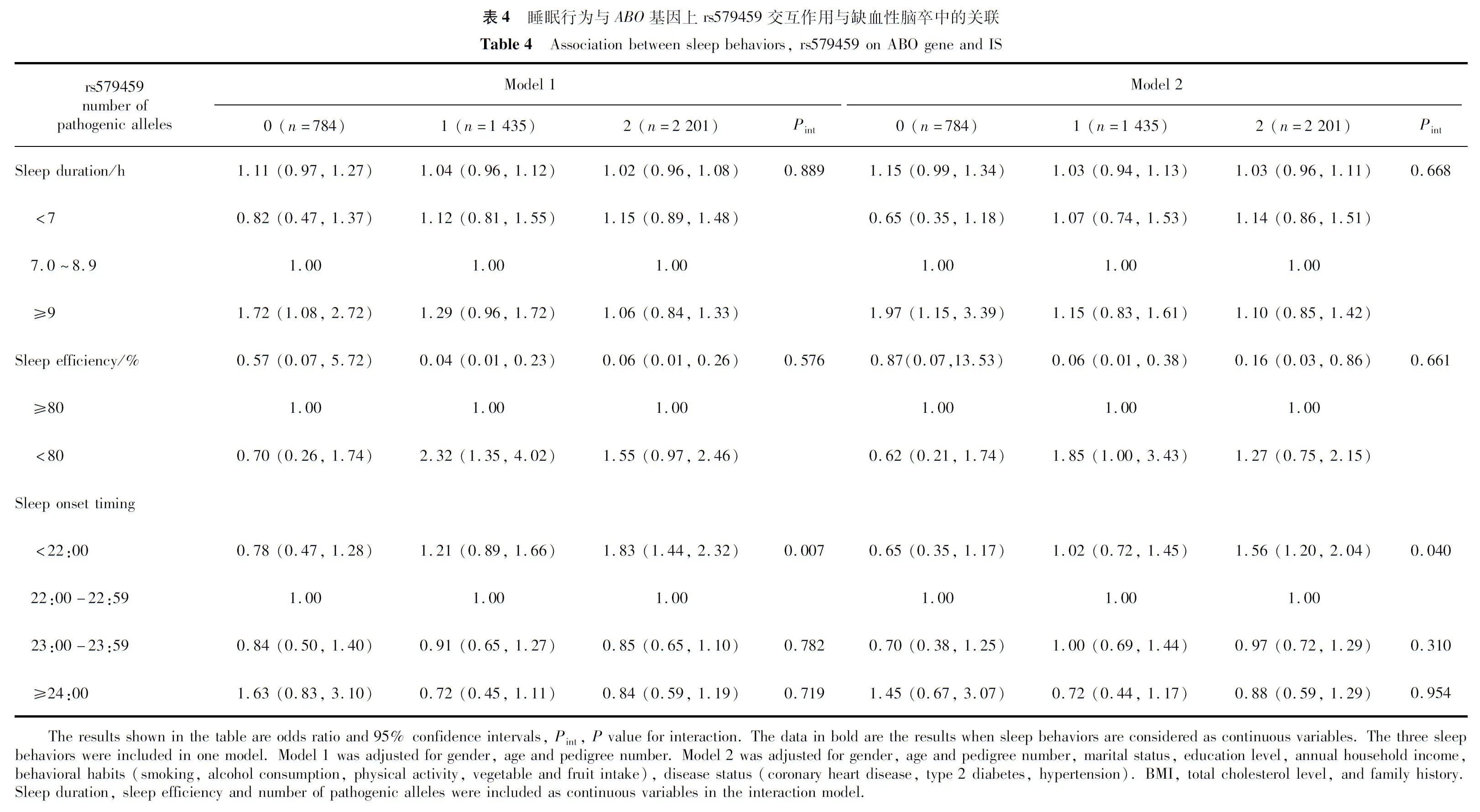
在本研究纳入的27个既往GWAS提示IS的阳性基因位点中,调整性别、年龄、家系编号后,共有7个位点在本研究人群中仍与IS显著性关联,分别是C1orf156基因上的rs10489177、SPSB4基因上的rs16851055、PITX2基因上的rs2634074、PON1基因上的rs662、ABO基因上的rs579459、NINJ2基因上的rs10849373、ZFHX3基因上的rs7193343(P均<0.05,表3)。多重校正后,仍有C1orf156-rs10489177、PITX-rs2634074、ABO-rs579459、NINJ-rs10849373呈显著关联(P均<0.05)。

表3 GWAS提示阳性基因位点信息及其与缺血性脑卒中的关联
2.4 睡眠-基因交互作用与缺血性脑卒中的关联
在本人群仍与IS相关的位点中,仅在ABO基因上rs579459和PITX2基因上rs2634074中发现睡眠行为对IS存在阳性的交互作用(表4和表5)。仅在ABO基因上rs579459致病等位基因T个数为2时,相比于入睡时间22:00—22:59,22:00之前入睡者IS风险显著升高,为其1.56倍(95%CI:1.20~2.04,P=0.001);而致病等位基因个数为0或1时,入睡时间和IS风险无显著关联。入睡时间与rs579459致病等位基因个数对IS有显著交互作用(P交互=0.040)。在PITX2基因上rs2634074致病等位基因T个数为0时,睡眠时长越长,IS风险越高(OR=1.15,95%CI:1.02~1.31,P=0.028),相比于睡眠时长7.0~8.9 h,睡眠时长≥9 h者IS风险为其1.71倍(95%CI:1.10~2.65,P=0.016);而致病等位基因个数为1或2时无显著关联。多因素模型中,睡眠时长与rs2634074致病等位基因个数对IS无显著交互作用(P交互=0.060);而在仅调整性别、年龄、家系编号的模型中,睡眠时长与rs2634074致病等位基因个数对IS有显著交互作用(P交互=0.033)。
3 讨论
本研究基于睡眠信息完整的北方农村居民4 648人资料,探讨睡眠时长、睡眠效率及入睡时间与IS的关联,并进一步分析睡眠、GWAS提示IS阳性位点与IS的交互作用,发现睡眠效率降低与IS风险增高有关,入睡时间早与较高的IS风险相关。入睡时间与ABO基因上rs579459致病等位基因T个数和IS风险存在显著交互作用。睡眠时长与PITX2基因上rs2634074致病等位基因T个数对IS风险存在潜在的交互作用。

本研究未发现睡眠时长与IS风险的线性关联。既往一项纳入16个前瞻性研究报告的meta分析也同样显示,睡眠时间与IS风险或IS病死率之间未见存在线性关系[1];研究结果还显示睡眠时间与IS风险呈U型关联,即短睡眠与长睡眠均与IS风险升高有关[2]。本研究尚未发现短睡眠与IS的关联,但在仅调整性别、年龄、家系编号后发现,相比于睡眠时长7.0~8.9 h,睡眠时长≥9 h的IS风险升高,这与既往国内研究仅报告长睡眠时间与IS风险较高相关的结果一致[3-4]。长时间睡眠和脑卒中风险的潜在机制尚不完全清楚,较长的睡眠时间可能反映了衰老过程或健康的衰退,与炎症生物标志物水平的增加有关[35]。另外,长时间睡眠与心血管危险因素,如动脉粥样硬化、左心室质量、房颤及大脑白质高强度量等相关[36-37],进而增加IS的风险。
睡眠效率常被用于客观评价睡眠质量。高效睡眠意味着深度睡眠、高质量睡眠、睡眠少受干扰。本研究发现睡眠效率与IS呈负相关。既往国外研究同样报告了较低的睡眠效率与高血压和复合心血管事件(心血管死亡、充血性心力衰竭、心肌梗死和脑卒中)发生风险增高有关[8,38]。尽管睡眠效率和IS的关联机制尚不清楚,但睡眠质量差已被发现与代谢紊乱和生活质量低有关[39],还有研究发现习惯性睡眠效率低下与心血管和皮质醇应激反应增加有关[40]。本研究发现入睡时间早于22:00的IS风险是入睡时间在22:00—22:59的1.26倍,这与既往的一项英国的前瞻性研究发现结果一致[10]。已有证据表明,长期的昼夜节律紊乱与血压升高、睡眠质量降低有关[9],还可能刺激机体产生动脉粥样硬化[41],这可能是增加心血管疾病风险的潜在生物学机制。虽然这项结论看似有悖于“早睡早起身体好”的常识,但需要强调的是,本研究人群多为中老年人,随着年龄的增长,上床睡觉的时间会倾向于提前,在中老年人中,较早上床睡觉反而可能是一种身体机能较差的信号,如衰弱、嗜睡、睡眠质量较差导致更易疲倦或因失能导致卧床等[42]。另外,因为横断面研究可能存在因果倒置,即卒中患者更有可能较早上床睡觉,所以还需要未来进一步的前瞻性研究来进一步探索,对结果的解释仍需要谨慎。
PITX2基因在IS的GWAS中被反复发现[8,32],其附近编码转录因子的变异与窦房结的发育和心脏动作电位的调节有关[43]。ABO基因上rs579459在汉族人群中也已被证实与IS相关[44]。本研究发现了入睡时间与rs579459和IS存在显著的交互作用。尽管产生交互作用的机制尚不清楚,但既往一项研究提示了睡眠和rs579459与脑卒中可能存在交互作用的潜在生物途径[45],该研究发现rs579459的等位基因T与较高的黏附分子(可溶性e-选择素、细胞间黏附分子-1)水平相关,rs579459基因型-阻塞性睡眠呼吸暂停指数与黏附分子水平存在交互作用,而较高的黏附分子水平与心血管疾病发生有关[45]。
本研究在中国人群中率先探讨并发现了睡眠效率和入睡时间与IS的阳性关联,提示对睡眠效率和入睡时间增强监测并及时进行干预和控制的重要性,同时,还探索了睡眠行为-遗传因素与IS的交互作用,提示对于具有不同遗传背景的人群,睡眠行为与IS的关联可能存在差异。睡眠行为的改善可以在一定程度上降低高遗传风险人群实际患病的风险,进一步强调了对于睡眠行为的监测和干预的意义。在未来基因筛查技术不断进步的背景下,对不同基因分型人群可采取更具针对性的睡眠行为干预措施,以达到精准防控疾病的目的。本研究各环节进行严格质量控制,分析过程中采取多种模型控制各种混杂因素,结果可靠性较高。但本研究仍具有一定的局限性,首先,本研究是横断面研究,不具备时序性,无法进行因果推断,睡眠行为既可主观调控,又可作为客观反映睡眠质量及身体健康的指标(尤其是睡眠效率),横断面研究只能在一定程度上反映睡眠行为和疾病在同一时间点的相关性,还需要更长期的随访观察资料,进行前瞻性的纵向研究;其次,本研究的睡眠信息均来源于自报,可能存在一定的信息偏倚,如睡眠时长和上床时间均来自研究对象对自己大多情况的一个平均估计,而入睡时长更难推测,仅能通过主观对自己容易或较难入睡的印象进行外推,更易受到主观情绪的影响去夸张的估计,使结果偏向于否定无效假设,未来可以通过睡眠监测设备进一步收集更为客观的睡眠信息;再次,本研究测定的基因位点有限,未来需要测定更多的基因位点深入研究。
综上所述,睡眠效率降低与IS风险增高有关,入睡时间早于22:00与较高的IS风险相关。入睡时间与ABO基因上rs579459和IS风险有显著交互作用。睡眠时长与PITX2基因上rs2634074和IS风险可能存在潜在的交互作用。
