香蕉弯孢霉叶斑病菌对戊唑醇的敏感性及抗药性突变体的生物学特性
2022-06-10刘桂芹周宇烨
刘桂芹,周宇烨,李 鑫
(1 廊坊职业技术学院,河北廊坊,065000;2 广东石油化工学院生物与食品工程学院,广东茂名,525000;3 广东省茂名市水果科学研究所,广东茂名,525000)
香蕉是重要的水果之一,种植面积较广,现已成为农户脱贫致富的重要产业,我国香蕉产地主要集中在海南、广东、广西、云南、福建等地区。近些年随着种植面积的增大,种植年限的延长,病虫害也呈逐年增加的趋势[1]。香蕉叶斑病是香蕉的重大病害,主要为害香蕉叶片,在叶片上形成病斑,影响植株的光合作用。当病害发生较重时,叶片干枯死亡,严重影响香蕉产量[2]。香蕉叶斑病由多种病原真菌单独或复合侵染引起,主要包括褐缘灰斑病、灰纹病和煤纹病等[3]。弯孢霉叶斑病菌Curvularialunata(Walker)Boedijin是香蕉叶斑病的主要病原,每年7—9月高温高湿季节,叶斑病发生较重,病叶率可达20%~40%,严重时可达80%[4]。目前,香蕉叶斑病的防治主要以化学防治为主,常见的防治药剂主要有戊唑醇、丙环唑、苯醚甲环唑、吡唑醚菌酯、啶氧菌酯、氟环唑、代森锰锌、甲基托布津等[5-6]。戊唑醇属于三唑类杀菌剂,具有较好的保护、治疗、铲除作用,戊唑醇杀菌谱广、持效期长,对多种植物病原菌具有较好的抑制作用,主要抑制真菌麦角甾醇的生物合成[7]。戊唑醇作用位点单一,且生产上已经有多年的用药史,病原菌在长期单一的药剂选择压力下,势必会诱发病原菌抗药性的产生,目前杀菌剂抗性行动委员会(FRAC)已将戊唑醇列为中等抗性风险药剂[8]。已有研究报道多种病原真菌对戊唑醇产生了不同程度的抗药性。Chen等[9]对2018—2020年从河南小麦分离鉴定的1 118株禾谷镰孢菌进行抗药性检测,发现362株(30.7%)对戊唑醇产生了抗药性。Fan等[10]测定了146株苹果葡萄球菌对戊唑醇的敏感性,发现1株抗性菌株且可稳定遗传。Wei等[11]测定了48株辣椒炭疽菌对戊唑醇的敏感性,发现6株抗性菌株;通过氨基酸序列比对发现,抗性菌株CgCYP51基因部分位点发生了替换。植物病原菌抗药性监测一直是植物保护工作的重要内容,加强病原菌抗药性监测能够及时充分地了解田间病原菌对药剂的敏感性,对药剂使用及病害防治具有重要指导作用。戊唑醇是防治香蕉叶斑病常用药剂,目前鲜见香蕉叶斑病菌对戊唑醇的抗药性报道。为充分了解我国香蕉产区叶斑病菌对戊唑醇的敏感性情况,本研究从广西、广东、海南、云南、福建等地采集分离香蕉叶斑病菌,测定分离菌株对戊唑醇的敏感性;同时探究香蕉弯孢霉叶斑病菌对戊唑醇产生抗药性突变的可能性,及所获抗性突变体的生物学特性,以评估香蕉弯孢霉叶斑病菌对戊唑醇的抗性风险,以期为香蕉弯孢霉叶斑病的防治及戊唑醇药剂的使用提供参考。
1 材料与方法
1.1 材料
供试菌株:采用组织分离,单孢纯化,鉴定香蕉弯孢霉叶斑病菌168株后,接种于PDA试管斜面保存备用。其中广西病菌32株、广东26株、海南38株、云南40株、福建32株。供试药剂:98%戊唑醇(tebuconazole)原药,江苏龙灯化学有限公司产。
1.2 方法
1.2.1 含药培养基的制备 准确称取一定量的98%戊唑醇原药,先用少量丙酮溶解后加入无菌水定容至100 mL,配制浓度为1 000 mg/L母液,再用无菌水将母液稀释为100、80、50、25、10、5、2.5 mg/L不同浓度药液,用移液枪分别移取不同浓度药液20 mL,加入到冷却至50 ℃左右180 mL PDA培养基中,充分混合均匀,制成10、8、5、2.5、1、0.5、0.25 mg/L含药培养基平板。每处理浓度重复3次,以不加药液的PDA培养基为对照。
1.2.2 病菌对戊唑醇的敏感性测定 用直径5 mm的打孔器取培养6 d的香蕉弯孢霉叶斑病菌,接种于不同浓度药液平板上,以PDA培养基平板为对照(空白),每处理重复3次,置于28 ℃恒温培养箱中黑暗培养5 d后,用十字交叉法测量菌落直径,以浓度对数(x)为横轴,抑菌率的机率值(y)为纵轴求戊唑醇对香蕉弯孢霉叶斑病菌的毒力回归方程y=ax+b,并计算抑制菌丝体生长的有效中浓度EC50值及r2。抑菌率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-5)×100。
1.2.3 香蕉弯孢霉叶斑病菌抗戊唑醇突变体的获得
1.2.3.1 亲本菌株的MIC值测定 根据香蕉弯孢霉叶斑病菌对戊唑醇的敏感性,从广东、海南、广西、福建、云南等5地分别随机抽取相对敏感的菌株各3株,共计15株,按照1.2.1的药剂浓度和1.2.2的方法测定戊唑醇对亲本菌株的最低抑菌浓度(MIC)值。
1.2.3.2 药剂连续诱导 将选取获得的15株菌株(亲本菌株)在各自菌株EC50值浓度下逐代诱导,每隔3 d转接1代,并逐渐增加药剂浓度,直至菌株可以在最低抑菌浓度(MIC)上生长。以各自亲本菌株为对照,计算药剂诱导后的抗性倍数。
1.2.3.3 紫外线诱导 将1.2.3.1挑选出的亲本菌株15株,接种至各自菌株MIC浓度平板中,每菌株接种20皿,每皿接种5个菌饼,将其置于事先预热15 min的紫外灯(20 W,254 nm)下方垂直距离20 cm处照射60 s,封口置于28 ℃恒温培养箱黑暗培养3 d,以紫外灯未照射的亲本菌株为对照,能在MIC浓度中生长的菌株则为疑似抗性菌株,测定菌株敏感性,计算抗性倍数和抗性频率。
1.2.3.4 抗性评价 抗性水平划分参照FAO标准[12],抗性水平<5,敏感菌株(S);5<抗性水平<10,低抗菌株(LR);10<抗性水平<40,中抗菌株(MR);抗性水平>40,高抗菌株(HR)。药剂连续诱导和紫外线诱导抗性倍数=抗性突变体EC50/亲本菌株EC50,整个群体菌株抗性倍数=供试菌株EC50/敏感性基线EC50;根据抗性菌株在整个群体中出现的频率计算抗性菌株频率[13],抗性菌株频率(%)=(抗性菌株数/供试菌株数)×100。
1.2.4 抗性菌株的生物学特性 生长速度及生长量测定:将抗性菌株与亲本菌株在PDA培养基上28 ℃黑暗培养4 d后,用直径5 mm打孔器于菌落边缘取菌饼,继续转接至PDA培养基上,于28 ℃黑暗条件下再培养4 d,测量菌落直径,计算菌丝生长速率,每菌株重复3次。同时分别取抗性菌株与亲本菌株菌饼各5个,分别接种于PDB液体培养基中,28 ℃避光120 r/min振荡培养5 d,抽滤得到菌丝,于80 ℃ 烘干,称量菌丝干重,每菌株重复3瓶。
抗性菌株遗传稳定性测定:将获得的抗性菌株在PDA培养基上连续培养15代,每隔5代测定其敏感性,比较F0、F5、F10及F15代菌株对药剂的敏感性,分析抗性菌株对戊唑醇的抗性能否稳定遗传。
2 结果与分析
2.1 病菌对戊唑醇的敏感性
测定168株香蕉弯孢霉叶斑病菌对戊唑醇的敏感性发现,随着药剂浓度增加,菌饼直径越小,菌株(GX-8)在不同浓度药液下的生长情况见图1。168株香蕉弯孢霉叶斑病菌对戊唑醇的敏感性存在一定差异,供试菌株对戊唑醇的EC50介于0.561 4~8.624 2 μg/mL之间,平均值(4.517 3 ± 1.270 6)mg/L。其中,采自云南省红河州河口县的菌株YN-16的EC50最小,为0.561 4 mg/L;采自海南省临高县的菌株HN-12的EC50最大,为8.624 2 mg/L,最大EC50是最小EC50的15.36倍。

图1 不同浓度戊唑醇平板上香蕉弯孢霉叶斑病菌(GX-8)菌丝生长情况
2.2 病菌对戊唑醇敏感性基线的建立
将香蕉弯孢霉叶斑病菌对戊唑醇的敏感性划分为7个区间,以菌株敏感性分布为横坐标,菌株频率分布为纵坐标绘制菌株对戊唑醇的敏感性分布。由图2可知,香蕉弯孢霉叶斑病菌对戊唑醇的敏感性分布呈连续性单峰曲线,采用 SPSS软件进行K-S法正态性检验,得Z=0.962 7,p=0.251 8(>0.05),表明供试菌株对戊唑醇的敏感性分布符合正态分布。因此,可将EC50的平均值4.517 3mg/L作为香蕉弯孢霉叶斑病菌对戊唑醇的敏感性基线。
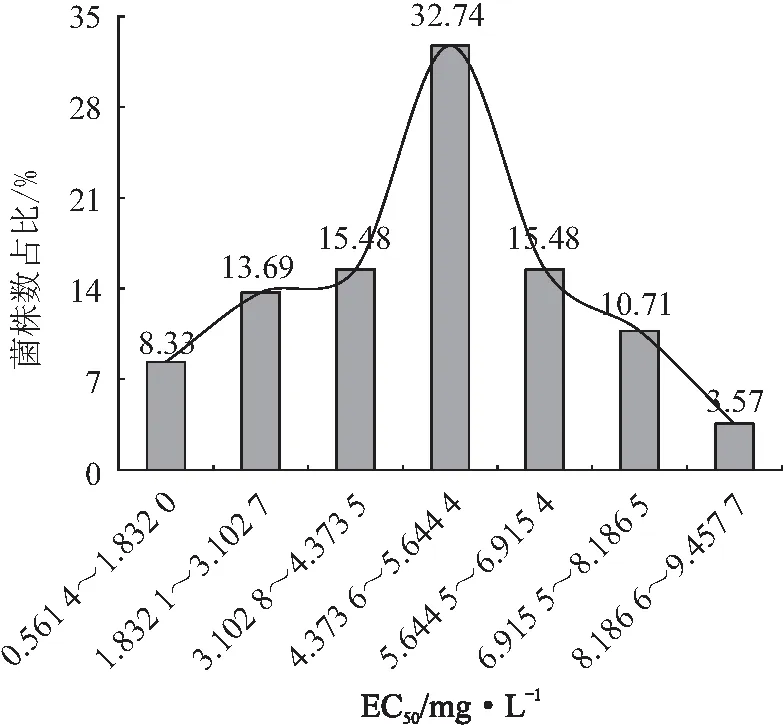
图2 168株香蕉弯孢霉叶斑病菌对戊唑醇的敏感性频率分布
2.3 病菌对戊唑醇的抗药性
通过测定168株香蕉弯孢霉叶斑病菌对戊唑醇的敏感性,计算其EC50,以敏感性基线为基准,计算抗性倍数,并根据FAO抗性分级标准进行评价发现,168株菌株均为敏感菌株,未检测到抗性菌株,最大EC50是最小EC50的15.36倍;且有79株菌株EC50大于平均值,有发展成为抗性菌株的潜在可能。
2.4 不同省(区)病菌对戊唑醇的敏感性
从表1可以看出,不同省(区)的香蕉叶斑病菌对戊唑醇的敏感性存在差异,来自海南的菌株EC50平均值最高,为4.607 3 mg/L;来自云南的菌株EC50平均值最小,为3.812 4 mg/L,不同省(区)病菌EC50平均值从大到小依次为海南>广东>广西>福建>云南。
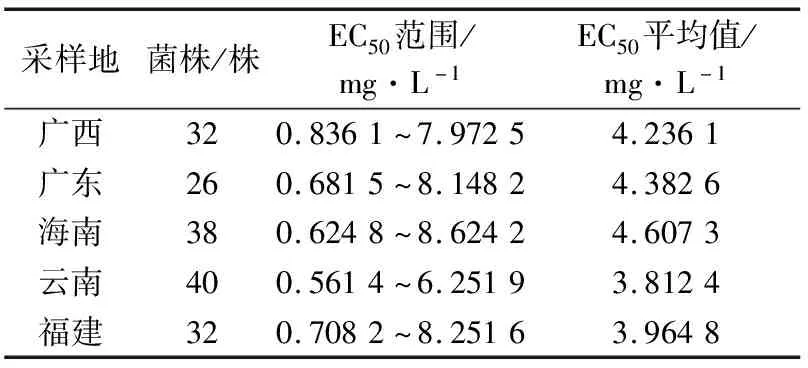
表1 不同省(区)香蕉弯孢霉叶斑病菌对戊唑醇的敏感性
2.5 抗戊唑醇菌株的获得
从表2可以看出,经戊唑醇连续诱导多代后,随着诱导代数增加,菌株敏感性逐渐降低,但变化并不大,仅有6株菌株产生了抗性,分别是亲本菌株GX-22、HN-6、HN-18、FJ-11,抗性倍数介于5.64~10.13之间;抗性突变体除GX-22-R1为中抗菌株外,其余抗性突变体均为低抗菌株。通过紫外线诱导后,共获得抗性菌株8株,分别是亲本菌株HN-4、GD-7、YN-10,突变频率为0.53%。突变体抗性倍数介于5.88~15.60之间,其中4株菌株为中抗菌株,其余为低抗菌株。
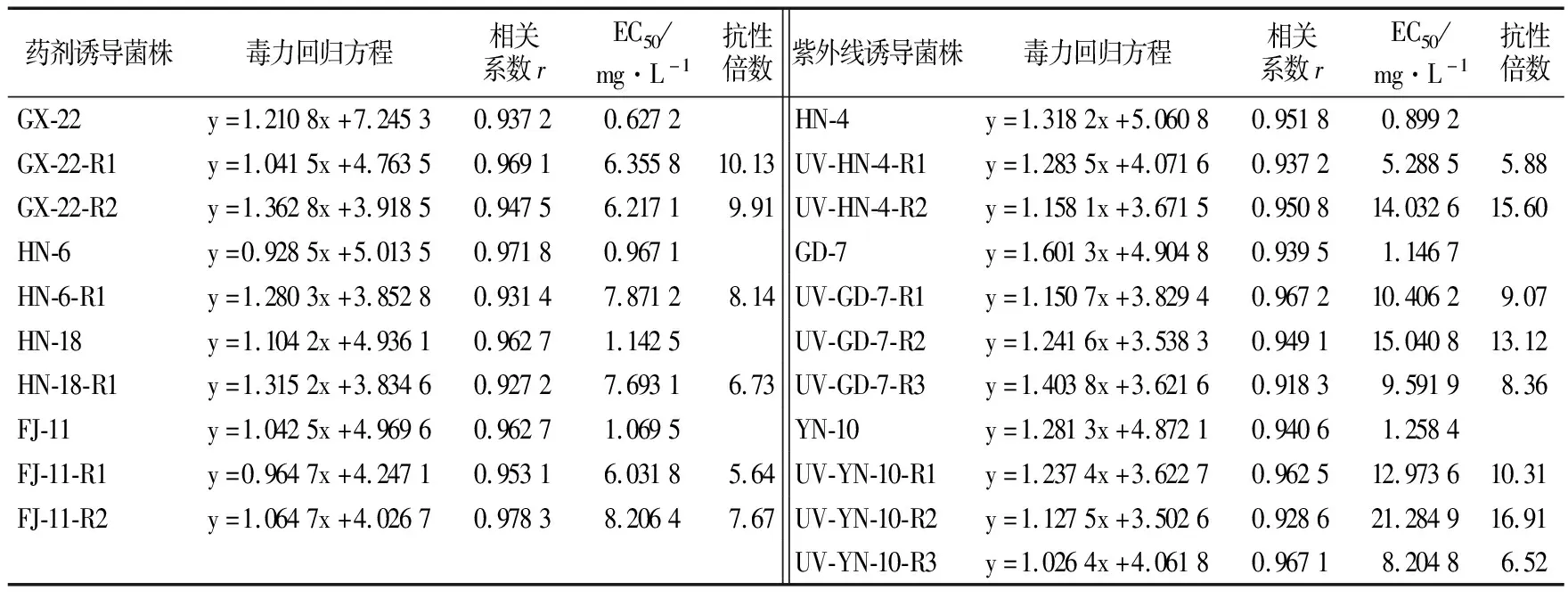
表2 药剂和紫外线诱导的香蕉弯孢霉叶斑病菌抗性菌株对戊唑醇的抗性水平
2.6 抗戊唑醇突变菌株的生物学特性
2.6.1 菌丝生长速度及干质量 从表3可以看出,抗性突变体菌丝生长速度和菌丝干质量均低于亲本菌株,药剂诱导获得的抗药突变体菌丝生长速度减退率介于7.94%~18.12%之间,菌丝干质量减退率介于12.12%~22.06%之间;紫外线诱导获得的抗药突变体菌丝生长速度减退率介于6.70%~19.23%之间,菌丝干质量减退率介于7.14%~27.59%之间。表明抗性菌株的生物适合度有所降低。
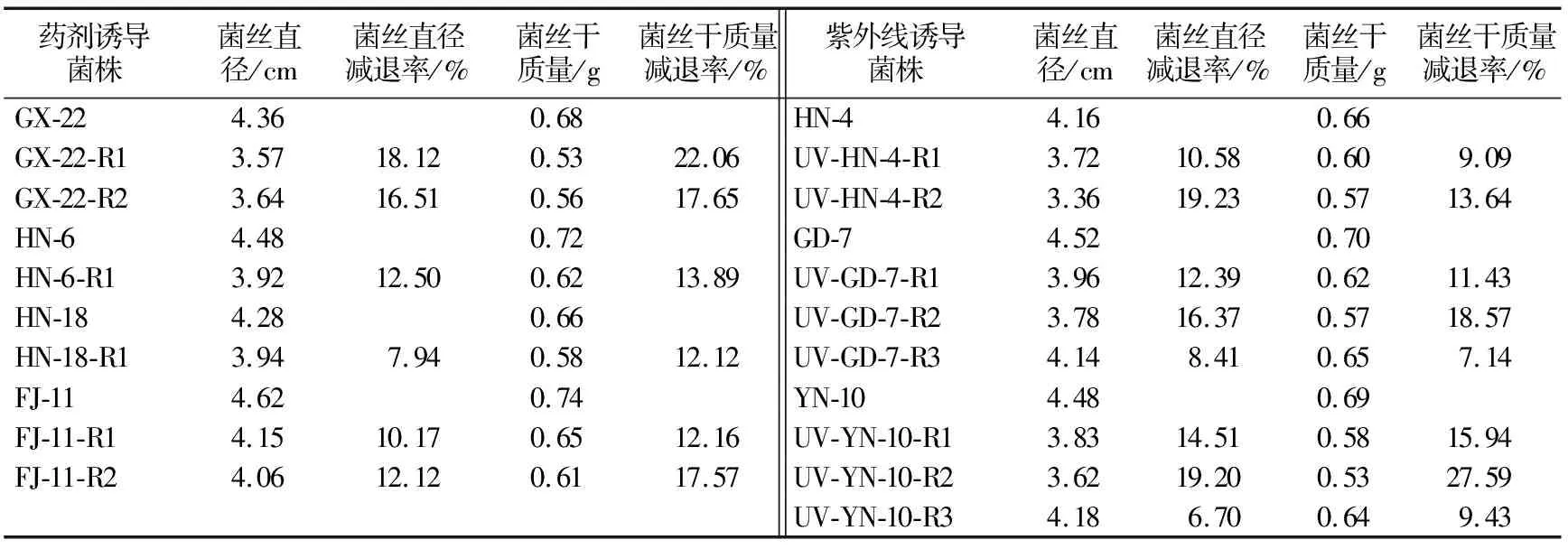
表3 药剂和紫外线诱导的香蕉弯孢霉叶斑病菌抗性突变菌株菌丝生长情况
2.6.2 遗传稳定性 从表4可以看出,药剂诱导获得的突变体菌株,只有GX-22-R2抗性突变菌株可以稳定遗传,其余抗性突变菌株均随着转接代数的增加,药剂敏感性逐渐增加。紫外诱导获得的突变体菌株,有3株菌株抗性可以稳定性遗传,分别为抗性突变菌株 UV-GD-7-R2、UV-YN-10-R1、UV-YN-10-R2,其余抗性突变菌株均随着转接代数的增加,药剂敏感性逐渐增加。
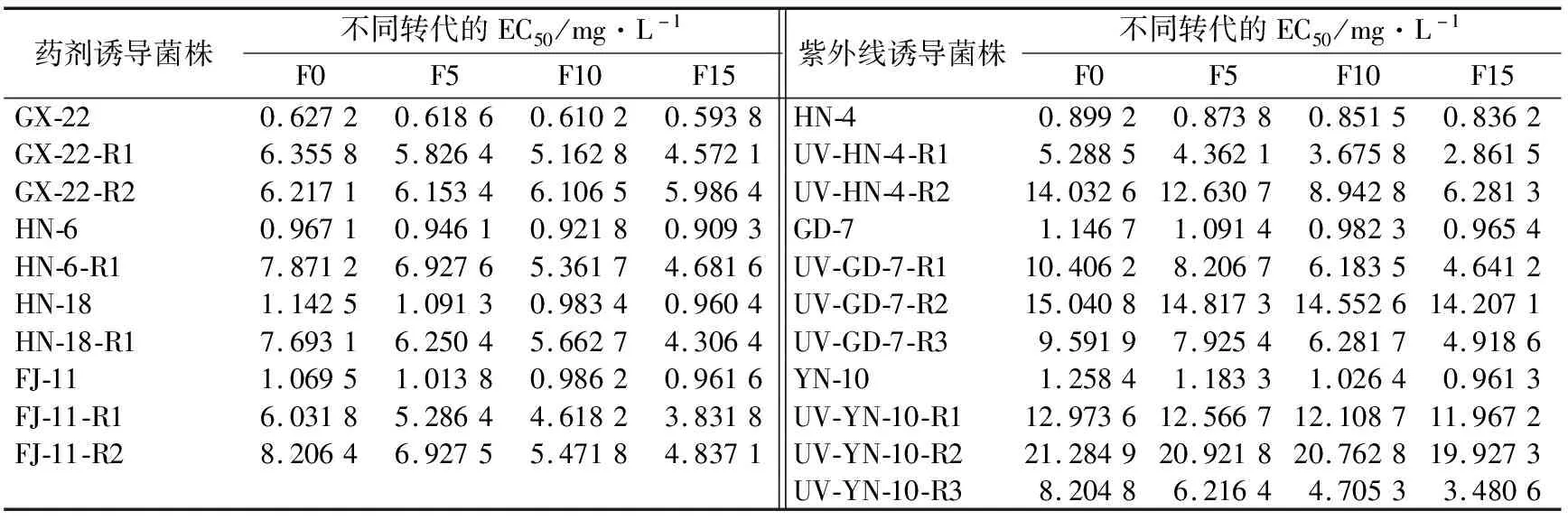
表4 药剂和紫外线诱导的抗戊唑醇香蕉弯孢霉叶斑病菌株遗传稳定性
3 结论与讨论
由弯孢霉引起的香蕉叶斑病是香蕉生产上的重大病害,目前防治主要依赖化学防治。化学防治效果较好,可以在短时间内抑制病害发生;但长期频繁使用化学药剂也促使病原菌抗药性的产生,开展病菌药剂敏感性测定和抗性评价对药剂的使用具有重要意义[14]。戊唑醇是生产上使用较广的杀菌剂,已在世界上50多个国家的60多种作物上获得登记[15],也是防治香蕉叶斑病常见药剂,在防治香蕉叶斑病中已使用多年。本研究测定了168株弯孢霉叶斑病菌对戊唑醇的敏感性,发现所有菌株对戊唑醇仍保持较好的敏感性,未出现敏感性下降的群体,但最敏感菌株和最抗菌株EC50相差15.36倍,可能存在潜在的抗药性风险。因此,药剂使用应当合理选择药剂浓度或交替轮换其他杀菌剂,避免抗药性发生。试验比较了不同省(区)菌株敏感性发现,不同省(区)之间病菌敏感性存在一定差异,这可能是由于不同省(区)之间生态位差异导致病害发生程度不同,导致各省(区)的用药水平、用药次数等不同。敏感性基线建立是抗药性监测的重要依据,国内外已经建立了多种病原菌对药剂的敏感性基线;而目前香蕉叶斑病的研究主要集中于室内药剂筛选和田间药剂防治,鲜见关于香蕉弯孢霉叶斑病菌杀菌剂敏感性基线的报道。本文建立了弯孢霉叶斑病菌对戊唑醇的敏感性基线,可为香蕉弯孢霉叶斑病菌的抗药性监测提供重要参考。
室内药剂诱导和紫外线诱导是获得抗性突变菌株常见的方法,本研究通过这两种方法仅获得少量抗性突变体,抗性频率和抗性倍数较低。当病原菌对药剂产生抗性时,往往伴随着一系列生物学特性的改变[16],本研究对诱导获得的抗性突变菌株开展生物学特性测定发现,抗性突变菌株菌丝生长速度、菌丝干质量均低于亲本菌株,仅有少量抗性菌株抗性可以稳定遗传,说明抗性菌株适合度比较低。因此,推测香蕉弯孢霉叶斑病菌对戊唑醇的抗性风险较低,生产上可继续使用戊唑醇防治香蕉弯孢霉叶斑病。
戊唑醇作为重要的三唑类杀菌剂,被广泛应用于生产,主要抑制麦角甾醇的生物合成,其抗药性一直备受关注。近些年随着分子生物学技术的发展,从分子水平可以阐述其抗性机理。研究发现,病原菌对戊唑醇的抗药性可能与靶标基因发生碱基突变、靶标基因过量表达、病原菌对药剂的外排能力增强、靶标同源基因补偿有关[17]。当戊唑醇的靶蛋白编码基因(CYP51)发生碱基突变,促使靶标蛋白构象改变,导致药剂与靶标蛋白的结合能力下降,从而引发病原菌抗药性产生[18-19]。当CYP51基因过量表达,会产生过多的靶标蛋白,从而使药剂浓度增加,导致药剂抗药性产生[20]。ABC或MFS运输蛋白是丝状真菌转运毒素的外排泵,当转运蛋白被过度表达,会降低药剂对细胞的毒害作用,从而产生抗药性[21]。靶标基因存在多个旁系同源基因,当靶标蛋白受到杀菌剂抑制时,旁系同源基因会被诱导表达,维持细胞的正常生理作用,从而导致抗药性的产生[22]。杀菌剂抗药性涉及面较广,本文只从药剂敏感性、药剂诱导和紫外诱导评价香蕉弯孢霉叶斑病对戊唑醇的抗药性,抗性菌株的抗性机理有待进一步研究。
