控释肥残膜积累对土壤微生物群落组成的影响*
2022-06-10王学霞邹国元张佳佳王甲辰刘东生陈延华
王学霞,曹 兵,邹国元,张佳佳,王甲辰,刘东生,陈延华**
(1.北京市农林科学院植物营养与资源研究所 北京 100097;2.北京市缓控释肥料工程技术研究中心 北京 100097)
包膜控释肥在调控肥料养分的释放速率,提高肥料利用率,降低肥料损失,减少环境污染等方面发挥积极作用,已广泛应用到农业生产中。在肥料养分释放完后,残留在土壤中的高分子膜壳降解缓慢甚至不降解,可能对土壤结构和环境带来潜在危险。残留的膜壳直径为4~5 mm,相当于微塑料(<5 mm)级别,随着包膜肥料常年施用,这些微塑料级别的残膜积累或降解过程中的产物是否会对土壤环境安全性产生影响,是农业生态环境可持续发展中不能回避的问题,而当前关于此方面的研究还未见系统报道。
在自然条件下,这些高分子残膜在光、热、水、化学作用、机械力等多种因素综合作用下发生一定程度的降解,但是由于其分子量较大、分子链长、结构复杂,不容易被微生物分解,在自然界中降解极慢,残留性极强,对土壤和水体生态系统的影响长期存在。迄今国内外学者有关控释肥残膜对土壤环境的影响主要集中在土壤理化性质和土壤酶活性等方面。鄂玉联等发现聚氨酯残膜施入土壤后改善了盐渍化土壤结构,增加土壤团聚体数量,尤其增加2.00~0.053 mm 土壤团聚体含量。Abobatta研究显示聚丙烯酰胺类残膜施入土壤后,短期内在周围土壤形成一个水分、营养都很充足的微环境,使得微域中的微生物数量增加、植物根系变发达,土壤微生物活动和酶活性得以增强。已有的研究证实大多数控释肥料的高分子包膜具有土壤改良剂和控制养分释放的双重作用,这些高分子残膜短期内能改善土壤质量,对土壤理化性质具有积极影响。
土壤微生物作为土壤生态系统中最重要组成部分之一,维系着土壤生态结构和功能稳定,在土壤有机质分解和促进营养循环等方面起到积极作用,对其生存的微环境变化极为敏感。迄今为止,只有少量研究报道了残膜在土壤中积累及降解过程中可能形成微塑料、小分子有机物等中间产物对土壤微生物的群落结构及功能产生的影响。Liang 等研究发现聚丙烯酸酯残膜在降解过程中对土壤中优势菌群落组成、多样性无显著影响;Huang 等研究表明聚乙烯残膜降解可改变土壤微生物群落组成,其影响程度受残膜性质和土壤环境因子的协同作用;Murugan 等研究表明,聚羟基烷酸酯残膜降解过程中能提高根际细菌和真菌数量和群落多样性。Pan 等发现聚氨酯与水溶性丙烯酸酯残膜累积和降解对黑土微生物群落结构组成与多样性无显著影响;Faccia 等发现生物降解性聚醚聚氨酯残膜在土壤中的降解主要受细菌控制,其中假单胞菌科(Pseudomonadaceae)、慢生根瘤科(Bradyrhizobiaceae)与降解速率密切相关;Barratt 等研究聚氨酯膜在土壤中的降解真菌起到主导作用,其影响程度受土壤含水量的影响。但关于控释肥残膜对土壤微生物群落组成的影响研究没有得出一致性结论。聚氨酯类包膜控释肥作为近年来国内外广泛推广应用的控释肥,有关其残膜在土壤中累积和降解对土壤微生物的影响也应该得到关注。因此,厘清土壤微生物群落对不同浓度梯度聚氨酯残膜的响应趋势及影响因素,对全面了解控释肥残膜的生态环境效应具有重要意义。基于此,本研究利用盆栽模拟试验,采用Illumina HiSeq 高通量测序技术,探究了5 个氨酯残膜量下土壤理化性质及细菌、真菌群落组成和多样性的变化,揭示了土壤微生物群落组成对不同氨酯残膜积累的响应趋势和机制,以期全面了解和评价控释肥残膜的生态环境效应。
1 材料与方法
1.1 试验材料制备
选择北京市农林科学院制备的纳米聚氨酯包膜控释肥[包膜是由异氰酸酯和生物基多元醇(蓖麻油及少量改性纤维素、淀粉、甘油)、少量纳米二氧化硅自动反应成膜工艺制备],使膜产生细缝,用自来水浸泡并冲洗掉全部的核芯肥料后,再将残膜用自来水冲洗3 次,再用蒸馏水漂洗3 次,置于干燥箱中50 ℃烘干,挑选完整溶出肥料核芯的形状完整的膜壳(残膜,直径大小在3.60~4.00 mm),备用。
1.2 试验设置
模拟盆栽试验在北京市农林科学院院内大温室进行。试验所用盆规格为25 cm (高)×50 cm (长)×30 cm(宽)。每盆装入10 kg 土,每盆种植1 株玉米()。试验地土壤为褐土,含全氮1.45 g·kg,速效磷10.36 mg·kg,速效钾124.27 mg·kg,有机质19.20 g·kg,pH 7.90;黏 粒(<0.002 mm)占26.87%,粉 粒(0.02~0.002 mm)占43.33%,砂 粒(2.00~0.02 mm)占29.80%。
根据华北小麦()-玉米轮作地区施氮水平中值380 kg(N)·hm,计算出在该施氮水平条件下施入聚氨酯包膜尿素(膜壳含量为3.20%,氮含量为43.00%)所带入土壤中的包膜含量为28 kg·hm,以0 倍、5 倍、10 倍、20 倍、50 倍的膜壳量为梯度,共设置5 个处理,分别为对照(不加膜,CK)、CR1 (施入0.062 g·kg聚氨酯膜壳)、CR2(施入0.124 g·kg聚氨酯膜壳)、CR3 (施入0.620 g·kg聚氨酯膜壳)和CR4 (施入1.24 g·kg聚氨酯膜壳),每个处理设20 个重复。氮磷钾肥分别为尿素、过磷酸钙和氯化钾,N、P 和K 的施用量分别为380 kg·hm、230 kg·hm和300 kg·hm;尿素施加方式是底肥占40%,大喇叭口和抽雄期2 次追肥分别占30%;所有处理的磷钾均一次性施入。
1.3 试验方法
4月20日将膜均匀埋入土壤中(深度大于5 cm 处)后,每隔20 d 取样1 次,直到120 d,每个处理每次取3 个重复(3 盆)。土壤过1 mm 筛将所有残膜捡出,用自来水冲洗3 次,再用蒸馏水漂洗3 次,放培养皿中50 ℃烘干,称重。用重量法检测残膜的降解速率。
在埋聚氨酯残膜同时种植玉米(‘先玉1466’)。8月20日(埋膜后120 d)收获玉米地上部分与根系,72 ℃烘干称重,检测玉米地上部与根的生物量。同时取非根际土,土壤样品分为3 部分,一部分风干用于分析土壤理化性状,一部分-20 ℃冰箱保存用于检测NH-N 和NO-N,一部分-80 ℃冰箱保存检测土壤微生物群落组成。
土壤pH 利用酸度计(S210 SevenCompact,Mettler Toledo,瑞士) (水土比2.5∶1)测定,土壤湿度(SM)采用温湿度探头(TPJ-21-G,浙江托普云农科技股份有限公司)检测;土壤总有机碳(TOC)、可溶性有机碳(DOC)采用总有机碳分析仪(Vario EI,Elementar,德国)测定;土壤速效磷(AP)、NH-N 和NO-N 采用流动分析仪检测分析(AA3,Bran+Luebbe,德国);土壤总氮(TN)采用凯氏定氮法(SKD-200,上海沛欧分析仪器有限公司)测定;土壤速效钾(AK)采用火焰光度法测定(FP6450,上海精科仪器公司)。
土壤微生物DNA 提取。称取冷冻土壤样品0.5 g,采用Power Soil™DNA 提取试剂盒 (MO BIO Laboratories,USA)进行土壤总DNA 基因组提取。对提取到的基因组DNA 进行琼脂糖电泳检测(10 mmol·LTris-HCl,1 mmol·LEDTA pH 8.0),用NanoDrop 2000 (Thermo Scientific,USA)测定DNA 含量与质量。
高通量测序。采用Illumina MiSeq 测序分析土壤细菌群落和真菌群落的组成。分别用引物515F/907R 和ITS1F/2043R 扩增细菌16S rRNA 基因的V3-V5 区域和真菌ITS 基因。合并扩增产物并在2%琼脂糖凝胶(TBE 缓冲液)上评估,在Illumina MiSeq Genome Sequome PE300 Titanium 平台(上海美吉生物医药科技有限公司,中国)上进行测序。
对Illumina MiSeq 测序原始数据进行拼接、过滤、聚类分析及物种注释。其中,序列拼接利用FLASH(V1.2.7)、序列过滤利用QIIME (V1.7.0)、聚类利用UPARSE pipeline (V7.0.1001)、物种注释利用RDP classifier (V2.2)软件。此外,利用QIIME 计算不同样品中细菌和真菌群落的α 多样性,包括采用OTU 实际观察数量(OTUs)、辛普森指数(Simpson)、ACE指数、Chao 指数和香农指数(Shannon)。
1.4 统计分析
利用SPSS 22.0 进行单因素方差分析(one-way analysis of variance)。利用R (V3.6.1)软件基于Bray-Curtis 距离算法进行主坐标分析(principal coordinate analysis,PCoA),利用R (Vegan) Mantel 检验进行微生物与土壤环境因子间关系分析(Pearson 相关系数)。文中数据均为平均数±标准误。
2 结果与分析
2.1 聚氨酯残膜降解分析
聚氨酯残膜累积降解率随时间()的变化如图1所示,短期内聚氨酯残膜在土壤中可以部分降解,不同残膜处理间其累积降解率差异不显著(图1A)。随着暴露时间的增加,平均累积降解率不断增加,120 d内可达10.02% (图1B)。

图1 不同添加量下土壤中聚氨酯残膜累积降解速率(A)和平均累积降解率(B) (n=12)Fig.1 Cumulative degradation rates under different addition rates (A) and their average (B) of polyurethane residual film in soil(n=12)
2.2 土壤理化性质分析
如表1所示,不同处理间土壤理化性质差异较小。土壤pH、总氮(TN)、速效磷(AP)、速效钾(AK)、NH-N 含量在不同处理间差异不显著。土壤含水量(SM)为14.98%~18.24%,呈随残膜施加量增加而增加的趋势,CR4 处理土壤含水量显著高于CK 处理(<0.05)。土壤中可溶性有机碳(DOC)含量也随残膜施加量增加而增加,且CR3 和CR4 处理显著高于CK 处理(<0.05);CR3 处理土壤中NO-N 含量显著高于CK 处理(<0.05),其他处理间差异不显著。不同处理间玉米地上生物量(AGB)随残膜添加量增加而增加,但差异不显著;聚氨酯残膜添加处理增加了玉米地下生物量(BGB),CK 和CR4 处理BGB 差异显著(<0.05)。由于高分子树脂残膜的存在不但提高土壤持水能力,而且增加了土壤孔隙度,因此聚氨酯残膜添加可提高土壤的含水量和玉米地下生物量。

表1 不同处理下土壤理化性质与玉米生物量变化Table 1 Soil physical and chemical properties and maize biomass under different treatments
2.3 土壤微生物测序结果分析
通过Illumina 高通量测序平台对细菌16S rRNA基因V3-V4 区测序,共得到有效序列943 610 条,统计各样品在不同OTUs 中的丰度信息,得到66 175 个OUTs;与CK 相比,CR2、CR3 和CR4 处理有效序列和OTUs 均显著增加(<0.05)。对真菌ITS rRNA 基因测序获得有效序列486 620 条,6120 个OUTs;与CK 相比,CR3 和CR4 处理有效序列显著增加(<0.05),CR4显著增加了真菌OUTs 数量(<0.05)(表2)。可见,添加聚氨酯残膜短期内增加了细菌和真菌OUTs 数量。

表2 不同处理下土壤细菌和真菌的序列数统计Table 2 Statistics of sample sequence of soil bacteria and funge under different treatments
2.4 土壤微生物群落多样性分析
聚氨酯残膜添加对土壤细菌和真菌多样性的影响如表3所示。按97%相似度聚类,各样品文库覆盖率均在97.4%以上,能够反映试验土壤微生物群落的真实情况。残膜埋入土壤120 d,土壤细菌群落丰度Ace、Chao 指数和Shannon 多样性指数均随添加量的增加而增加。与CK 相比,CR4 处理显著增加这些指数(<0.05),其他处理之间差异不明显。不同处理间土壤真菌群落丰度Ace、Chao 指数和Shannon 多样性指数差异均不显著。由此,聚氨酯残膜添加短期内提高了土壤细菌群落丰度和多样性,而对土壤真菌群落丰度和多样性影响不明显。
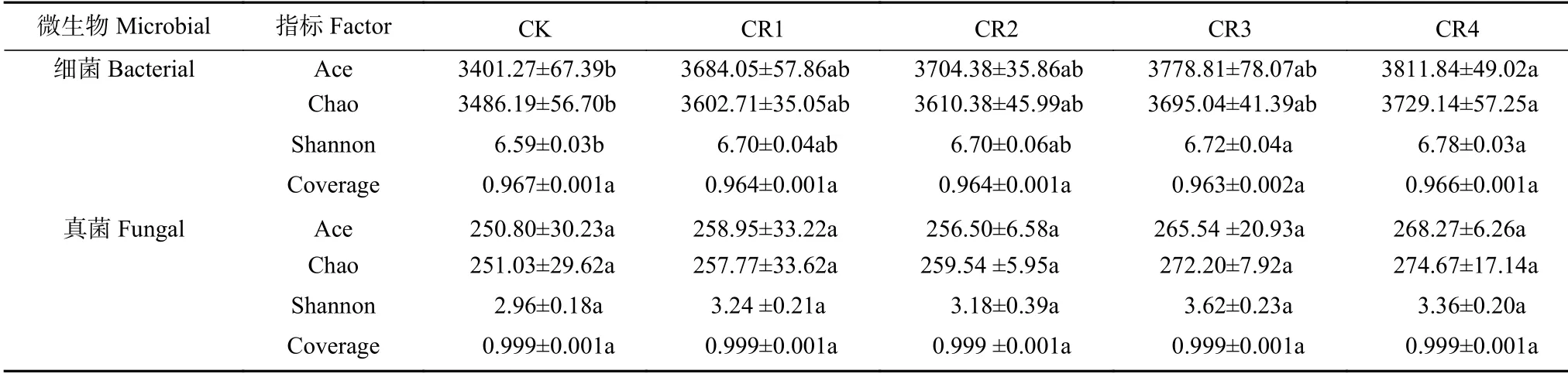
表3 不同处理土壤细菌和真菌OTU 及多样性指数Table 3 Soil microbial diversity indexes of soil bacteria and funge under different treatments
2.5 土壤微生物群落结构分析
微生物统计分析时对丰度20 以下及在该水平上没有注释结果的细菌或真菌归于Orther。试验土壤样品中细菌OTU 隶属于41 门109 纲280 目479 科915 属(图2A)。在门水平上,土壤优势细菌均为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi),总相对丰度达74.39%以上,且不同处理差异明显(图2A)。
变形菌门相对丰度为26.96%~34.10%,呈现出随残膜添加量增加逐渐增加趋势,与CK相比,CR4 处理其相对丰度显著增加(<0.05)。放线菌门相对丰度为15.01%~20.97%,聚氨酯残膜处理增加了其相对丰度,但不同处理间差异不明显。绿弯菌门相对丰度在14.53%~18.32%,不同处理间差异不明显。酸杆菌门相对丰度为10.67%~17.60%,呈现出CR4<CR3<CR2<CR1<CK,且CK 显著高于CR4 处理(<0.05)。芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、己科河菌门(Rokubacteria)、Patescibacteria、硝化螺旋菌门(Nitrospirae)和疣微菌门(Verrucomicrobia),也是主要的细菌类群。除了拟杆菌门在CK 处理(1.48%)中的相对丰度显著低于CR4 处理(4.14%) (<0.05),异常球菌-栖热菌门(Deinococcus-Thermus)在CK (1.84%)处理中丰度显著高于CR2 处理(0.49%) (<0.05)外,其他细菌类群门间无显著差异。
土壤真菌OTU 隶属于13 门36 纲68 目141 科236 属,其中担子菌门(Basidiomycota)、子囊菌门(Ascomycota)是优势门,两者相对丰度占89.60%以上。担子菌门相对丰度为73.98%~80.04%,不同处理间差异不明显;子囊菌门相对丰度为10.20%~18.15%,CR3 处理显著高于CK 处理(<0.05) (图2B)。被孢霉 门(Mortierellomycota,2.33%~3.98%)、球囊菌门(Glomeromycota,0.14%~1.78%)也是主要的真菌类群,其中CK 处理球囊菌门相对丰度显著高于CR4处理(<0.05) (图2B)。
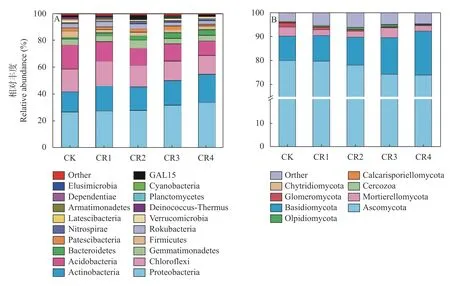
图2 不同处理土壤细菌(A)和真菌(B)群落门水平组成变化Fig.2 Characteristics of bacterial (A) and fungal (B) community structures at phylum level under different treatments
不同处理细菌属水平的变化如图3A 所示。优势菌属主要包括鞘脂单胞菌属(,1.39%~3.56%)、芽胞杆菌属(,1.78%~2.97%)、金霉素链霉菌属(,0.98%~1.89%)、根瘤菌属(,1.03%~1.75%)、(0.58%~0.89%)、壤霉菌属(,0.68%~0.98%)、黄杆菌属(,0.33%~0.84%)、硝化螺旋菌属(,0.32%~0.87%)、假单胞菌属(,0.21%~0.77%)、伯克氏菌属(,0.20%~0.62%)等。这些细菌属在不同处理中均有分布,但相对丰度有一定差异。聚氨酯残膜添加逐渐增加了伯克氏菌属丰度,降低了鞘脂单胞菌属丰度,与CK 相比,CR4 处理差异达显著水平(<0.05)。
不同处理真菌属水平的变化如图3B 所示。优势属是(16.41%~24.8%)、青霉属(,4.18%~9.35%)、链孢霉属(,2.12%~4.18%)、枝孢菌属(,4.33%~6.31%)、镰刀菌属(,2.90%~6.73%)、被孢霉属(,1.07%~5.56%)、链格孢属(,2.15%~4.38%)等。这些真菌属在不同处理土壤中均有分布,但相对丰度有一定差异。与CK 相比,聚氨酯残膜添加逐渐降低了相对丰度,但差异不显著;与CK 相比,CR4 处理被孢霉属相对丰度显著增加(<0.05)。
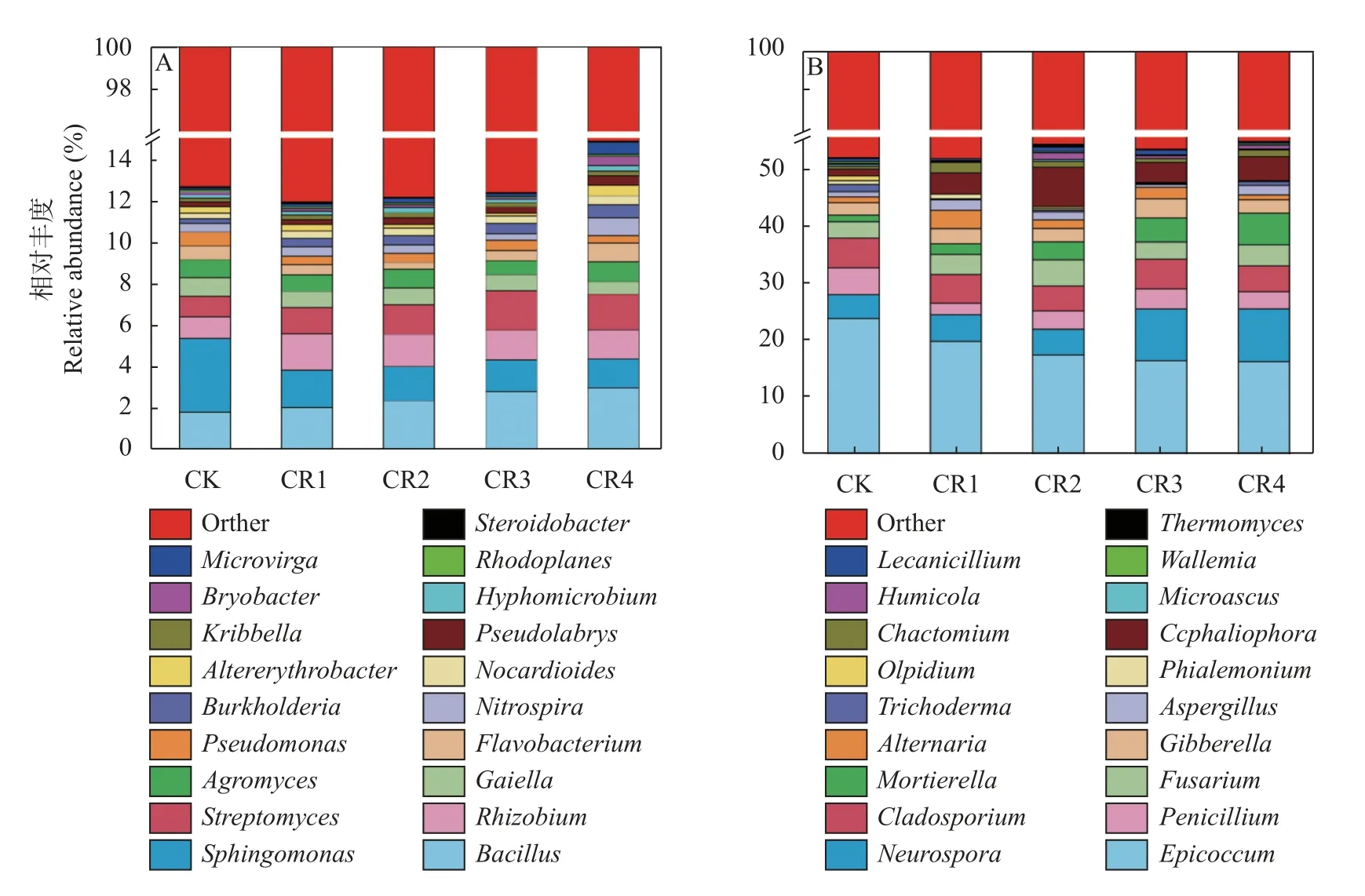
图3 不同处理土壤细菌(A)和真菌(B)群落属水平组成变化Fig.3 Characteristics of bacterial (A) and fungal (B) community structure at genus level under different treatments
为进一步明晰样本间在群落物种组成上的差异性,采用主成分分析(这rincipal component analysis,PCA)分析5 个处理间土壤细菌和真菌群落物种组成的相似度。图4A 所示,PC1 和PC2 分别解释细菌变量方差的40.57%和24.87%,两者累计贡献率达65.44%。这2 个主成分为坐标轴构建的二维坐标系中,各处理在PC 轴上存在差异,说明聚氨酯残膜不同添加量处理中土壤细菌群落的结构特征存在差异。CK 处理与CR2、CR4 处理的土壤细菌群落组成差异较大。图4B 所示,PC1 和PC2 分别解释真菌变量方差的31.39%、24.94%,两者累计贡献率达56.33%。CK 处理与CR4 处理的土壤真菌群落组成差异较大。
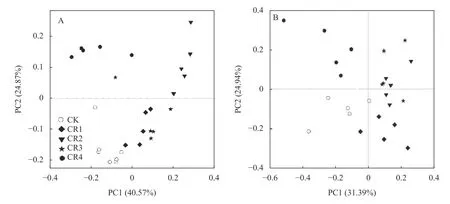
图4 不同处理土壤细菌(A)和真菌(B)群落分析(PCA)Fig.4 Principal coordinate analysis (PCA) analysis of soil bacteria (A) and fungal (B) communities under different treatments
2.6 环境因子与微生物的相关性分析
Mantel 分析微生物群落结构与作物、土壤因子间相互关系(表4)的结果显示,DOC 对细菌群落结构的影响最大(=0.622,=0.003)。同时,AP、SM 和BGB 对细菌群落结构也具有显著影响(<0.05)。真菌群落结构与土壤DOC、TN 和SM 呈现显著相关(<0.05),其中DOC 影响最大(=0.432,=0.008)。进一步对优势微生物门与土壤因子进行相关分析(表5),变形菌门与SM、DOC 和BGB 间呈显著正相关(<0.05 或<0.01);硝化螺旋菌门与SM、DOC、NO-N 和BGB 间呈显著正相关(<0.05 或<0.01);拟杆菌门与DOC、AP 和BGB 间呈显著正相关(<0.05);放线菌门与DOC 和AP 之间呈显著正相关(<0.05 或<0.01);浮霉菌门(Planctomycetes)与AK 间呈显著正相关(<0.05);异常球菌-栖热菌门与TN 间呈显著正相关(<0.05);芽单胞菌门与SM 之间呈显著正相关(<0.05);芽单胞菌门、放线菌门与TN 间呈显著负相关(<0.05);酸杆菌门与SM、DOC 和AGB 间呈显著负相关(<0.05);担子菌门与SM、DOC、TN 和NH-N 间呈显著正相关(<0.05 或<0.01);子囊菌门与SM、DOC 间呈显著正相关(<0.05);Cercozoa 门与SM、TN 间呈显著正相关(<0.05);球囊菌门与SM、AGB 和BGB 间呈显著负相关(<0.05 或<0.01)。

表4 Mantel 检验微生物群落结构与植物、土壤环境因子的相关性Table 4 Mantel test showing the correlation among soil microbial community structure similarity and plant,soil environment factors

表5 优势细菌门、真菌门与土壤因子的相关分析Table 5 Redundancy analysis of dominant bacterial phylum,dominant fungal phylum and environmental factors
3 讨论与结论
3.1 不同聚氨酯残膜添加量下土壤微生物群落多样性的差异
土壤微生物多样性是反映土壤微生物群落结构与生态功能的重要指标。本研究结果表明,短时间内(120 d)土壤细菌OTUs 数量、群落多样性和丰富度指数随聚氨酯残膜添加量增加而增加,尤其是CR4 处理显著增加了细菌群落多样性;而残膜添加仅增加了土壤真菌OTUs 数量,而对其他多样性指标
影响不显著。由此可见,短期内大量聚氨酯残膜添加到土壤,有助于提高土壤细菌群落多样性且对土壤真菌群落多样性影响较小。这与Huang 等利用聚乙烯类和Murugan 等利用聚羟基烷酸酯残膜模拟结果有差异,这可能是不同组分的聚合物残膜由于膜材性质的差异进而对土壤环境影响不同而导致的。
在自然生态系统中细菌和真菌群落多样性差异主要由土壤基本理化性质和养分差异导致。本研究中聚氨酯残膜积累造成土壤环境(含水量、可溶性有机碳、硝态氮含量等)差异,影响到土壤微生物多样性。首先,本研究使用的聚氨酯包膜由聚氰酸酯与生物基多元醇反应形成,其主要组分是碳元素,其残膜在土壤中积累相对增加了碳含量;包膜在制备过程中,使用的生物基多元醇是由蓖麻油、改性纤维素、淀粉、甘油等物质组成,这些物质很容易被微生物降解和利用,残膜添加可为细菌生长和繁殖提供大量的底物,因而促进微生物短期内大量繁殖;同时与CK 相比,聚氨酯残膜添加可能增加了土壤中碳源(如淀粉、甘油等)的种类,因而导致了土壤微生物多样性的改变,这是由于土壤有机组分差异可直接影响土壤微生物群落结构和多样性。其次,残膜作为土壤微生物载体为其提供更多的栖息地和庇护所,对土壤微生物的生长和繁殖起到积极作用。在适宜的温湿环境中,细菌是低分子等较易分解的有机物质的分解者,而真菌侧重于分解木质素、纤维素等土壤中复杂高碳氮有机物,由于聚氨酯残膜添加后增加了淀粉、甘油等低分子有机物质,短期内为细菌提供了充足底物,因而提高了细菌群落多样性,对真菌群落多样性影响不明显。再次,土壤含水量也是影响土壤微生物群落和多样性的重要因素之一。Jiao 等和Zhou等研究均表明随土壤持水量增加,土壤细菌多样性也逐渐提高,在适宜土壤含水量下,细菌多样性最高,而真菌多样性对土壤含水量响应不明显;Charlotte 等研究表明,在土壤含水量较低条件下,利于真菌生长,真菌多样性增加。de Souza Machado 等证实高分子微粒(微塑料)的存在提高土壤持水能力,与本研究结果一致。这可能是由于聚酯树脂中含有大量羟基等强亲水性基团,增强了其吸附水分子能力,因此,聚氨酯残膜添加可提高土壤含水量,进而提高了土壤细菌多样性,不影响真菌多样性。
3.2 不同聚氨酯残膜添加量下土壤微生物群落结构差异
土壤微生物能够敏感地反映土壤生态系统的细微变化及其程度,土壤微生境细微差异导致土壤微生物群落结构变化。本研究中,不同处理土壤优势细菌均为变形菌门、放线菌门和酸杆菌门(图2A),同时,在多种农田生态系统也常检测到变形菌门、酸杆菌门和放线菌作为优势菌存在,且这些细菌群落受土壤含水量、土壤养分、作物等多因子综合影响。不同处理土壤中变形菌占据绝对优势,丰度随聚氨酯残膜添加量增加而增加,CR4 处理中增加明显。这是由于变形菌门属于富营养型物种,在养分含量较高的土壤中占据优势。本研究土壤中相对较高的土壤有机碳和聚氨酯残膜自身带入的有机质保证了该菌生长和繁殖;前人研究表明较低的土壤含水量限制了土壤养分的矿化作用同时影响变形菌相对丰度,CK 处理土壤含水量较CR4 低,因此导致其变形菌门相对丰度低于CR4 处理。酸杆菌门相对丰度表现出相反趋势,由于酸杆菌是寡营养型细菌,适宜低有机质和含水量的土壤环境,CK处理土壤低含水量和无外源有机质添加,适合酸杆菌生活,导致其酸杆菌相对丰度显著高于CR4 处理。
本研究中放线菌门、厚壁菌门、硝化螺旋菌门和拟杆菌门也是主要的细菌类群,这与Wang 等在农田系统中得出的结果一致。放线菌和拟杆菌门广泛分布在干旱与半干旱区生态系统中,偏好营养丰富的土壤环境,且它们在碳氢化合物降解过程中发挥重要作用,聚氨酯作为一种碳氢化合物加入土壤,相当于增加了外源碳氢化合物,可以解释本研究中放线菌门和拟酸杆菌门相对丰度随聚氨酯残膜添加量增加而增加的现象。芽胞杆菌属、鞘脂单胞菌属、金霉素链霉菌、根瘤菌属是土壤细菌优势属,这与Pan 等关于残膜积累和Fei 等关于微塑料对土壤细菌群落组成影响的研究结果基本一致。聚氨酯残膜添加和分解短期内导致伯克霍尔德菌和芽胞杆菌属相对丰度增加,说明残膜添加和分解刺激了与固氮相关的细菌的表达,降低了鞘脂单胞菌属相对丰度,这与Fei 等的研究结果一致。
本研究中土壤真菌优势菌群均为担子菌门和子囊菌门,不同处理间其相对丰度存在一定差异(图2B),这与低密度聚乙烯(LDPE)和聚丙烯(PP)微塑料短期添加、LDPE 微塑料添加对土壤真菌群落结构影响结论相似。担子菌和子囊菌是土壤中的重要分解者,其中子囊菌门多为腐生菌,对有机质和纤维素分解起着关键作用。相对于CK 而言,聚氨酯残膜添加相当于增加了土壤有机物,可促进其分解微生物菌群的增加,这可解释CR3 和CR4 处理子囊菌门的相对丰度高于CK 处理。在属分类水平上,属、青霉属、枝孢菌属、镰刀菌属、链孢霉属、被孢霉属相对丰度较高,这些类群真菌属在不同处理土壤中均有分布,但相对丰度有一定差异,残膜添加增加了被孢霉属丰度,这与Gao 等的研究结果一致。这可能是由于聚氨酯残膜添加后导致土壤有机质组分存在差异,使真菌类群间的碳源分配不同,导致真菌群落差异。由此,聚氨酯残膜的添加与分解改变了土壤微生物的微环境和食物类型,从而影响了微生物群落结构和组成,同时,微生物群落间的相对丰度也发生变化。
3.3 土壤环境因子变化对土壤微生物的影响
前人研究表明土壤质地、pH、含水量、有机质含量等因素均可通过单因子或多因子综合作用影响着土壤微生物群落组成。PCA 分析显示不同聚氨酯残膜添加处理间土壤微生物群落结构存在差异(图4),其主要的驱动因子是土壤DOC、含水量、总氮、速效磷含量和玉米根生物量(表4),这与前人报道一致。DOC 是土壤微生物能量和养分的来源之一,可直接影响土壤微生物,而土壤含水量则通过影响养分循环和植物生长间接改变微生物代谢活性,进而间接地影响土壤微生物群落组成。本研究中聚氨酯残膜添加和分解过程中增加了土壤含水量、DOC 含量及玉米根生物量,为微生物生长创造了有利条件,进而影响土壤微生物群落结构;此外,随填埋时间增加聚氨酯残膜发生不同程度的降解,从而改变其碳氢化合物的结构和化学性质,继而影响土壤的微生物群落。与CK 相比,CR4 处理,由于残膜添加量较大对土壤理化性质及玉米根生物量的影响更明显,因而土壤微生物群落结构差异更大。
综上所述,聚氨酯类控释肥残膜短期内积累与降解对土壤理化性质与微生物群落组成和多样性产生积极影响。而控释肥残膜在土壤中的降解是一个长期过程,尤其是聚氨酯降解过程中残膜结构、降解产物以及对土壤生态环境的影响还需要系统深入研究,以期全面了解和系统评价控释肥残膜的生态环境效应。
3.4 结论
1)聚氨酯残膜添加后,短期内对土壤微生物群落多样性产生积极影响,显著提高土壤细菌群落多样性和真菌OTUs 数量。
2)土壤优势细菌门为变形菌门、酸杆菌门和放线菌门,优势属为芽胞杆菌属、鞘氨醇单胞菌属、金霉素链霉菌属。其中变形菌门、拟杆菌门和伯克氏菌属相对丰度随残膜积累而增加,而酸杆菌门和鞘氨醇单胞菌属相对丰度呈相反趋势。土壤优势真菌门为担子菌门和子囊菌门,优势属为、青霉属、枝孢菌属,其中残膜添加提高了子囊菌门和被孢霉属相对丰度,降低了球囊菌门相对丰度。
3)聚氨酯残膜添加通过影响土壤可溶性有机碳、全氮、速效磷、含水量及玉米地下生物量而影响了土壤微生物群落组成。
