溶解氧水平对青海湖裸鲤体肾组织结构及抗氧化酶活性的影响
2022-06-09陈付菊赵宇田付生云李雪源
陈付菊 赵宇田 付生云 李雪源
(1. 青海大学农牧学院, 西宁 810016; 2. 青海省裸鲤救助中心, 西宁 810003)
水体中溶解氧(Dissolved oxygen, DO)作为影响鱼类生命活动的重要指标, 与鱼类的生长[1]、生殖[2]和能量代谢[3]等生命活动密切相关。然而水体环境中的DO水平常随地理位置、季节、水流状态和水体环境等变化而呈现出一定的波动性(4.0—7.4 mg/L)[4]。当水体中DO含量低于2.0 mg/L时, 鱼会因低氧或缺氧表现出浮头现象, 当DO含量低于1.0 mg/L时, 鱼会出现严重浮头甚至因缺氧而致死[5]。缺氧会影响鱼类生理机能和器官形态结构[6], 而缺氧对其生理状态和器官形态结构的影响与其体内活性氧自由基(Reactive oxygen species, ROS)的累积密切相关。
线粒体被认为是氧浓度感受器, 也是产生ROS的重要细胞器[7]。当机体面临急性或严峻缺氧时,细胞线粒体发生损伤, 线粒体蛋白质合成受阻, 数目减少, 嵴消失, 氧化力下降, 进而使线粒体产生过量的ROS[8], 过多的ROS会攻击生物膜、蛋白质和核酸, 导致DNA、蛋白质和脂质的氧化损伤, 引发生物体生理机能改变、组织损伤及代谢紊乱等[9—11]。然而, 细胞内存在ROS清除系统如超氧化物歧化酶(Superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GPX)和过氧化氢酶(Catalase, CAT)等能够清除过量ROS使细胞内ROS的产生与清除处于动态平衡状态[12]。研究表明, 在低氧环境下, 线粒体通过ROS信号间接激活低氧诱导因子(HIF)而介导机体对低氧的适应[13]。因此, 以线粒体ROS为切入点研究细胞低氧响应对揭示高原土著动物低氧适应机制具有重要意义。
青海湖裸鲤(Gymnocypris przewalskii)作为青海湖中唯一的经济鱼类, 在青海湖整个生态系统中居于核心地位。自20世纪60年代初至90年代末, 由于自然环境的破坏和人为过度的捕捞, 导致青海湖裸鲤资源急剧下降。自21世纪开始, 青海省通过封湖育渔、增殖放流和修设洄游通道等资源保护措施使其数量恢复至8800万千克, 但与原始蕴藏量的32万吨仍有较大差距。2009年, 青海湖裸鲤在《中国物种红色名录》脊椎动物篇中被列为国家二级保护濒危物种, 2010年被列为世界濒危物种之一[14]。因此, 保护青海湖裸鲤资源具有非常重要的意义。
青海湖裸鲤长期生活在高海拔(3200 m)的低氧(溶解氧约6 mg/L)环境中, 对于环境溶解氧的波动表现出较强的耐受能力[15], 是研究低氧耐受机制的理想动物模型。然而, 截至目前对青海湖裸鲤的研究主要集中在盐度适应特性[16—18]、繁殖特性[19]和肠道菌群[20,21]等方面, 而对其低氧耐受的研究较少见, 仅见低氧胁迫对青海湖裸鲤鳃组织结构的影响[15]。
肾作为鱼类的主要排泄器官, 在清除鱼类体内有害代谢产物过程中发挥重要的作用[22]。黄建盛等[23]和区又君等[24]发现, 急性低氧胁迫会造成军曹鱼(Rachycentron canadum)和卵形鲳鲹(Trachinotus ovatus)肾损伤, 提示肾对低氧敏感。因此, 本研究以青海湖裸鲤体肾为研究对象, 通过研究青海湖裸鲤在低氧胁迫下体肾线粒体超微结构及相关抗氧化酶活性的变化规律, 以期探讨青海湖裸鲤低氧的适应能力, 为青海湖裸鲤的资源保护提供参考依据。
1 材料与方法
1.1 试验材料
性成熟的青海湖裸鲤取自青海湖黑马河, 体长(24.11±0.12) cm, 体重(97.68±0.12) g。正式实验前在室内暂养1周, 暂养水温(14.5±0.7)℃, 水体DO维持在(8.4±0.1) mg/L(自然水体中的DO值), 即本实验中为常氧, 正式实验前1天停止进食。丙二醛(MDA)测定试剂盒(A003-1)、过氧化氢(H2O2)测定试剂盒(A064-1)、超氧化物歧化酶(SOD)测定试剂盒(A001-3)、谷胱甘肽过氧化物(GPX)测定试剂盒(A005-1)和总蛋白测定试剂盒(A045-2)均购自南京建成生物工程研究所; 组织线粒体分离试剂盒(C3606)、JC-1线粒体膜电位检测试剂盒(C2006)、Bradford蛋白浓度试剂盒(P0006C)均购自中国碧云天生物公司; 詹纳斯绿B(J8020)购自北京索莱宝科技有限公司; 氯仿、无水乙醇等均购自天津市富宇精细化工有限公司。
1.2 试验设计
青海湖裸鲤中度和重度低氧胁迫均采用自制水族箱顶部覆盖塑料膜, 水体充氮除氧方法而获得。维持低氧期间, 利用AZ8402溶解氧测定仪定期监控水体溶解氧浓度, 参见文献[25]。
实验鱼分成3组, 重度低氧组、中度低氧组和常氧组, 每组设置3个平行, 每组20尾。重度低氧组在1h内将DO从(8.4±0.1)降至(0.7±0.1) mg/L, 并维持24h; 中度低氧组在1h内将DO从(8.4±0.1)降至(3.0±0.1) mg/L, 并维持24h; 常氧组用氧泵将水体DO维持在(8.4±0.1) mg/L。在低氧胁迫结束后, 分别在中度低氧24h及重度低氧8h和24h时, 将鱼用适量MS-222溶液麻醉, 迅速解剖后取体肾(1对), 用生理盐水冲洗, 取左侧体肾并提取线粒体用于膜电位的检测(8尾/组); 取右侧前1/3体肾, 4%多聚甲醛缓冲液(pH=7.4)固定用于组织结构的观察(4尾/组); 取右侧后1/3体肾, 2.5%戊二醛固定用于线粒体超微结构的观察(4尾/组); 取左侧和右侧结合处体肾, 储存于液氮用于抗氧化酶活性的检测(8尾/组)。
1.3 试验方法
体肾组织显微结构的观察用4%多聚甲醛固定后的体肾组织, 经50%、75%、85%、95%和100%的梯度酒精逐级脱水后, 二甲苯透明, 石蜡包埋, 用切片机(Leica RM 2135)切6 μm厚连续切片, 脱蜡以及梯度乙醇脱水, 苏木精-伊红(HE)染色, 自来水返蓝、 脱水、 透明、 封片, 光学显微镜下观察。
线粒体超微结构的观察用2.5%戊二醛固定的体肾组织, 用0.1 mol/L磷酸缓冲液(pH=7.4)洗涤3次, 每次5min。1%四氧化锇固定1h, 梯度酒精脱水, 环氧树脂包埋, 定位、超薄切片, 经醋酸铀及柠檬酸铅双重染色, 透射电镜下观察、拍照, 并统计杆状线粒体比例(杆状线粒体数/圆形线粒体数×100%)。
体肾抗氧化酶活性的测定将液氮保存的肾脏组织冰上解冻, 称量, 按重量体积比1∶9 (g/mL)向样品中加入生理盐水, 并振荡混匀后4℃离心10min(2500 r/min), 取上清液, 保存于-80℃冰箱暂存, 用于检测抗氧化指标和蛋白浓度。
体肾线粒体的分离和线粒体膜电位的检测按试剂盒说明进行线粒体分离, 取新鲜体肾组织(90 mg), 于预冷离心管(1.5 mL)内用剪刀剪碎后, 加入900 μL预冷的线粒体分离试剂A, 冰浴匀浆10次左右, 4℃离心5min(600 r/min), 将上清转移到另一离心管中, 4℃离心(11000 r/min) 10min, 小心去除上清, 获得沉淀物即线粒体, 用线粒体储存液制备线粒体悬液并用Bradford蛋白浓度试剂盒检测蛋白浓度和詹纳斯绿B检测线粒体活性。以上步骤均在冰上进行, 且不超过1h。
根据线粒体膜电位检测试剂盒说明书进行线粒体膜电位的检测, 在配置好的JC-1染色工作液中加入纯化的线粒体, 用荧光酶标仪检测线粒体膜电位的变化, 并计算相对荧光强度。相对荧光强度=绿色荧光强度/红色荧光强度。检测JC-1单体时, 激发光波长490 nm, 发射光波长530 nm; 检测JC-1聚合物时, 激发光波长525 nm, 发射光波长590 nm。
1.4 统计分析
结果均采用平均值±标准误(mean±SEM)表示,采用SPSS 17.0软件对实验数据进行单因素方差分析, 不同时间点的数据进行Duncan检验进行多重比较, 以P<0.05表示差异显著。
2 结果
2.1 溶解氧水平对青海湖裸鲤体肾显微结构的影响
在光学显微镜下青海湖裸鲤体肾由肾小球、第一近曲小管、第二近曲小管、集合管和远曲小管组成。常氧组体肾显微结构正常, 肾小球和肾小管结构完整。第一近曲小管上皮细胞呈单层柱状,管腔小而不规则, 第二近曲小管上皮细胞呈单层柱状, 管腔呈圆形, 集合管上皮细胞呈单层立方形, 管腔不规则, 远曲小管上皮细胞呈单层立方上皮, 管腔呈圆形, 管径相对较大, 血管内含有红细胞(图 1A)。重度低氧8h(图 1B)和24h(图 1C)及中度低氧24h(图 1D)胁迫对肾小球、近曲小管、远曲小管及集合管结构均没有影响。
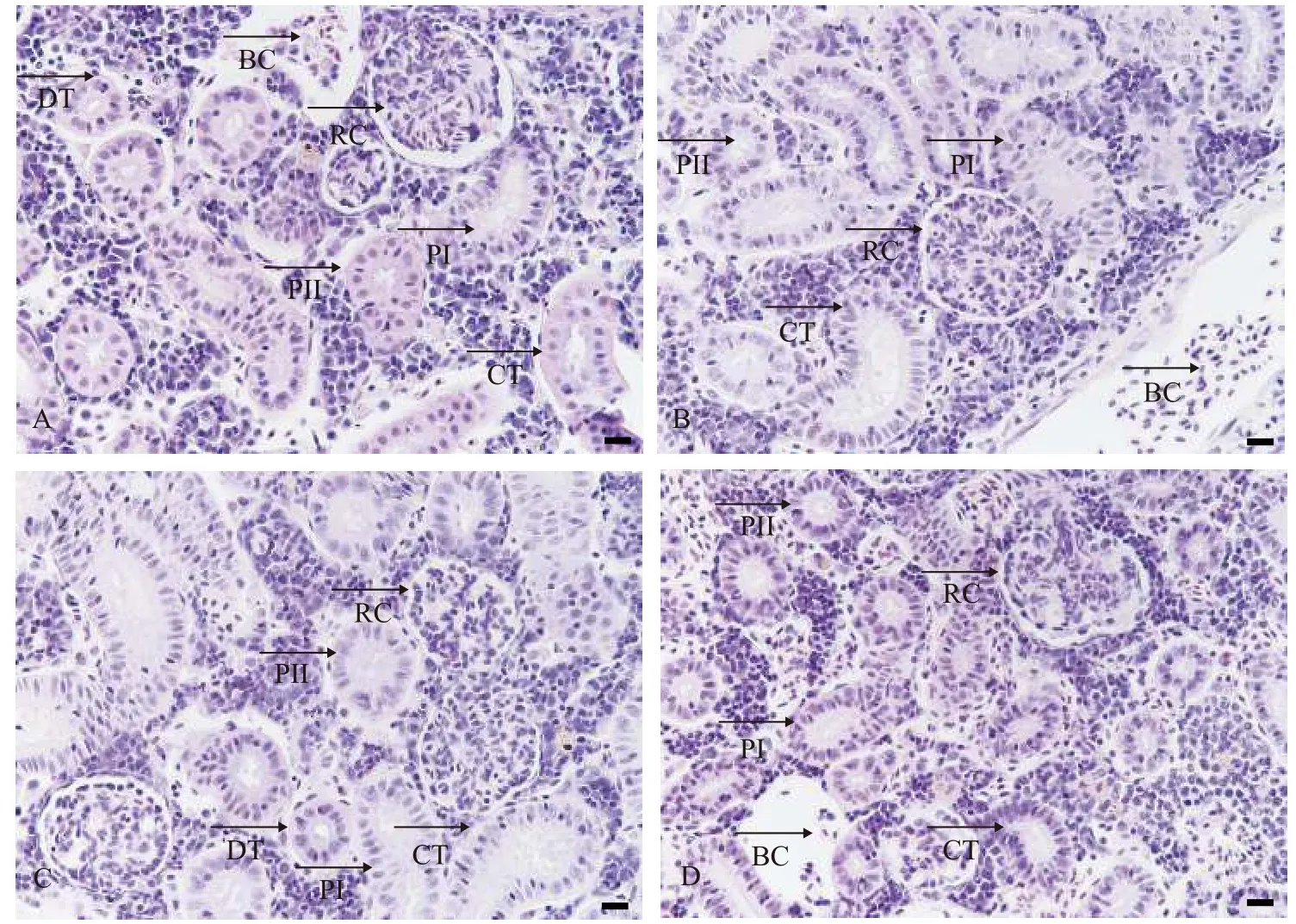
图1 溶解氧水平对青海湖裸鲤体肾显微结构的影响Fig. 1 Effects of dissolve oxygen level on the body kidney microstructure of Gymnocypris przewalskii
2.2 溶解氧水平对青海湖裸鲤体肾线粒体超微结构的影响
透射电镜观察发现青海湖裸鲤常氧组体肾肾小管上皮细胞线粒体多呈圆形和椭圆形, 偶见有杆状线粒体, 内有嵴, 线粒体膜完整(图 2A); 重度低氧胁迫8h时线粒体多呈圆形和椭圆形, 偶见有细长的杆状线粒体, 线粒体膜完整(图 2B); 重度低氧胁迫24h时线粒体多呈杆状和椭圆形, 线粒体膜和嵴完整(图 2C); 中度低氧胁迫24h时线粒体多呈长杆状,线粒体膜完整(图 2D)。
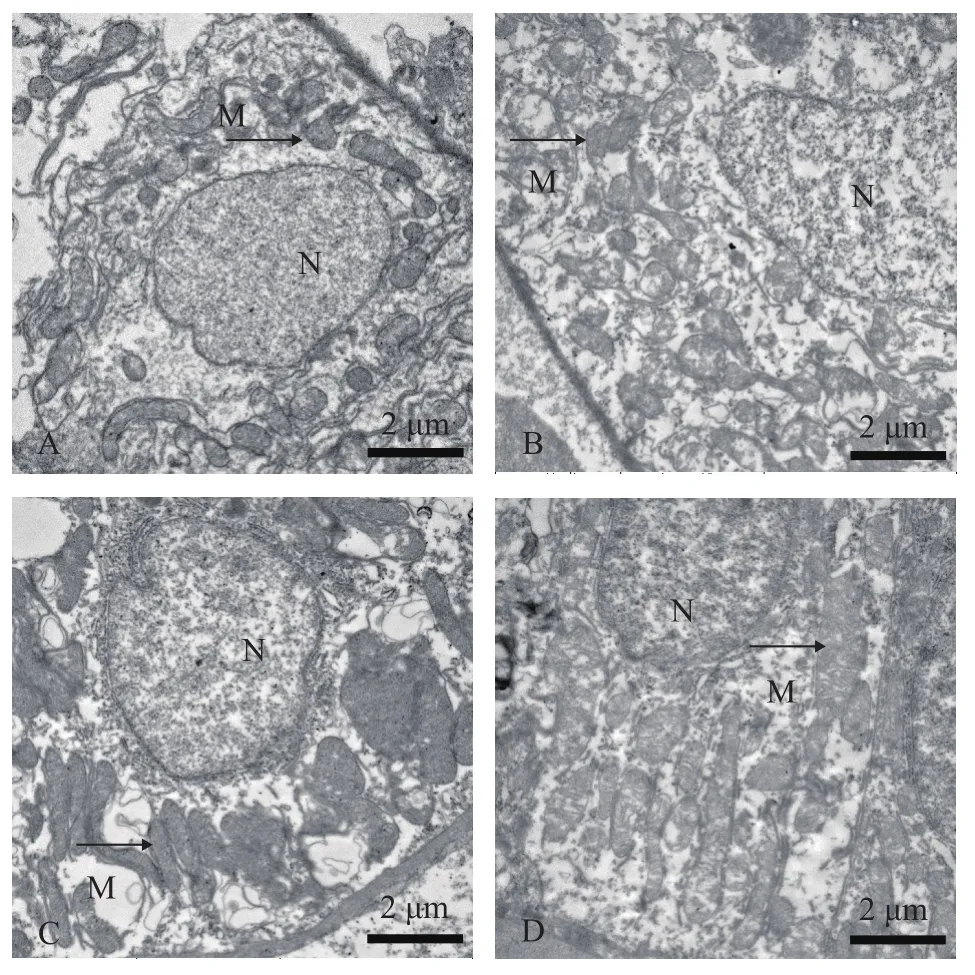
图2 溶解氧水平对青海湖裸鲤体肾线粒体超微结构的影响Fig. 2 Effects of dissolve oxygen level on the body kidney mitochondrial ultrastructure of Gymnocypris przewalskii
通过统计杆状线粒体比例后发现, 重度低氧胁迫8h时体肾杆状线粒体比例与常氧组差异不显著(P>0.05); 中度和重度低氧胁迫24h时体肾杆状线粒体比例显著增加(P<0.05; 图 3)。
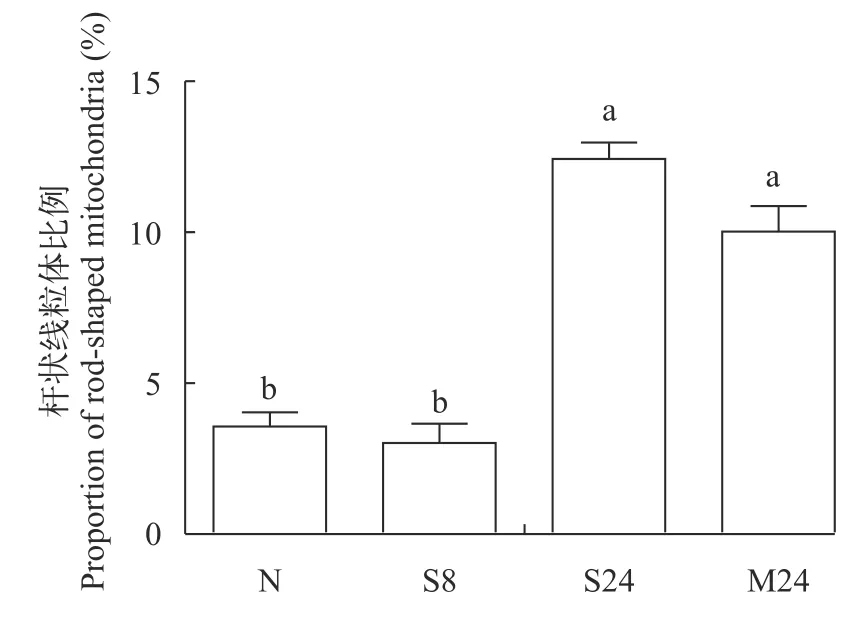
图3 溶解氧水平对青海湖裸鲤体肾杆状线粒体比例的影响Fig. 3 Effects of dissolve oxygen level on proportion of rodshaped mitochondria in the body kidney of Gymnocypris przewalskii
2.3 溶解氧水平对青海湖裸鲤体肾线粒体膜电位的影响
由图 4可见, 体肾线粒体绿色荧光与红色荧光强度比值在重度低氧胁迫8h时升至最大(P<0.05),24h时降低(P<0.05), 但重度低氧8h和24h时其比值均高于常氧组(P<0.05); 中度低氧24h时体肾线粒体绿色荧光与红色荧光强度比值显著高于常氧组(P<0.05), 但与重度低氧24h时差异不显著(P>0.05)。这表明重度低氧胁迫使体肾线粒体膜电位呈先降低后增加的变化趋势, 中度低氧使体肾线粒体膜电位降低。
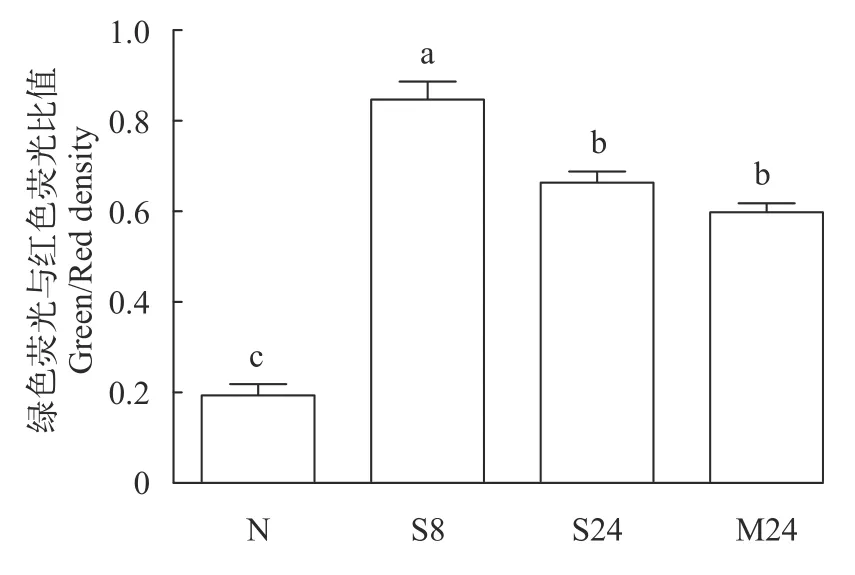
图4 溶解氧水平对青海湖裸鲤体肾线粒体膜电位的影响Fig. 4 Effects of dissolve oxygen level on the body kidney mitochondrial membrane potential of Gymnocypris przewalskii
2.4 溶解氧水平对青海湖裸鲤体肾抗氧化酶活性的影响
由图 5可知, 体肾H2O2含量在重度低氧胁迫8h时最大(P<0.05), 24h时降低(P>0.05), 且重度低氧24h时其含量与常氧组间差异不显著(P>0.05); 中度低氧胁迫24h时H2O2含量升高, 但与常氧组间差异不显著(P>0.05; 图 5A)。体肾MDA含量在重度低氧胁迫8h时最大(P<0.05), 24h时降低(P>0.05), 且重度低氧8h和24h时其含量均高于常氧组(P<0.05); 中度低氧胁迫24h时MDA含量显著高于常氧组(P<0.05), 但与重度低氧8h和24h时差异不显著(P>0.05; 图 5B)。
体肾SOD活性在重度低氧胁迫8h时最大(P<0.05),24h时降低(P>0.05), 且重度低氧8h和24h时其活性均高于常氧组(P<0.05); 中度低氧胁迫24h时SOD活性与常氧组间差异不显著(P>0.05; 图 5C)。体肾TAOC在重度低氧胁迫后持续增加, 且均高于常氧组(P<0.05), 但重度低氧8h和24h间T-AOC差异不显著(P>0.05); 中度低氧胁迫24h时T-AOC显著高于常氧组(P<0.05; 图 5D)。体肾GPX活性在重度低氧8h时最大, 24h时稍降低, 但重度低氧8h和24h时其活性均高于常氧组(P<0.05); 中度低氧胁迫24h时GPX显著高于常氧组(P<0.05), 但与重度低氧8h和24h间其活性差异不显著(P>0.05; 图 5E)。

图5 溶解氧水平对青海湖裸鲤体肾H2O2 (A)、MDA (B)、SOD (C)、T-AOC (D)和GPX (E)活力的影响Fig. 5 Effects of dissolve oxygen level on H2O2 (A), MDA (B), SOD (C), T-AOC (D) and GPX (E) activities in the body kidney of Gymnocypris przewalskii
3 讨论
3.1 溶解氧水平对青海湖裸鲤体肾显微结构的影响
鱼类的窒息点可以反映鱼类对DO的最低需求量。刘济源等[16]研究显示, 4龄性成熟青海湖裸鲤的窒息点为0.14—0.17 mg/L, 除鲫(Carassius auratus)的窒息点(0.11—0.13 mg/L)外, 其他鲤科鱼类的窒息点均大于青海湖裸鲤。Matey等[15]研究显示, 青海湖裸鲤在急性低氧(0.3±0.1 mg/L)可存活24h, 说明青海湖裸鲤具有很强的低氧耐受能力。本研究发现, 青海湖裸鲤在低氧(0.3±0.1 mg/L)胁迫8h后其死亡率高达40%, 但在低氧(0.7±0.1 mg/L)胁迫8h后其死亡率降至15%以下, 低氧(3.0 mg/L)胁迫可存活数天。故本研究采用0.7 mg/L为重度低氧胁迫浓度, 3.0 mg/L为中度低氧胁迫浓度。
体肾作为鱼类的主要排泄器官, 在清除鱼类体内有害代谢产物过程中发挥重要的作用[22]。黄建盛等[23]和区又君等[24]发现, 急性低氧胁迫会造成军曹鱼(Rachycentron canadum)和卵形鲳鲹(Trachinotus ovatus)肾损伤, 使其机能紊乱。邵川等[26]研究显示,慢性间歇性低氧可导致大鼠肾脏组织细胞水肿变性和超微结构异常。戴玉等[27]研究显示, 急性低压缺氧导致大鼠肾脏功能和结构造成损伤, 表明肾脏也是一个对缺氧十分敏感的器官, 很容易受到缺氧性损伤。组织和器官的结构变化被认为是病理损伤的最初表现, 也是快速检测生物机体应激反应的方法之一[28]。在本研究中, 重度(0.7±0.1) mg/L和中度(3.0±0.1) mg/L低氧胁迫对青海湖裸鲤体肾组织结构没有影响, 表明重度和中度低氧并未造成体肾组织结构的损伤。目前无低氧胁迫后鱼类体肾组织结构变化的参考对比文献, 本实验室前期研究结果显示, 重度低氧使肝细胞出现空泡化, 且随低氧胁迫时间延长肝细胞空泡变性更严重, 且部分线粒体出现空泡化。作者认为, 青海湖裸鲤长期生活在高海拔的低氧环境中, 经过长期的自然适应, 对高原低氧水环境具有较强的耐受潜力, 但不同组织对低氧的耐受性及响应时间可能不同。
3.2 溶解氧水平对青海湖裸鲤体肾线粒体超微结构和膜电位的影响
线粒体是细胞利用氧并合成ATP的主要场所,对缺氧最敏感。缺氧可导致组织、细胞发生一系列结构改变。研究显示, 缺氧情况下最敏感的是线粒体和内质网[29]。在本研究中, 重度和中度低氧胁迫对青海湖裸鲤体肾肾小管上皮细胞线粒体超微结构没有影响, 但低氧胁迫后线粒体形态以杆状居多, 其原因不明。陈世喜等[30]认为, 在低氧胁迫后,水体环境中的低DO水平将导致有氧呼吸水平下降,为提供足够能量, 线粒体功能应该增强。本研究中,低氧胁迫后杆状线粒体的增多是否与增加其呼吸功能有关则有待进一步研究探讨。
线粒体氧的生成和利用首先通过线粒体呼吸链复合体形成跨内膜两侧的膜电位, 后者通过复合体Ⅴ转化为ATP。因而线粒体膜电位是衡量线粒体健康水平的重要标准[31]。在急性肾损伤时, 肾脏组织由于供氧不足, 从而使线粒体ROS清除能力显著下降, 导致细胞和线粒体发生氧化应激[32], 过量的ROS沉积可导致线粒体膜电位的丧失[33]。本研究中, 重度低氧胁迫8h时青海湖裸鲤体肾线粒体膜电位急剧降低, 24h时膜电位又升高。本试验结果表明, 低氧胁迫下, 青海湖裸鲤体肾线粒体膜电位应激性下降, 但随着低氧胁迫时间的延长, 体肾线粒体膜电位逐渐升高, 可能与增加其呼吸功能有关。低氧胁迫后体肾线粒体膜电位的急剧降低可能与低氧应激导致的体肾ROS增加有关。
3.3 溶解氧水平对青海湖裸鲤体肾组织氧化应激水平的影响
机体受到低氧胁迫后线粒体内ROS产生迅速增加, 而未被及时清除的过量ROS容易导致机体氧化应激损伤, 故线粒体内ROS的水平能够反映细胞内的氧化应激水平, 但因ROS寿命短暂, 并且缺乏足够敏感的技术直接检测生物体内的ROS, 通常通过检测体内H2O2含量来间接反映细胞发生脂质过氧化的程度[34]。在本研究中, 体肾H2O2含量在重度低氧胁迫8h时显著增加, 24h时降至正常水平, 表明水环境中DO骤然降低后对青海湖裸鲤产生胁迫,从而导致ROS大量产生, 裸鲤可通过自身调节能在24h内使体肾ROS恢复到原来的水平。研究表明, 在低氧环境下, 线粒体通过ROS信号间接激活低氧诱导因子(HIF)而介导机体对低氧的适应[13], 低氧胁迫后青海湖裸鲤ROS信号通路有待进一步研究。
MDA是自由基和多不饱和脂肪酸反应产生的环氧化合物, 可作为氧化的一个指标, 反映机体脂质过氧化程度[35]。在本研究中, 低氧胁迫使体肾组织MDA含量增加, 且随低氧胁迫时间延长MDA含量呈降低趋势。这与陈世喜等[30]对卵形鲳鲹(Trachinotus ovatus)幼鱼肝的研究结果相似。本试验结果表明,在低氧胁迫初期, 青海湖裸鲤体肾内ROS应激性增加, 从而使MDA含量升高, 但随着低氧胁迫时间的延长, 体内抗氧化酶持续清除ROS, 进而使MDA含量降低, 从而避免低氧胁迫对体肾组织造成损伤,这与低氧胁迫并未造成青海湖裸鲤体肾组织结构和线粒体超微结构损伤的结果相吻合。
3.4 溶解氧水平对青海湖裸鲤体肾抗氧化能力的影响
过量ROS容易导致机体氧化应激损伤, 但线粒体内存在ROS清除系统能够清除过量的ROS, 从而避免ROS累积造成的机体损伤。SOD、GPX和TAOC是清除体内多余自由基的重要抗氧化酶, 代表和反映机体抗氧化酶系统和非酶系统的代偿能力及机体自由基的代谢状态[36]。在本研究中, 体肾中T-AOC和GPX在低氧胁迫后显著增加, 这与贾秀琪等[37]对河川沙塘鳢(Odontobutis potamophila)肾的研究结果一致。本试验结果表明, 当裸鲤受到低氧胁迫时, 体肾中ROS应激性增高, T-AOC和GPX响应性增高以清除过多的ROS, 从而保护体肾免受ROS损伤。在本研究中, 重度低氧胁迫后体肾中SOD活性呈先增加后降低的趋势, 中度低氧胁迫后SOD活性与常氧组差异不显著。陈世喜等[30]研究发现, 卵形鲳鲹(Trachinotus ovatus)幼鱼肝组织SOD活性在急性低氧胁迫3h时最大, 后逐渐降低,8h和24h时降至正常水平, 这与本研究的变化趋势相似。本试验结果表明, 在低氧胁迫早期, 体肾中ROS含量应激性增高, SOD活性响应性增强以清除过多的ROS, 但随着体肾内ROS含量的降低,SOD活性也随之降低。
综上所述, 中度低氧(3.0±0.1) mg/L和重度低氧(0.7±0.1) mg/L胁迫引起青海湖裸鲤体肾组织发生氧化应激反应, 但并未造成体肾组织结构和线粒体结构的损伤, 低氧胁迫下体肾线粒体形态和抗氧化酶活性发生明显变化, 推测体肾可能通过调整线粒体形态及相关抗氧化酶活性来更好地应对溶氧变化。本研究为探讨青海湖裸鲤裸鲤低氧适应机制提供理论依据。
