池塘圈养密度对大口黑鲈生长性能和健康状况的影响
2022-06-09廖伟坚卢建超何绪刚
张 奇 侯 杰, 杨 军 廖伟坚 卢建超 何绪刚,
(1. 华中农业大学水产学院, 武汉 430070; 2. 长江经济带大宗水生生物产业绿色发展教育部工程研究中心, 武汉 430070;3. 湖北省宜昌市水产技术推广站, 宜昌 443000)
我国是水产养殖第一大国, 其中池塘养殖是最主要的生产方式之一[1]。现在, 池塘养殖普遍采用高密度放养、大量投饲散养方式[2], 池塘营养水平已大大超出池塘自净能力, 面临着养殖水质劣化、病害频发、反复用药且用药量与药残高、养殖效率低下等一系列问题[3]; 同时, 养殖池塘冬季集中干塘、外排尾水, 低温增加了养殖尾水治理难度, 未达标的养殖尾水集中大量排放, 易引起受纳水体富营养化。因此, 传统池塘养殖模式向绿色、健康转型升级已刻不容缓。基于“时时打扫卫生”理念创制的池塘圈养模式(以下简称“圈养模式”), 变池塘散养为圈养, 通过高效收集养殖废弃物并移出池塘、资源化再利用, 实现了清水养殖, 大幅削减养殖废弃物排放量, 提质增效显著, 生态环保优点突出[4,5], 成为当下备受关注的新型绿色高效养殖模式; 圈养技术也被农业农村部列为2019年、2020年重大引领性技术。然而, 作为一种新生模式与技术,需要不断熟化与完善。所以, 有必要系统、深入研究圈养模式与技术。
养殖密度是水产养殖中最重要的技术参数之一, 直接影响到养殖对象的存活、生长、健康及养殖水环境质量, 也是养殖产量和经济效益的关键决定因素[6]。通常, 适度提高养殖密度可降低养殖生产成本、提高经济效益; 但过高养殖密度反而会成为压力源, 引起养殖水环境恶化、养殖对象出现拥挤胁迫或不良群体行为, 从而导致养殖对象生长速度减缓、健康状况变差[7]。因此, 确定适宜养殖密度是养殖系统高效率运行的关键。大口黑鲈(Micropterus salmoides), 俗称加州鲈, 是我国淡水养殖重要品种之一; 其肉质鲜美、无肌间刺、生长速度快、养殖周期短、适应性强, 深受广大消费者和养殖者喜爱[8]。本文以大口黑鲈为圈养对象, 研究了从鱼种(约9.7 g)到商品鱼(约400 g以上)阶段, 3种不同圈养密度对其生长、生理指标以及抗氧化性能等的影响, 以期为大口黑鲈适宜圈养密度的确定、熟化圈养相关技术等提供科学依据。
1 材料与方法
1.1 试验材料与设计
大口黑鲈苗种来自湖北省枝江市一尘水产苗种厂, 健康无病, 规格整齐, 生长良好。试验鱼初始平均体重为(9.71±3.75) g, 初始平均体长为(7.66±0.98) cm。设置低密度组(LSD; 1000尾/圈, 50尾/m3)、中密度组(MSD; 2000尾/圈, 100尾/m3)和高密度组(HSD; 4000尾/圈, 200尾/m3)3个养殖密度组,每个密度组3个重复。养殖试验从2019年5月17日开始至11月16日, 共持续180d。
1.2 圈养设施
试验地点为华中农业大学水产学院校内基地,圈养池塘面积1.75 m×667 m, 平均水深2.0 m, 圈养桶12个(编号1—12#; 图 1), 圈养桶上部圆柱体(直径4.0 m, 高1.9 m)是主要养殖区域, 有效养殖水体20 m3,内设固定式防逃网和活动式捕捞网等; 通过涡轮式风机和纳米微孔管进行增氧; 圈养桶下部锥形结构、尾水管道、自吸泵等构成集排污系统, 养殖废弃物通过桶内涡流和自然沉降至锥底, 通过自吸泵抽排进入固液分离塔, 在重力作用下固液分离, 固废被回收再利用, 上清液通过人工湿地进一步脱氮除磷后, 循环流入圈养池塘。
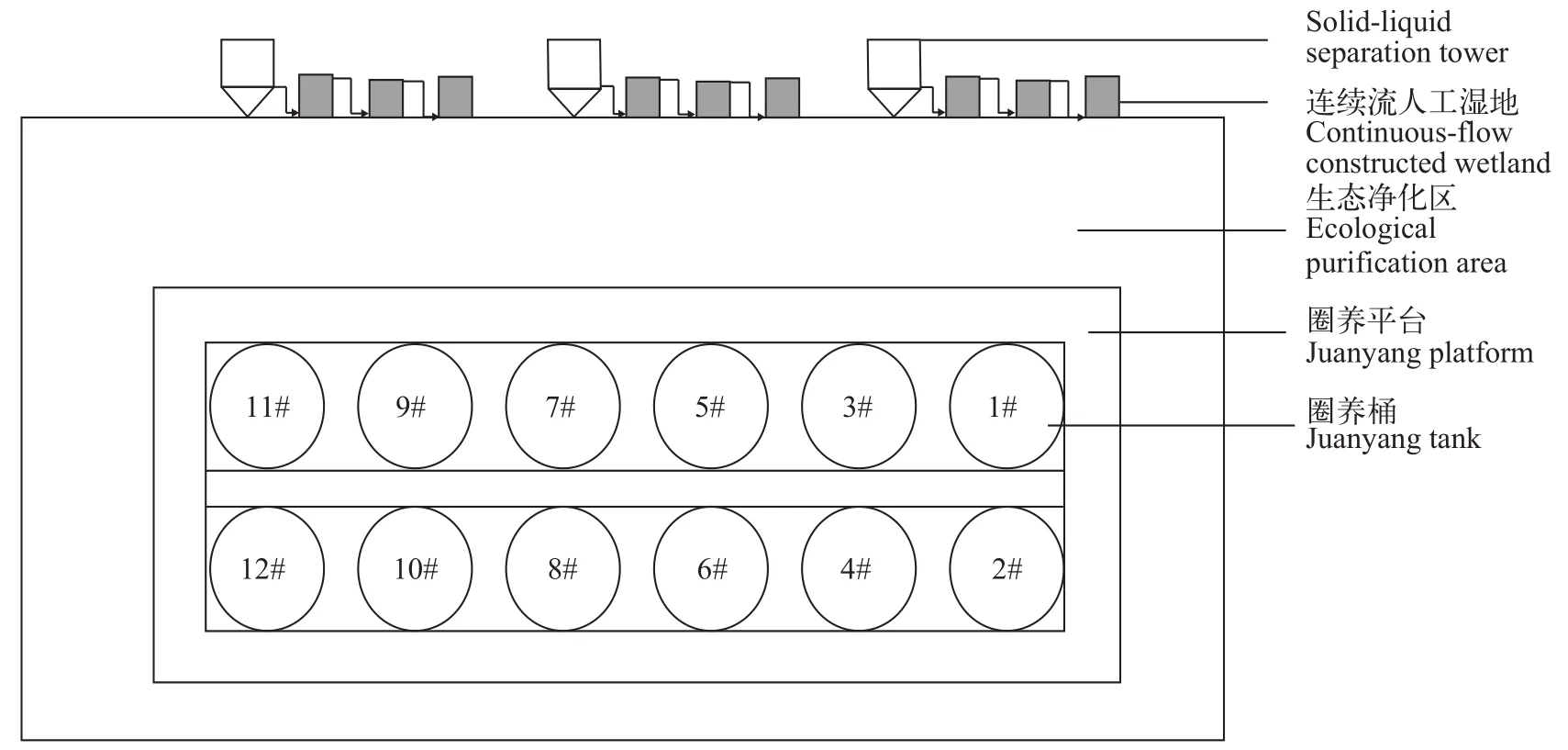
图1 圈养系统布局图Fig. 1 Stable breeding system layout
1.3 饲养管理
试验用饲料为大口黑鲈专用商品饲料(粗蛋白≥48.00%, 粗脂肪≥6.00%, 粗纤维≤4.00%, 粗灰分≤16.00%), 每天进行2—3次投喂, 每天的投喂水平占鱼体总重量的1%—3%, 每天早晚各排污一次,根据池塘水位情况, 池塘因渗漏和蒸发时, 适当补充新水, 不额外换水。每天多次巡塘, 密切观察系统设备运行和鱼体生活状况。定期监测系统水质变化, 在试验期间圈养桶水温为19.00—33.90℃, 溶解氧3.32—6.51 mg/L, 透明度40.0—120.0 cm, pH为6.84—7.97, 氨氮为0.12—5.31 mg/L, 亚硝酸盐为0.05—0.56 mg/L。
1.4 样品采集与分析
每日记录饲料投喂和死亡情况, 每半个月从各试验组随机选取50尾鱼测定体重和体长等生长数据, 测定后回放; 每两个月从各试验组随机选取9尾鱼, 尾部静脉取血, 分离血清。同时将每尾鱼解剖,取肝脏样品用于抗氧化指标测定。
血清生化指标在Chemix800型全自动生化分析仪(日本希森美康公司)上测定, 试剂盒购自中生北控生物技术股份有限公司。肝脏抗氧化指标采用试剂盒法测定, 试剂盒购自南京建成生物科技研究所。
1.5 计算公式
存活率(SR, %)=100×(N0-Nt)N0
特定生长率(SGR, %/d)=100×(lnM2-lnM1)/t
饵料系数(FCR)=FI/(M2-M1)
摄食率(FR, %)=100×FI/[0.5(M2+M1)×t]
式中,Nt为收获尾数;N0为放养尾数,M1(g)为鱼体最初均体重,M2(g)为鱼体最终均质量,t为饲喂天数,FI(g)为尾均摄食量(湿重),Mb(g)和L(cm)分别代表每尾鱼体重和体长。
1.6 数据分析
试验统计数据用平均数±标准差(mean±SD)表示, 方差分析(One way ANOVA)采用SPSS25.0软件完成, 通过Duncan’s多重比较来分析组间显著差异,P<0.05为差异显著。
2 结果
2.1 存活率
在0—30d、90—120d两个阶段各密度组的存活率均较其他养殖阶段低, 且HSD组显著高于LSD、MSD组(P<0.05); 其他阶段各组存活率均在98%以上, 并且各组间差异不显著(P>0.05; 表 1)。
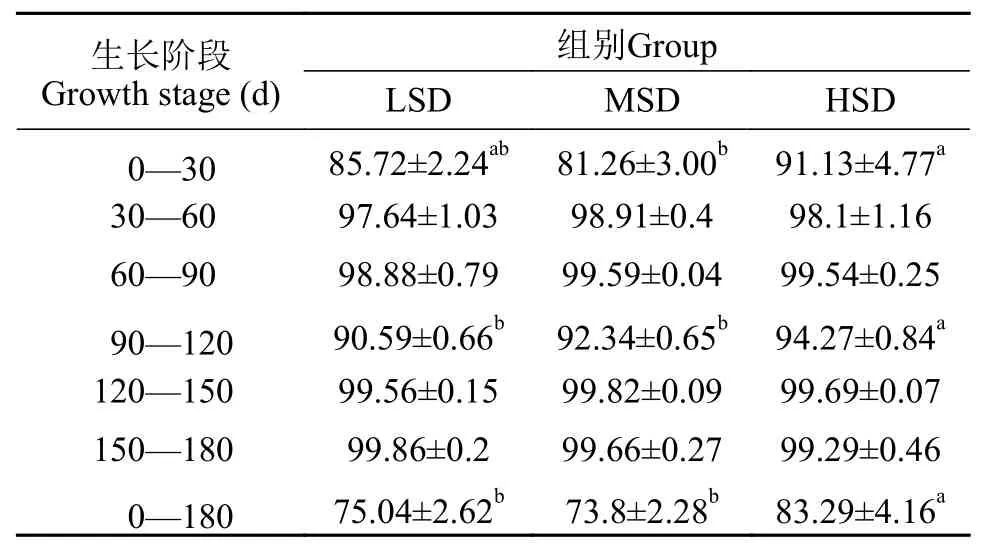
表1 不同密度组大口黑鲈成活率Tab. 1 Survival rates of largemouth bass in different density groups
2.2 生长情况
经180d圈养, 大口黑鲈终末体重、终末体长跟密度密切相关, 表现为随密度升高而显著递减(P<0.05), HSD组最终密度、重量和总存活率显著高于MSD和LSD组(P<0.05; 表 2)。LSD、MSD和HSD组最终单产依次为(352.84±32.54)、(650.17±29.77)和(1197±82.52) kg/圈(图 2)。
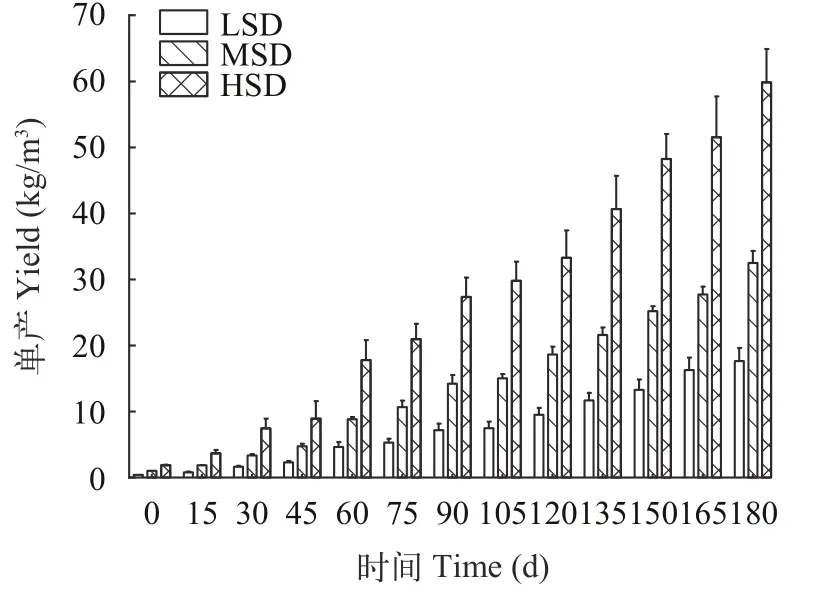
图2 不同密度圈养大口黑鲈单产Fig. 2 Yield of largemouth bass at different densities groups in stable breeding
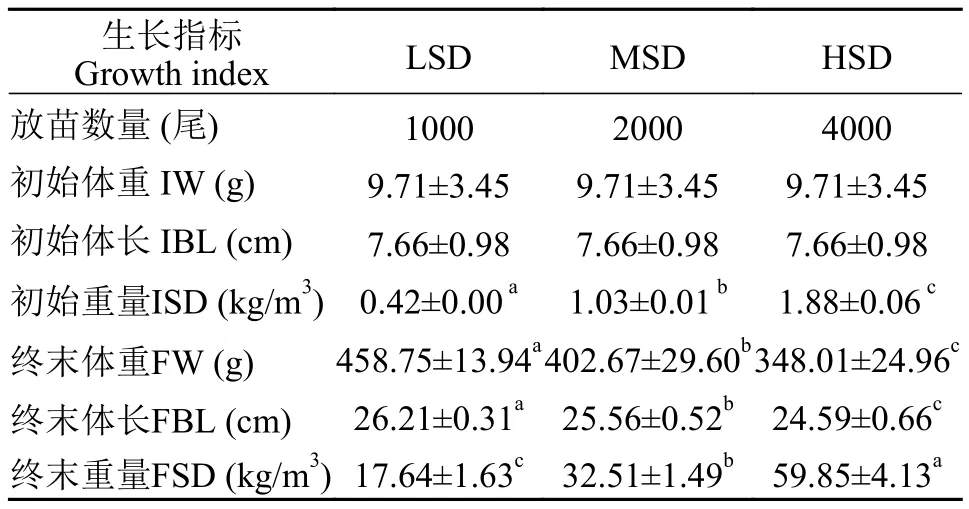
表2 不同密度圈养大口黑鲈生长状况Tab. 2 Growth of largemouth bass at different densities in stable breeding
2.3 生长速度
总体上, 各密度组特定生长率随养殖时间延长呈逐步下降趋势: 0—30d阶段各组特定生长率约为4.5%/d, 30—60d阶段各组特定生长率为3%—3.5%/d,60d以后, 各组特定生长率从1.8%左右逐渐下降至1%/d (图 3)。
0—30d阶段, HSD组特定生长率显著高于其余密度组(P<0.05; 图 3), 且体重也显著高于LSD组(P<0.05; 图 4)。在规格苗种(~40 g/尾)培育阶段, 较高圈养密度(不低于4000尾/圈)有助于大口黑鲈苗种的快速生长。
30—60d阶段, HSD组特定生长率和体重均显著低于LSD组(P<0.05), 而MSD组与LSD组差异不显著(P>0.05; 图 3和图 4)。当体重达到50 g/尾时,大口黑鲈圈养密度宜下调至4000尾/圈以下但不低于2000尾/圈。
60d以后, 各密度组特定生长率差异不显著(P<0.05; 图 3), 但HSD组体重在各时间节点均显著低于其余密度组(P<0.05); 60—105d阶段, MSD组体重与LSD组差异不显著(P>0.05); 各密度组体重之间差异显著(P<0.05), 组间LSD组体重最大(图 3)。这说明拥挤胁迫效应至养殖中后期逐渐显现。
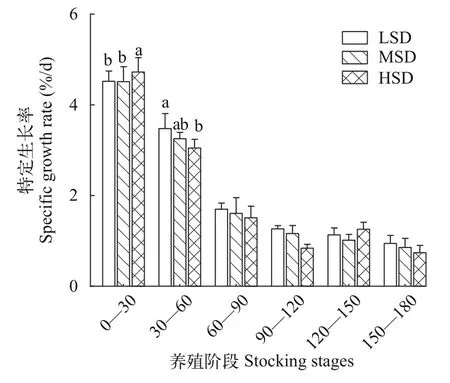
图3 不同密度圈养大口黑鲈特定生长率Fig. 3 SGR of largemouth bass at different densities in stable breeding
2.4 摄食和饵料转化效率
各试验组摄食率在整体上呈逐渐降低趋势, 而且HSD组摄食率在大部分阶段显著降低(P<0.05;图 5a); 各试验组饵料系数在整体上呈先上升后下降的趋势(图 5b)。0—30d阶段, HSD组饵料系数显著低于LSD、MSD组(P<0.05); 其他阶段差异不显著(P>0.05; 图 5b)。
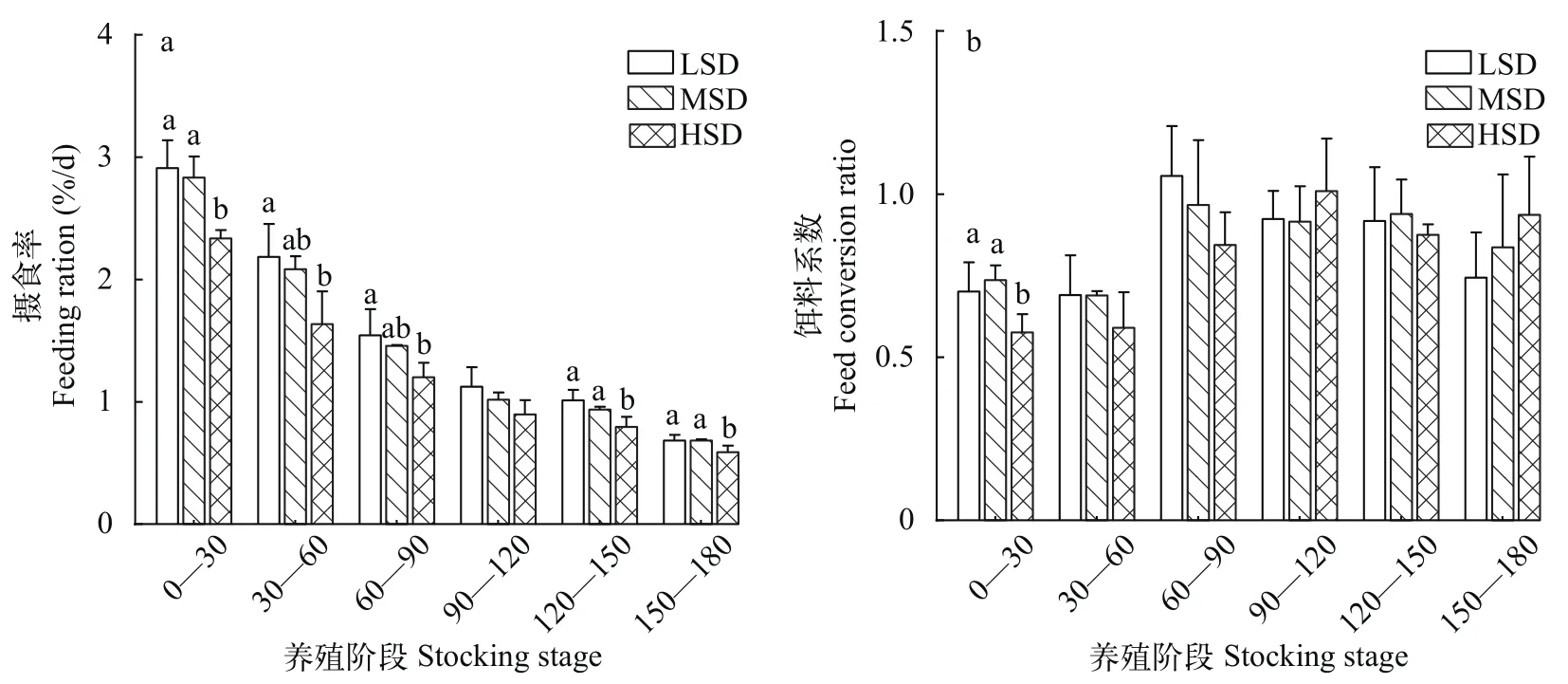
图5 不同密度圈养大口黑鲈摄食率和饵料系数Fig. 5 Feeding ration and feed conversion ratio of largemouth bass at different densities in stable breeding
2.5 血清生化指标
在60d时, 各密度组血清生化指标均没有显著差异(P>0.05); 在120d时, 相比于LSD和MSD组,HSD组甘油三酯及碱性磷酸酶含量更高(P<0.05),并且一直持续到180d; 在180d时, HSD组葡萄糖和谷丙转氨酶也显著高于另外两组(P<0.05), 而总蛋白、胆固醇和谷草转氨酶含量在各密度组之间没有显著差异(P>0.05; 表 3)。

表3 不同密度圈养大口黑鲈的血清生化指标Tab. 3 Serum biochemical indexes of largemouth bass at different densities in stable breeding
2.6 肝脏抗氧化指标
在第0至第120天时, HSD组超氧化物歧化酶活性显著低于LSD组(P<0.05), 其他指标在各组之间无显著差异(P>0.05); 在180d时, HSD组总抗氧化力、超氧化物歧化酶、过氧化氢酶活性显著降低(P<0.05), 而丙二醛浓度显著升高(P<0.05; 图 6)。
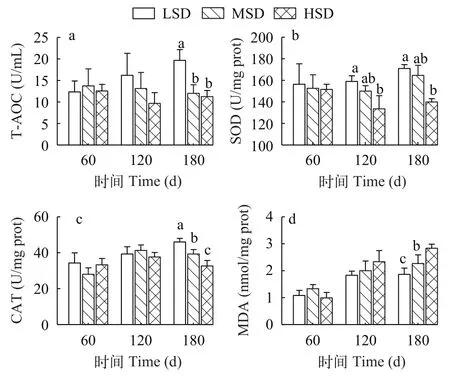
图6 不同密度圈养大口黑鲈抗氧化性能Fig. 6 Antioxidant properties of largemouth bass at different densities in stable breeding
3 讨论
3.1 圈养密度对大口黑鲈存活率的影响
在本试验中, 0—30d阶段、90—120d两个阶段各组存活率均较低, 这与两次较大的死亡有关。第一次发生在进苗初期, 水温23.3—25.2℃, 其主要原因是鱼苗运输和转运过程中发生了较严重的机械损伤, 鱼苗入养殖桶后受到水霉菌感染而爆发水霉病; 第二次发生在8月中下旬, 水温31.2—32.6℃, 大大超过了大口黑鲈生长最适水温(18—28℃), 高温会引起大口黑鲈食欲下降、自身免疫力降低[9], 受铜绿假单胞菌、金黄色葡萄球菌感染, 暴发烂嘴烂身病。从发病规律和特征来看, 圈养大口黑鲈有两大技术关键点, 一是鱼苗在运输和投放过程中要尽量避免机械损伤; 二是高温时期需要注重保护鱼体健康, 增强鱼体免疫力。另外, 先前的一些研究报道了养殖鱼类存活率与密度之间呈反比关系, 如虹鳟(Oncorhynchus mykiss)[10]和尼罗罗非鱼(Nile tilapia)[11]在高养殖密度下存活率更低。本研究的结果与之不同, 在圈养模式下, 大口黑鲈存活率并不会因为密度升高而降低。另外, 除暴发疾病引起较大死亡外, 其他阶段的存活率均在98%以上, 这也侧面印证大口黑鲈可以很好适应圈养环境。
3.2 圈养密度对大口黑鲈生长的影响
鱼类不同生长阶段的适宜放养密度不同。0—30d阶段, HSD组虽然尾数较多, 但由于鱼体规格较小, 30d时的平均单产仅为1.88 kg/m3, 养殖系统实际承载量并不大。该阶段HSD组体重和特定生长率显著高于LSD组, 同时HSD组饵料系数更低。这表明, 大口黑鲈规格苗种(~40 g/尾)培育阶段, 较高圈养密度(≥4000尾/圈)对其生长有利。限于本研究苗种放养规格, 小规格(<5 g/尾)培育阶段的适宜圈养密度有待进一步研究。有研究证实, 较高放养密度可增进个体间的竞争和互动性; 在较低放养密度时, 因社会互动性较弱反而引起生长减缓[13,14]。大口黑鲈集群性强, 密养时相互模仿, 有助于增进群体食欲, 进而有益于其快速生长。该现象在细鳞鲑(Brachymystax lenok)[15]和泥塘幼鲻(Chelon labrosus)[16]等鱼类中也普遍存在。
30—60d阶段, HSD组特定生长率和体重均显著低于LSD组, 而MSD组与LSD组差异不显著。60d时, LSD、MSD和HSD组的单产分别是4.64、8.84和17.80 kg/m3。因此, 下调圈养密度有助于养殖对象保持较高生长速度。
在养殖中后期(105—180d), 各密度组间体重各时间节点均差异显著, 表现为密度越低, 体重越大; 同时特定生长率随密度增高逐渐降低, 说明HSD组大口黑鲈在养殖中后期生长速度开始被抑制。这一结果表明, 密度制约效应在养殖中后期才逐渐显现。类似情况在大口黑鲈池塘“跑道”养殖中也被观察到, 如“跑道”养殖后期, 高养殖密度会降低其增重率和特定生长率[17]。大量研究也表明, 过高养殖密度会对鱼类生长性能产生不利影响[18—20], 主要的影响机制可能是, 高养殖密度使鱼类机体应激水平升高, 饲料摄取降低, 机体代谢成本增加[13,21,22]。在本研究中, 养殖中后期HSD组摄食率较LSD、MSD组更低, 这可能是因高密度下养殖鱼类生活空间和食物争夺压力增大、食欲降低[23]导致的。此外, 在高密度胁迫下鱼体会通过分配体内能源物质来弥补额外能量损耗[24], 而摄食量的下降会加剧这种能量损失[25], 这可能是导致本研究中大口黑鲈生长减缓的直接原因。
据本研究结果, 大口黑鲈规格苗种(~40 g/尾)培育阶段, 适宜圈养密度应不低于4000尾/圈(200尾/m3);当体重达到50 g/尾时, 圈养密度宜下调, 综合考虑生长速度和单产, 建议圈养密度下调至2000—3000尾/圈(100—150尾/m3)。
3.3 养殖密度对大口黑鲈健康状况的影响
养殖密度是鱼类重要的慢性应激源之一。机体产生一系列生理反应以适应高密度环境, 因此通过生理指标可评估不同放养密度下鱼类的健康状况[26]。在众多生理指标中, 血清葡萄糖浓度常被用作反映鱼类在应激水平[27]; 总胆固醇和甘油三酯与机体代谢和生理状态密切相关, 反映了鱼类对环境的适应性[28]; 碱性磷酸酶是机体一种重要的代谢调控酶, 与鱼体的抗病能力息息相关[29]。在本研究中,各密度组间血清指标的差异主要存在于养殖中后期(120—180d), 180d时, HSD组血清葡萄糖显著高升高, 这与杂交鲟幼鱼[30]和大口黑鲈[31]的研究结果类似。密度胁迫会上调皮质醇水平, 从而促进糖异生, 加速非碳水化合物转化葡萄糖[32]。180d时,HSD组甘油三酯的浓度显著高于LSD、MSD组, 而总胆固醇浓度在各组间差异不显著。这可能是在密度胁迫下, 甘油三酯被大量动员以应对额外增加的能量消耗导致的。另外, 总蛋白含量在各密度组间没有明显差异, 可能因为能量来源主要是脂肪,总蛋白水平则趋于稳定。本研究还发现, 180d时HSD组碱性磷酸酶活性中显著上升, 说明高密度下机体的代谢和免疫水平增强, 这在团头鲂(Megalobrama amblycephala)的研究中也有类似现象[33]。此外, 谷草、谷丙转氨酶活性与肝功能直接相关,通常这两种酶活性升高表明肝脏发生病变[34], 本研究发现HSD组大口黑鲈肝脏谷草、谷丙转氨酶活性在180d时显著升高, 说明高养殖密度在养殖后期对大口黑鲈肝脏健康存在不利的影响。
在高密度胁迫下, 细胞内氧自由基增加, 当过量的氧自由基和抗氧化防御系统失衡, 就会产生氧化损伤[35]。总抗氧化力、超氧化物歧化酶、过氧化氢酶等抗氧化指标与机体对应激的代偿和清除自由基的能力直接相关[36]。丙二醛是脂质过氧化氢的分解产物, 也是细胞氧化损伤的重要信号之一[37]。在养殖前期(0—120d), 超氧化物歧化酶、过氧化氢酶活力和丙二醛含量在各组间无明显差异, 表明圈养密度在养殖前期没有造成氧化损伤; 养殖后期高养殖密度组的大口黑鲈超氧化物歧化酶、过氧化氢酶显著降低, 同时丙二醛含量显著升高。这说明在养殖后期高密度组大口黑鲈氧自由基合成增强,细胞损伤程度加剧, 清除自由基和抗氧化能力下降,这与在大菱鲆(Scophthalmus maximus)[37]和大西洋鲑(Salmo salar)[38]的研究中发现是一致的。
4 结论
本研究表明, 在养殖前期, 高养殖密度(4000尾/圈, 200尾/m3)对生长有利; 但随养殖时间延长, 养殖密度不断升高, 生长会受到抑制, 并对生理指标和抗氧化性能有一定的负面影响。以尾重9.7 g大规格苗种为养殖起点, 大口黑鲈早期阶段(<40 g/尾)圈养密度宜为4000尾/圈(200尾/m3); 养殖中后期圈养密度宜为2000—3000尾/圈(100—150尾/m3)。
