大白菜KCS基因家族鉴定及在蜡粉近等基因系中表达分析
2022-06-09王荣花王树彬张志刚赵智中李巧云王立华刘栓桃
王荣花 王树彬 张志刚 赵智中 李巧云 王立华 刘栓桃
(山东省农业科学院蔬菜研究所 国家蔬菜改良中心山东分中心 山东省设施蔬菜生物学重点实验室 农业部黄淮地区蔬菜科学观测实验站(山东),济南 250100)
超长链脂肪酸(very long chain fatty acids,VLCFAs)是植物表皮蜡质生物合成的直接前体物质,它是由内质网上的多酶复合体-脂肪酸延长酶(multienzyme-fatty acid elongase,FAE)经过多个循环反应催化生成[1]。FAE多酶复合体包括4种酶:β-酮脂酰辅酶A合成酶(β-ketoacyl-CoA synthase,KCS)、β-酮脂酰基辅酶A还原酶(β-ketoacyl-CoA reductase,KCR)、β-羟酰基辅酶A水解酶(β-hydroxyacyl-CoA dehydratase,HCD)和烯酰基辅酶A还原酶(enoyl-CoA reductase,ECR)[2]。其中,KCS 是 VLCFA 合成中的限速酶,具有严格的底物特异性和碳链长度特异性,它的类型决定了循环反应的速度和最终的酰基辅酶A产物的酰基链长度[3]。
在拟南芥(Arabidopsis thaliana)的21个KCS基因中,AtKCS18/FAR1是第一个被克隆得到的KCS基因,该基因仅在种子中表达,其表达与种子的发育时期相关[4]。与AtKCS18/FAR1属于同一亚属的 5个 基 因,AtKCS4、AtKCS8、AtKCS9、AtKCS16和AtKCS17均没有内含子,其中AtKCS8仅在叶片中表达,AtKCS17只在花和角果中表达[5]。此外,有8个基因包括AtKCS1、AtKCS2/DAISY、AtKCS5/CER60、AtKCS6/CER6/CUT1、AtKCS9、AtKCS10/FDH、AtKCS13/HIC和AtKCS20被报道参与蜡质中VLCFA的合成[6-13]。AtKCS1在拟南芥植株的各个部位中均有表达,其突变体导致蜡质中C26和C30的脂肪醇和脂肪醛含量下降[6,14]。AtKCS2/DAISY和AtKCS20都参与C20-C22的延伸,在表皮蜡质合成和根中木栓质的合成过程具有重要作用[7,13]。AtKCS5/CER60和AtKCS6/CER6/CUT1序列高度相似,参与C24以上的脂肪酸合成,影响植物表皮蜡质含量[8-9]。AtKCS6最初被克隆出来被称为CUT1,是蜡质合成基因[15],CER6基因被克隆后通过序列分析显示,与CUT1是同一个基因[16]。拟南芥cer6突变体的茎、果实和花粉的表皮蜡质严重缺失,且影响柱头识别花粉,导致花粉育性降低[9,16]。AtKCS9在拟南芥的地上部分器官中表达显著,kcs9突变体表现出C24的VLCFA显著减少,C20和C22的VLCFA含量增加[10]。AtKCS10/FDH主要在花和嫩叶中表达,参与表皮蜡质的合成,影响植物的形态结构和胁迫响应[5,11]。AtKCS13/HIC参与气孔的生长发育[12],其在棉花中超量表达可使棉花的纤维细胞伸长[17],编码产物也参与VLCFAs的合成。此外,在蒺藜苜蓿(Medicago truncatula)中发现MtKCS12控制种皮中超长链脂质种类的产生对于保持种子物理休眠至关重要[18]。柑橘属(Citrus)KCS基因家族的综合分析,揭示了CsKCS2和CsKCS11参与果实成熟时表皮蜡的合成[19]。
大白菜(Brassica rapa L.ssp.pekinensis)属于十字花科芸薹属,是我国重要的十字花科蔬菜。基于越来越多的物种已完成基因组测序,KCS家族成员已在拟南芥[5]、油菜[20]、辣椒[21]、黄麻[22]等物种中被鉴定,KCS家族成员在不同物种间存在较大差异。本研究以大白菜Chiifu基因组数据作参考,通过生物信息学方法鉴定大白菜KCS基因家族成员,分析该家族成员的基本理化性质、系统发育进化关系、染色体定位、基因结构、保守基序、组织特异性及在蜡粉近等基因系的表达分析,为深入研究大白菜KCS家族基因奠定基础。
1 材料与方法
1.1 材料
以大白菜06-247(无蜡粉)为母本,He102(无蜡粉)为父本杂交,构建了一个F2-7重组自交 系 群 体(recombinant inbred line,RIL), 在 F7中RIL065是一个花茎表皮有蜡粉/无蜡粉杂合系,称其为剩余杂合系(residual heterozygous line,RHL)即RHL065,继续自交在F8代获得了有蜡粉纯系 RHL065_1 与无蜡粉纯系 RHL065_2[23-24]。RHL065_1与RHL065_2的种子催芽后,播于山东省农业科学院蔬菜研究所核心试验基地。选取RHL065_1与RHL065_2单株各3个为一组样品,分别取其成熟叶片和花茎,每组样品3个生物学重复,样品迅速用液氮冷冻,再转移至-80℃冰箱保存备用。
1.2 方法
1.2.1 大白菜KCS基因家族的鉴定、进化树构建和蛋白特征分析 从TAIR数据库(http://www.arabidopsis.org/)下载了拟南芥KCS基因家族蛋白序列共计 21(AtKCS1 - AtKCS21)条[25]。在 BRAD数据库(http://brassicadb.org/brad/)[26-27]下载大白菜(V3.0版本)和甘蓝(Braol JZS_V2.0版本)全基因组蛋白序列文件和gff3文件构建本地BLASTP数据库,将拟南芥(At)KCS基因家族的蛋白序列通过本地BLASTP比对出大白菜(Br)KCS和甘蓝(Bo)KCS的基因成员。BrKCS和BoKCS基因的命名根据其与AtKCS1 - AtKCS21序列的同源性及共线性关系并添加后缀(a、b......等)来命名。
利 用MEGA 7.0对BrKCS、AtKCS和BoKCS蛋白质序列绘制系统进化树,采用最大似然法(maximum-likelihood), 设 置 Bootstrap值 为 1 000,其他参数保持默认值[28]。利用在线ExPaSy(https://web.expasy.org/protparam/)对获得的BrKCS蛋白质序列分子量、理论等电点进行分析[29]。
1.2.2 大白菜KCS基因的染色体分布和共线性分析 根据BrKCS基因在染色体上的物理位置,使用TBtools[30]对BrKCS基因进行染色体定位。利用BRAD(http://brassicadb.org/brad/searchSyntenytPCK.php)数据库分析大白菜、甘蓝和拟南芥之间的亲缘关系,利用TBtools[30]绘制共线性图。
1.2.3 大白菜KCS基因结构和蛋白保守域结构分析 利 用 Gene Structure Display Server(GSDS 2.0,http://gsds.gao-lab.org/)根据每个BrKCS基因组序列和相应的CDS序列绘制基因结构图[31]。使用模体分析工具MEME(http://meme-suite.org/)对BrKCS蛋白进行保守基序分析,其中最适基序宽度设置为6-50,最大基序设置为10,其他为默认参数。
1.2.4 大白菜KCS基因在不同器官/组织以及不同材料中的表达模式分析 为了分析大白菜不同器官/组织中BrKCS基因的表达水平,在NCBI的GEO数据库下载大白菜不同器官/组织(愈伤组织、根、茎、叶、花和角果)转录组数据(登录号:GSE43245), 以 BrKCS基 因 的 Log2(FPKM)(fragments per kilobase per million mapped reads)值来表示BrKCSs在不同器官/组织中的表达水平,并绘制热图。
前期构建了大白菜花茎有蜡粉组(RHL065_1_T1、T2、T3)与无蜡粉组(RHL065_2_T1、T2、T3)两组cDNA文库,并对文库质量检测后应用Illumina HiSeq平台进行测序[23]。根据RNA-Seq数据中获取的每个BrKCS基因的Log2(FPKM)值来绘制热图。
1.2.5 实时荧光定量PCR(qRT-PCR)利用来源于高代自交系的有蜡粉植株Waxy1(W1)和无蜡粉植株Glossy1(G1)及RIL群体中有蜡粉植株W2和无蜡粉植株G2为试验材料,采用Trizol法(Invitrogen,USA)提取两组样品花茎表皮的总RNA,进行反转录合成cDNA。采用TB GreenTMPremix Ex TaqTMII(TaKaRa,中国)试剂盒、在ABI 7500荧光定量PCR仪进行qRT-PCR反应,以基因葡萄糖-6-磷酸脱氢酶基因(G6PD)作为内标基因,按照2-ΔΔCT法计算基因相对表达量。统计分析用SPSS Version 21.0软件进行,依据Duncan’s multiple range test法计算P< 0.05水平显著性。各基因引物序列如表1所示。

表1 用于qRT-PCR分析的引物序列Table 1 Primer sequences for qRT-PCR analysis
2 结果
2.1 大白菜KCS基因家族的鉴定、系统发育和蛋白特征分析
通过对全基因组蛋白质数据库的鉴定和结构域验证,在大白菜和甘蓝基因组中分别鉴定到32个BrKCS和36个BoKCS蛋白。根据命名规则,将这些蛋白分别命名为BrKCS1 - BrKCS21和BoKCS1 -BoKCS21。将大白菜、甘蓝和拟南芥的KCS蛋白序列构建了无根系统进化树(图1)。这些KCS蛋白成员根据亲缘关系的远近被分为4个不同的亚组(Group A-D)。亚组Group A、B、C和D分别包含10、10、9和3个KCS成员。其中亚组Group A包括 BrKCS1a、BrKCS1b、BrKCS2a、BrKCS2b、BrKC-S10a、BrKCS10b、BrKCS13、BrKCS15、BrKCS20 a 和BrKCS20b,亚组 Group B 包括 BrKCS4a、BrKCS4b、BrKCS8、BrKCS9a、BrKCS9b、BrKCS9c、BrKCS16a、BrKCS16b、BrKCS17和 BrKCS18,亚组 Group C包括 BrKCS3a、BrKCS3b、BrKCS7a、BrKCS7b、BrKCS12a、BrKCS12b、BrKCS19a、BrKCS19b和BrKCS21,亚组Group D是成员最少的,包括BrKCS5、BrKCS6a和 BrKCS6b。
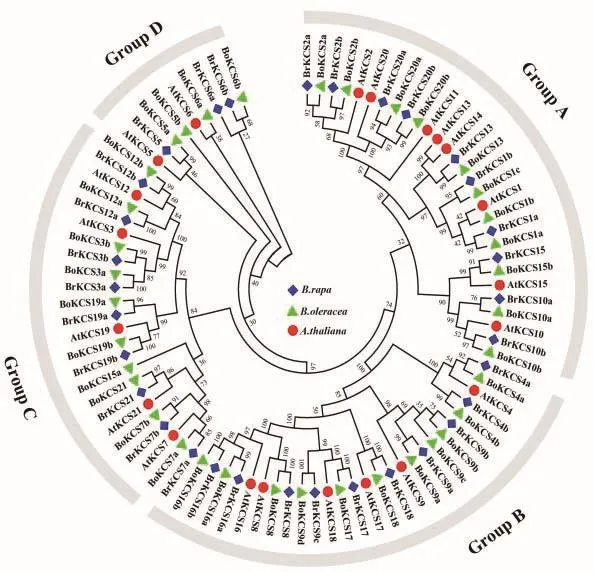
图1 大白菜(Br)、甘蓝(Bo)、拟南芥(At)KCS蛋白系统进化树分析Fig.1 Phylogenetic tree analysis of KCS proteins in Brassica rapa(Br),Brassica oleracea(Bo)and Arabidopsis thaliana(At)
通过在线ProtParam工具预测了BrKCS蛋白的物理和化学特征(表2)。BrKCS蛋白的氨基酸长度范围为181-755 aa。BrKCS蛋白的分子量范围为20.54-84.83 kD,理论等电点范围为8.01-9.40。

表2 大白菜和拟南芥KCS基因对应关系及大白菜KCS基因基本信息Table 2 Corresponding relationship between B.rapa and A.thaliana KCS genes and basic information of KCS genes in B.rapa
2.2 大白菜KCS基因的染色体分布和共线性分析
在本研究中,BrKCS基因家族的32个成员分布在3个亚基因组上,其中LF亚基因组有13个BrKCS基因,MF1有10个BrKCS基因,MF2有9个BrKCS基因(表1)。与拟南芥AtKCS基因相比,大白菜的BrKCS基因在全基因组三倍化的过程中,BrKCS11和BrKCS14被丢失。在进化压的作用下,总共有7个BrKCS基因(BrKCS5、BrKCS8、BrKCS13、BrKCS15、BrKCS17、BrKCS18和 BrKCS21)保留了单拷贝,有11个BrKCS基因(BrKCS1、BrKCS2、BrKCS3等)均保留了双拷贝。只有BrKCS9在进化到白菜的三倍化过程中保留了三拷贝。本研究共有32个BrKCS基因分别被定位在10条染色体上,并分析了BrKCS基因在大白菜染色体上的物理定位。BrKCS16a定位于染色体A01上,BrKCS6a、BrKCS7a、BrKCS19b、BrKCS20b和BrKCS21位于染色体A02上,BrKCS9c、BrKCS15和BrKCS16b位于染色体A03上,BrKCS10b和BrKCS12b位于染色体A04上,BrKCS13定位于染色体A05上,BrKCS3a、BrKCS4a和BrKCS20a定位于染色体A06上,BrKCS6b、BrKCS7b、BrKCS8、BrKCS9a和BrKCS12a定位于染色体A07上,BrKCS2b、BrKCS3b、BrKCS17和 BrKCS18定位于染色体A08上,BrKCS1b、BrKCS4b、BrKCS5、BrKCS9b和BrKCS10a定位于染色体A09上,BrKCS1a、BrKCS2a和BrKCS19a定位于染色体A10上(图2)。

图2 大白菜KCS基因在10条染色体上的定位分布Fig.2 Distribution of KCS gene in B.rapa on 10 chromosomes
此外,将鉴定到的直系和旁系同源KCS基因用于分析BrKCS和AtKCS基因间的共线性。结果共鉴定到大白菜之间14对旁系同源基因、大白菜和拟南芥之间32对直系同源基因(图3)。

图3 大白菜(Br)和拟南芥(At)KCS基因的共线性关系Fig.3 Collinear relationship of KCS genes in B.rapa(Br)and A.thaliana(At)
2.3 大白菜KCS基因结构分析
根据BrKCS基因家族成员的CDS和DNA序列,绘制BrKCS基因结构图(图4)。结果显示,BrKCS基因家族成员之间的外显子数量差异不大(1-7个)。其中BrKCS7b含有7个外显子,BrKCS3、BrKCS4和BrKCS5a含有3个外显子,BrKCS1b、BrKCS2a、BrKCS3b、BrKCS5、BrKCS6a、BrKCS6b、BrKCS13、BrKCS20a和BrKCS20b含有2个外显子,其余19个BrKCS基因均含有1个外显子。

图4 大白菜KCS基因家族外显子-内含子结构分析Fig.4 Analysis of exon-intron structure of KCS gene family in B.rapa
2.4 大白菜KCS蛋白保守域结构分析
利用MEME在线分析工具对BrKCS家族蛋白保守结构域进行分析(图5),获得10个保守基序,分别命名为motif 1-motif 10。结果显示,在32个BrKCS家族成员中,有22个成员含有motif 1-motif 10保守基序。进一步分析发现BrKCS1b、BrKCS12b和BrKCS19a含有9个保守基序,其中BrKCS1b中没有motif 4,BrKCS12b和BrKCS19a中没有motif 5。BrKCS3a、BrKCS12a、BrKCS15和 BrKCS19b含有8个保守基序,其中BrKCS3a、BrKCS12a和BrKCS19b中都缺失motif 5和motif 8,而BrKCS15中缺失motif 6和motif 9。BrKCS3b含有7个保守基序,缺失motif 2、motif 5和motif 8。BrKCS2b中只有3个保守基序分别是motif 1、motif 4和motif 9,BrKCS6a中只有4个保守基序分别是motif 2、motif 3、motif 5和 motif 7。

图5 大白菜KCS基因家族成员蛋白保守结构域分析Fig.5 Analysis of protein conserved domains of KCS gene family members in B.rapa
2.5 大白菜KCS家族基因转录组分析
2.5.1 大白菜KCS基因组织特异性表达分析 本研究分析了29个BrKCS基因家族成员在大白菜不同器官/组织中的表达,另外有3个成员(BrKCS2b、BrKCS6a和BrKCS21)在大白菜不同器官/组织转录组中不表达。大多数BrKCS在大白菜花中高表达,其次是角果、茎、叶、根和愈伤组织(图6)。其中,BrKCS10b和BrKCS5在各个器官/组织中整体表达量最高。在花中表达量由高到低依次是BrKCS5、BrKCS10b和BrKCS6b;在角果中表达量由高到低依次是BrKCS10b、BrKCS6b和BrKCS19a;在茎中表达量由高到低依次是BrKCS10b、BrKCS4b和BrKCS19b;在叶中表达量由高到低依次是BrKCS10b、BrKCS4b和 BrKCS20b。
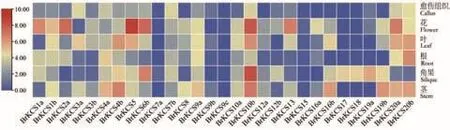
图6 大白菜KCS基因在不同组织/器官中的表达分析Fig.6 Expression analysis of KCS gene in B.rapa on different tissues/organs
2.5.2 大白菜KCS基因在蜡粉近等基因系中的表达分析 本研究分析了28个BrKCS基因在蜡粉近等基因系中的表达模式,另外4个BrKCS基因(BrKCS6a、BrKCS9c、BrKCS17和 BrKCS18) 在 大白菜蜡粉近等基因系转录组中不表达。如图7所示,共计17个BrKCS基因在有蜡粉大白菜中的表达量高于无蜡粉大白菜;BrKCS2b、BrKCS4a、BrKCS4b、BrKCS7a、BrKCS7b、BrKCS8、BrKCS9b、BrKCS12a、BrKCS16a、BrKCS19b和BrKCS20b共计11个基因在有蜡粉大白菜中的表达量低于无蜡粉大白菜。其中,BrKCS5、BrKCS9a、BrKCS10b和BrKCS13整体表达水平相对较高。
11对BrKCS基因具有双拷贝,其中5对(BrKCS1、BrKCS2、BrKCS6、BrKCS7、BrKCS10) 部 分 同 源拷贝在两近等基因系中均存在表达差异。如图7,BrKCS1a,BrKCS2a,BrKCS6b,BrKCS7b,BrKCS10b相较另一个部分同源拷贝具有较高表达量,特别是BrKCS2b,BrKCS6a,BrKCS7a三个基因几乎或完全没有检测到表达。6对BrKCS基因(BrKCS3、BrKCS4、BrKCS12、BrKCS16、BrKCS19、BrKCS20)两个部分同源拷贝在两近等基因系中表达差异均未达到统计学显著水平。BrKCS9是唯一一个具有3个部分同源拷贝的大白菜KCS编码基因,拷贝BrKCS9c在两近等基因系转录组分析中均未检测到表达,BrKCS9a总体表达量较高,BrKCS9b相对表达量较低。

图7 大白菜KCS基因在大白菜蜡粉近等基因系中的表达分析Fig.7 Expression analysis of BrKCS gene in waxy nearisogenic line of B.rapa
2.6 实时荧光定量PCR(qRT-PCR)
利用qRT-PCR验证了14个BrKCS基因在有/无蜡粉高代自交系及蜡粉近等基因系表皮中的表达情况,其中2个BrKCS基因(BrKCS6a和BrKCS9a) 不 表 达( 图8)。BrKCS1a、BrKCS2a、BrKCS5、BrKCS6b、BrKCS9c、BrKCS10b、BrKCS13和BrKCS20a共计8个基因在RIL群体中有蜡粉大白菜中的表达量高于无蜡粉大白菜。其中,BrKCS5、BrKCS6b、BrKCS9c、BrKCS10b和BrKCS20a整体表达水平相对较高。BrKCS7a、BrKCS7b、BrKCS9b和BrKCS10a共计4个基因在RIL群体中有蜡粉大白菜中的表达量低于无蜡粉大白菜。以上分析结果与转录组结果基本一致。此外,14个BrKCS基因在没有亲缘关系的有/无蜡粉高代自交系中的表达模式与蜡粉近等基因系中的表达模式相一致。

图8 大白菜KCS基因在大白菜有/无蜡粉高代自交系及近等基因系表皮中的相对表达量Fig.8 Relative expression of BrKCS gene in waxy/non-waxy high-generation inbred lines and near-isogenic lines of B.rapa
3 讨论
基因组多倍化广泛存在于众多物种进化过程中,通过基因扩张或部分同源基因功能分化为新基因产生和物种进化提供了重要途径。本研究在大白菜中鉴定到32个KCS家族成员,通过进化树分析和基因组共线性分析,展示了大白菜基因组三倍化事件对该基因家族扩张和分化的影响。大白菜32个BrKCS分为19个部分同源基因,其中12个(约63%)随基因组三倍化进行了扩展,但仅1个基因具有3个部分同源基因,说明三倍化事件后产生了较高频率偏性基因丢失[26]。另外,我们发现BrKCS7的两个部分同源拷贝间基因结构和表达模式存在巨大差异,BrKCS7b比旁系同源基因BrKCS7a多出2 015 bp对应6个外显子结构,BrKCS7a在不同器官/组织和蜡粉近等基因系中的表达模式与BrKCS7b差异显著,这可能使两者在功能上产生了分化。
KCS家族基因是超长链脂肪酸延伸反应的关键酶,其调控合成的C20 - C30的超长链脂肪酸是植物表皮蜡质合成的前体物质[1-3]。植物表皮蜡粉主要分布在植物茎、叶和荚果等器官的表面,在植物抗干旱、抵御病害等生物与非生物胁迫方面起着重要作用[5,14]。同时对于大白菜等叶用蔬菜作物特别是白菜薹品种,蜡粉是重要的商品性状[32]。随着基因组学的快速发展,越来越多的植物全基因组序列已经完成测定,更多的KCS基因家族成员被分离鉴定[1,15]。拟南芥中发现了 21 个 KCS 基因[5],其中有 8个基因(AtKCS1、AtKCS2/DAISY、AtKCS5/CER60、AtKCS6/CER6/CUT1、AtKCS9、AtKCS10/FDH、AtKCS13/HIC和AtKCS20)已被报道参与蜡质中VLCFA的合成[6-13]。本研究对大白菜不同器官/组织和蜡粉近等基因系进行转录组分析并绘制表达热图,结果显示BrKCS基因具有不同的组织表达模式,部分同源基因之间以及同一分组的基因之间的组织表达模式有较大差异。此外,利用qRT-PCR验证了BrKCS基因在蜡粉近等基因系表皮中的表达情况,证明了转录组数据的可靠性。拟南芥突变cer6植株茎和角果的蜡质严重缺失[16],而且C24的蜡质衍生物大量积累[9,16],在油菜(Brassica napus)中BnKCS6在花蕾和30 d种子中表达量较高[20],而大白菜中BrKCS6a在不同器官/组织的转录组、蜡粉近等基因系和高代自交系中都没有表达,BrKCS6b在花和角果中高表达,并且有蜡粉大白菜中的表达量显著高于无蜡粉。KCS5与KCS6同源性最高,油菜BnKCS5在叶片和柱头中的表达量较高[20],而白菜BrKCS5仅在花中表达量很高,并且在有蜡粉大白菜中的表达量显著高于无蜡粉大白菜。AtKCS10/FDH主要在花和嫩叶中表达,BnKCS10在花蕾和柱头的表达量较高,BrKCS10b整体表达量高,特别是角果和花,而BrKCS10a在大白菜不同器官/组织、蜡粉近等基因系和高代自交系中表达量都很低。以上线索表明BrKCS5、BrKCS6b与BrKCS10b可能是参与大白菜蜡粉合成的关键KCS基因,值得进一步开展功能验证工作。
本研究中对大白菜KCS基因家族进行鉴定及分析,根据与拟南芥的同源性比较,推测该家族中高表达量的BrKCS5、BrKCS6b与BrKCS10b是超长链脂肪酸延伸所必需的,这为今后开展BrKCS5、BrKCS6b与BrKCS10b基因在控制大白菜蜡质性状中的具体功能研究奠定了基础。
4 结论
本研究在大白菜全基因组中共鉴定到32个BrKCS基因家族成员,可分为4个亚族,不均匀地分布在10条染色体。在大白菜各个器官/组织中,BrKCS5、BrKCS6b与BrKCS10b表达量高且在有蜡粉大白菜中的表达量显著高于无蜡粉大白菜,这些证据表明其可能参与大白菜蜡粉的合成。
