奶牛子宫内膜原代上皮细胞转染miRNA模拟物效率的研究
2022-06-09郑程远孙敬明张晓山
邹 晓,郑程远,*,孙敬明,张晓山,王 平
(1.齐齐哈尔大学,黑龙江齐齐哈尔 161000;2.黑龙江北大仓集团有限公司,黑龙江齐齐哈尔 161000)
随着现代化牧场飞速发展,繁殖与营养成为集约化奶牛场的主角,子宫类疾病因关乎奶牛繁殖性能而广受学者关注。奶牛子宫内膜上皮细胞作为子宫组织的重要组成细胞,是研究子宫类疾病的基础[1-4]。MicroRNA(miRNA)是一类新发现的内源性非编码转录后调控sRNA,可作用于靶基因mRNA,抑制或增强靶基因miRNA的翻译,进而引起相应靶蛋白的变化[4-8]。目前,通过模拟生物体内内源性miRNA化学合成模拟物片段,转染至体外细胞以达到增强或抑制miRNA表达的方法,成为检测其功能和识别miRNA靶基因的重要手段[9-11]。在常见的转染方法中,阳离子脂质体转染因其具有操作简单、转染率高、低毒、无免疫原性、质粒免受核酸酶降解等优点得到了广泛应用[12]。影响转染效率的因素很多,其中原代细胞的转染效率低是一项难题;转染效率直接决定了后续生物学功能的研究结果。
本研究以奶牛子宫内膜原代上皮细胞为研究对象,探讨不同转染试剂和转染时间对miRNA模拟物转染效果的影响,筛选最适合的转染条件,并通过Q-PCR法评估最适条件下miRNA模拟物的试剂转染效果,以期为后续同类研究提供参考。
1 材料与方法
1.1 主要试剂
Lipofectamine RNAiMAX、Lipofectamine 2000、Trizol(Invitrogen);miRNA-RNA mimics、NC miRNA mimics(上海吉玛制药技术有限公司)。
PrimeScript™RT Reagent Kit、SYBR®Premix Ex Taq™Ⅱ(宝日医生物技术有限公司);氯仿、异丙醇、无水乙醇(生工生物工程股份有限公司);RPMI-1640培养基(赛默飞世尔科技公司);血清(浙江天杭生物科技股份有限公司);DEPC水、青链霉素混合液(北京索莱宝科技有限公司)。
1.2 主要仪器
荧光定量分析仪(伯乐生命医学产品有限公司)、ND-1000紫外分光光度仪(赛默飞世尔科技公司)、倒置显微镜(伯乐生命医学产品有限公司)、CO2培养箱(赛默飞世尔科技公司)。
1.3 试验方法
1.3.1 细胞培养
复苏先前冻存的奶牛子宫内膜原代上皮细胞,采用不含抗生素含10%胎牛血清的RPMI-1640培养基接种于6孔细胞培养板中,细胞密度为1×107个/孔,于37℃5%CO2条件下常规培养。
1.3.2 细胞转染
向250μL无血清、无抗生素的RPMI-1640培养基中加入5μL miRNA-185 mimics,轻轻混匀。分别用250μL无血清、无抗生素的培养基稀释5μL Lipofectamine RNAiMAX与Lipofectamine 2000试剂,轻轻混匀,室温静置5 min。将先前预混好的miRNA-185 mimics分别与稀释好的Lipofectamine试剂混合均匀,室温静置20 min,形成miRNA-185 mimics-Lipofectamin复合物。
分别在细胞接种12、18、24 h后,移除先前的培养基,并向每孔加入1.5 mL无血清无抗生素的培养基,加入miRNA-185 mimics-Lipofectamin复合物。转染6 h后,完全培养基清洗细胞3次,每次3 min,荧光显微镜观察转染效果,随机选取5个高倍视野计数阳性细胞及总细胞数。Image J软件分析组间细胞平均荧光强度,记录试验结果。
依据最佳转染条件,对细胞分别转染miR-185 micscs作为试验组(标记为E),转染NC miRNA mimics作为对照组(标记为NC),每组3个重复,转染后48 h收集细胞。
1.3.3 总RNA提取
收集后的细胞每管中加入1 mL Trizol,室温裂解20 min后加入200μL的氯仿,振荡混匀,室温静置10 min。12 000×g离心15 min,取上清加入等体积的异丙醇,轻轻混匀,室温静置10 min。
12 000×g离心10 min,弃去液体,向底部RNA沉掉加入1 mL 75%冰乙醇,轻轻混匀,7 500×g离心6 min。超净台内室温干燥10 min,加入20μL DEPC水。
1.3.4 RT及Q-PCR
试验依据TaKaRa PrimeScript™RT Reagent Kit说明书对各样品总RNA进行反转录。以U6为内参基因,对各样品经行Q-PCR检测。反应程序为:95℃4 min,94℃30 s,60℃30 s,72℃30 s,72℃6 min,35个循环。引物序列见表1。
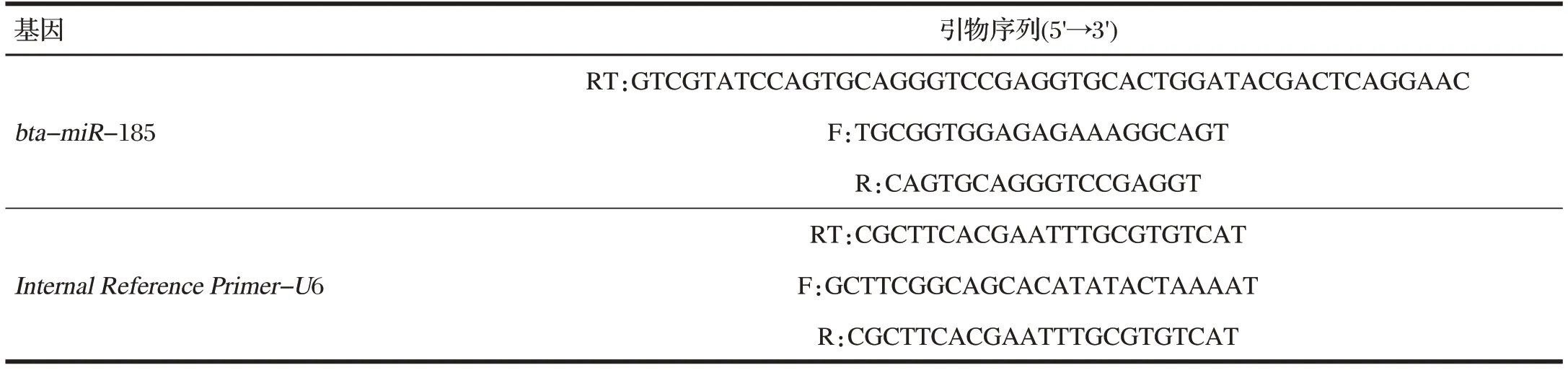
表1 反转录及荧光定量PCR引物序列Tab.1 Sequences of the primers that were used in the RT and Q-PCR
1.4 数据统计与分析
试验数据采用SPSS 19.0软件进行t检验,采用单因素方差和LSD法比较不同转染时间及转染试剂对转染效率和细胞内平均荧光强度的影响应用,2(-Delta Delta C(T))分析Q-PCR结果。P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05差异不显著。
2 结果与分析
2.1 Lipofectamine 2000转染结果(见图1~图3)
由图1~图3可知,各组间均可见绿色荧光信号,说明有miRNA-185 mimics转入细胞内,但转染效果并不理想;且随着接种时间的延长,转染效率逐渐降低。对比自然光下的图片发现,在接种后24 h进行转染,仅有少量miRNA-185 mimics转入未纯化完全的成纤维细胞中。
2.2 Lipofectamine RNAiMAX转染结果(见图4~图6)
由图6~图8可知,各组间均可见强烈的荧光信号,说明存在大量的miRNA-185 mimics转入细胞内且转染效果很好,尤以细胞接种12 h后转染效果最佳。
与Lipofectamine 2000试剂相同,使用Lipofectamine RNAiMAX作为转染试剂时,随着接种时间的延长,转染效率逐渐降低。
2.3 转染试剂对转染效率、荧光强度的影响(见图7、图8)
由图7可知,无论使用Lipofectamine 2000还是Lipofectamine RNAiMAX作为奶牛子宫内膜原代上皮细胞的转染试剂,各组间12 h的转染效率均极显著高于18、24 h(P<0.01),18 h的转染效率均极 显著高于24 h(P<0.01);Lipofectamine RNAiMAX各时间点的转染效率均极显著高于Lipofectamine 2000(P<0.01)。
由图8可知,使用Lipofectamine 2000的各组荧光强度差异不显著(P>0.05)。使用Lipofectamine RNAiMAX作为奶牛子宫内膜原代上皮细胞的转染试剂时,12 h的荧光强度均极显著高于18、24 h(P<0.01),24 h的荧光强度均极显著高于18 h(P<0.01)。Lipofectamine RNAiMAX各时间点的荧光强度均极显著高于Lipofectamine 2000(P<0.01)。结果表明,当使用Lipofectamine 2000作为奶牛子宫内膜原代上皮细胞的转染试剂时,无法达到很好的转染效果。
综上所述,在奶牛子宫内膜原代上皮细胞转染miRNA-185 mimics时,Lipofectamine RNAiMAX转染效果明显优于Lipofectamine 2000,且以接种细胞12 h后转染效果最佳。
2.4 Q-PCR结果(见图9)
为检测优化后的转染条件其真实效果,利用Q-PCR法检测最优条件下miRNA-185的表达变化。由图9可知,与NC相比,E组miRNA-185的表达量极显著升高(P<0.01)。
3 讨论
MiRNA是1类重要的转录后调控因子,参与机体基因组30%以上的蛋白编码过程。大量研究表明,miRNA可参与体内细胞增殖、分化、发育、凋亡等生物学活动,进而影响机体的生理或病理过程[6-11]。miRNA mimics是1段小双链RNA分子,可通过化学手段合成,模拟细胞中内源性成熟miRNA的高表达水平,进而达到特异性增强内源性miRNA的调控作用[13]。体外调控miRNA因化学合成方法兼具操作简单的优点,可高效特异性地调控相关miRNA表达的效果,近年来被广泛应用于miRNA功能和下游靶基因位点等方面的研究。如Gutkoska[14]等将miR-203a-5p和miR-203-5p mimics转入猪的细胞系,研究miRNA-203a在手足口病发病过程中的作用,并取得了重要突破。
奶牛子宫内膜原代上皮细胞是研究奶牛生殖系统疾病分子机制常用的体外模型,奶牛子宫内膜炎和胎衣不下与子宫内膜上皮细胞的生理过程关系极为密切,通过miRNA在子宫内膜原代上皮细胞内对相关疾病的功能基因进行研究具有重要意义。在应用miRNA化学合成模拟物研究miRNA功能试验时,外源性miRNA模拟物对内源性miRNA表达的影响取决于其进入细胞内部的多少,即转染效率的高低。影响miRNA转染效率的因素很多,不同的细胞对miRNA的摄取率不尽相同;因此,若要达到最佳的调控效果,对转染条件的筛选至关重要。
本试验选取miRNA-185 mimics为代表,探究miRNA化学模拟物在奶牛子宫内膜上皮细胞中转染试剂及转染时间对转染效率的影响;结果发现,Lipofectamine RNAiMAX的转染效果明显优于Lipofectamine 2000,与之前的学者大多采用Lipofectamine 2000得到的结果不同[15-16]。分析其原因,可能是由于大多数先前的研究大多选用细胞系而非原代细胞,与细胞系相比,原代细胞更难转入小分子RNA;也可能是由于Lipofectamine RNAiMAX相比Lipofectamine 2000,是一款更新型的、适合小分子RNA转入的试剂,能够实现更高的基因抑制效果,并可在10倍试剂浓度范围内维持细胞的上佳活力,可针对更加广泛的细胞类型,但并未得到更好的推广。
本试验结果发现,无论Lipofectamine RNAiMAX还是Lipofectamine 2000,随着细胞接种时间的延长,转染效率均逐渐下降,其中以细胞接种12 h后转染的效果最好,但与梁戈玉等[16]的研究结果相反。该研究认为细胞接种24 h后转染效果最好,12 h的效果并不理想。这可能是由于物种及细胞本身特性不同所造成的。此外,无血清、无抗生素培养基的使用以及严格的用量标准均为高转染效率提供了保证。
4 结论
本试验结果表明,奶牛子宫内膜原代上皮细胞适合应用脂质体进行miRNA化学合成模拟物的转染,miRNA转染效率的高低与转染试剂及转染时间相关;选用Lipofectamine RNAiMAX作转染试剂,细胞接种12 h后转染可达最佳的转染效果,实际检测表达量变化后,可应用于后续试验。
