宫颈黏液腺癌MRI诊断价值
2022-06-09周宣邑李学胜宁
周宣邑 孙 艳 李学胜宁 刚,*
1.四川大学华西第二医院放射科,出生缺陷与相关妇儿疾病教育部重点实验室(四川 成都 610041)
2.成都市第四人民医院放射科(四川 成都 610036)
宫颈癌是发展中国家和地区最常见的妇科恶性肿瘤[1],2018年宫颈癌全球新发病例估计为569847例,死亡病例数为311365例[2],而在我国每年新发病例约为98900人,死亡病例约为30500人[3],所以宫颈癌目前仍是对妇女的健康和生命有着严重危害的恶性肿瘤之一。鳞癌在宫颈癌组织学类型中最多见,约占69%,而腺癌约占20%~25%,腺鳞癌仅占3%~5%[4-5]。2014年WHO肿瘤分类[6]中,把宫颈黏液腺癌(mucinous adenocarcinoma of the uterine cervix)重新定义为一个新的亚组,发病率占宫颈腺癌的10%左右[7],起自于宫颈内膜柱状黏液细胞,可分为胃型、肠型、宫颈管型、印戒细胞型四个亚型。研究显示,MRI在宫颈癌诊断方面具有一定优势[8],但目前国内尚无大宗病例对宫颈黏液腺癌MRI表现进行研究。本研究通过回顾性分析19例经手术病理证实的宫颈原发黏液腺癌的MRI表现,拟提高对该病MRI影像特点的认识,并分析MRI诊断及其临床分期的价值。
1 资料与方法
1.1 研究对象回顾性分析2010年1月至2020年5月期间经手术和病理证实,并在术前行MRI检查的19例宫颈黏液腺癌患者的影像资料,患者年龄范围位于28~68岁,中位数年龄42岁。临床症状主要表现为阴道流液、不规则出血、腹痛、腹胀等,其中尤以大量的黏液或者水样分泌物排出最为突出。病理类型为普通型宫颈黏液腺癌13例,胃型黏液腺癌4例,宫颈管型黏液腺癌2例。截至本次随访之时,3例死亡(该3例存活时间分别为14个月、25个月、48个月),14例术后存活,病程范围为19~65个月,中位数为41个月,2例患者失访。
1.2 扫描方式扫描范围即常规腹盆腔扫描范围,从膈顶到耻骨联合下缘水平,若病灶较大超出常规扫描范围时则扩大扫描范围。用3.0T西门子MRI Skyra扫描仪进行扫描。患者仰卧位,平静呼吸。平扫时采用T2WI矢状位、横断位及冠状位扫描TSE序列(TR/TE: 3000ms/100ms,层厚4.0mm)、横断位T2WI压脂TSE序列(TR/TE:7200ms/70ms,层厚4.0mm)、T1WI横断位TSE序列(TR/TE:670ms/10ms,层厚4.0mm)、DWI序列分别运用b值为50s/mm2及1000s/mm2进行扫描(TR/TE:6200ms/80ms,层厚4.0mm)。增强扫描用钆喷酸葡胺对比剂,注射速率1~2mL/s,剂量2025mL;3.0T磁共振注射对比剂后采用T1WI矢状位VIBE序列(TR/TE:4.0ms/1.2ms,层厚4.0mm)进行动态扫描,后采用T1WI矢状位、横断位及冠状位TSE序列(TR/TE:780ms/140ms,层厚4.0mm)进行延迟扫描。
1.3 图像分析方式MRI图像由两名从事妇科影像诊断的高年资医师进行分析,意见不一致时经过共同讨论得出最后结果。观察内容包括:(1)病灶部位、最大直径、形态、生长方式、边界;(2)病灶分别在T1WI、T2WI、DWI及增强检查时的信号特点(信号强度及强化程度均以子宫肌层为参照);(3)肿块质地:分为实性及囊实性;(4)囊液信号:以子宫颈肌层为参照分为低信号或高信号;(5)宫颈间质环、宫颈内膜、宫体、阴道、宫旁受累情况;(6)淋巴结增大,即盆腔淋巴结短径大于0.8cm,腹主动脉旁淋巴结短径大于1.0cm[9-10],或者淋巴结形态呈圆形,边缘有毛刺,信号不均匀出现坏死、与宫颈原发病灶信号相似都提示淋巴结受累[11];(7)邻近及远处脏器转移情况。
2 结 果
19例宫颈黏液腺癌患者的病理分型如下:普通型宫颈黏液腺癌13例,胃型黏液腺癌4例,宫颈管型黏液腺癌2例。肿块最大径为0.8~4.7cm,经检验符合正态分布,肿块大小平均直径3.1±1.3cm;MRI分期Ⅰ期10例,其中Ⅰa期1例(1/19,5.3%),最大径约0.8cm;Ⅰb期9例(9/19,47.4%),最大径约1.7~3.5cm(中位数为2.7cm);Ⅱa期2例(2/19,10.5%),最大径分别约2.6cm、4.1cm;Ⅲc期5例(5/19,26.3%),最大径约3.9~5.4cm(中位数为4.2cm);Ⅳa期卵巢转移2例(2/19,10.5%),最大径分别约2.0cm、4.7cm。
生长方式:宫颈黏液腺癌在宫颈管内生长7例(7/19,36.8%),在宫颈管内生长并经宫颈外口突向阴道腔6例(6/19,31.6%),完全向宫颈外口生长突向阴道腔2例(2/19,10.5%),在宫颈管内生长并向宫颈内口生长突向宫体腔内2例(2/19,10.5%),在宫颈管内并同时向宫颈管内外口生长2例(2/19,10.5%)。
病灶内部影像学特点:肿瘤边界均不清楚,实性12例(12/19,63.2%),囊实性7例(7/19,36.8%);其中囊性病灶内可见分房3例(3/7,42.9%)、不分房4例(4/7,57.1%);囊液信号T1WI、T2WI均为高信号6例(6/7,85.7%),T1WI呈低信号、T2WI信号较高1例(1/7,13.0%),囊液出现DWI弥散受限者2例(2/7,28.6%);病灶合并宫颈纳氏囊肿者7例(7/19,36.8%)。病灶实性部分T1WI上呈混杂等、高信号12例(12/19,63.2%),均匀等信号6例(6/19,31.6%),不均匀等、低信号1例(1/19,5.3%);T2WI上呈不均匀高信号14例(14/19,73.7%)、均匀高信号5例(5/19,26.3%)。DWI弥散受限均为高信号。动态增强扫描早期(28~88s)强化程度高于肌层,延迟期强化程度低于肌层9例(9/19,47.4%),不均匀轻度强化8例(8/19,42.1%),渐进性强化1例(1/19,5.3%),持续性明显强化1例(1/19,5.3%)。病灶内出现坏死11例(11/19,67.9%),其中1例坏死较明显。
宫颈间质环完整1例(1/19,5.3%),部分受侵变薄1例(1/19,5.3%),间质环连续性中断17例(17/19,89.5%),其中宫颈肌层受累小于1/2者2例(2/19,10.5%),大于1/2但未累及全层者12例(12/19,63.2%),全层受累且宫旁受侵者3例(3/19,15.8%)。
直接侵犯情况:阴道未受累14例(14/19,73.7%),阴道前穹隆受累2例(2/19,10.5%),后穹隆受累2例(2/19,10.5%),阴道上1/3受累1例(1/19,5.3%);子宫体下段或颈体交界区受累9例(9/19,47.4%)。
闭孔淋巴结转移3例(3/19,15.8%),髂外血管旁淋巴结及闭孔淋巴结转移1例(1/19,5.3%),髂总血管旁淋巴结转移1例(1/19,5.3%)。
远处转移情况:转移至双侧卵巢2例(2/19,10.5%),所有病例均未见膀胱及直肠受侵。(见图1~图3)
本组病例手术病理FIGO分期Ⅰ期7例,Ⅱ期4例,Ⅲ期5例,Ⅳ期3例;MRI分期与手术病理分期一致率78.9%(15/19)例,其中,Ⅰ期一致率为100%,Ⅱ期为50%,Ⅲ期为80%,Ⅳ期为66.7%(表1),MRI分期与病理分期一致性kappa值0.698,(P<0.05)。本组淋巴结转移以病理结果为“金标准”,MRI诊断淋巴结转移的真阳性4例,真阴性12例,假阳性2例,假阴性1例,诊断准确率为84.2%(kappa=0.617,P<0.05)。
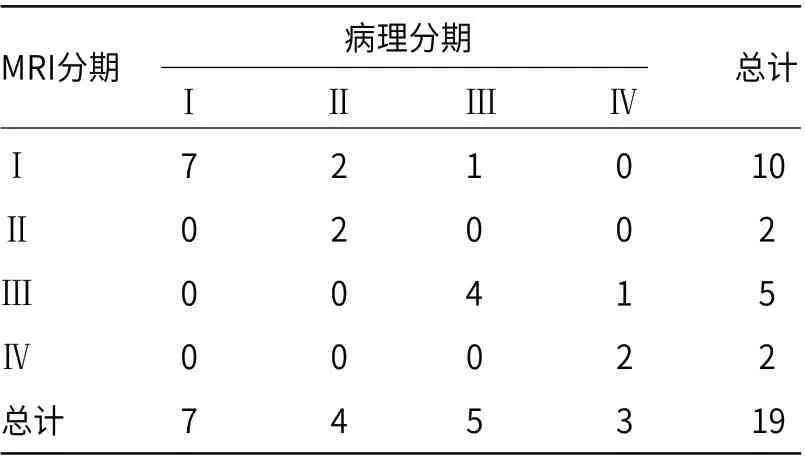
表1 宫颈黏液腺癌MRI分期与病理分期比较(例)
3 讨 论
宫颈黏液腺癌是一种极其少见的宫颈癌类型,尽管由于宫颈癌的广泛筛查及HPV疫苗在世界范围内广泛使用致使宫颈癌的发病率有所下降,然而宫颈腺癌的发病率却没有显著地减少,反而稍有增长[12-14]。因此其发病率正在相对升高,并且宫颈黏液腺癌较其他类型宫颈腺癌预后更差,尤以胃型为甚[7],宫颈腺癌的5年生存率为68%[15],宫颈黏液腺癌的5年生存率为49%[7],而胃型黏液腺癌的5年生存率比其他亚型更低,只有25%[16-17]。但在本次研究中,黏液腺癌的5年生存率达到了82.3%,与文献报道存在一定差异[7],考虑可能是因为此次研究病例数量较少所致。
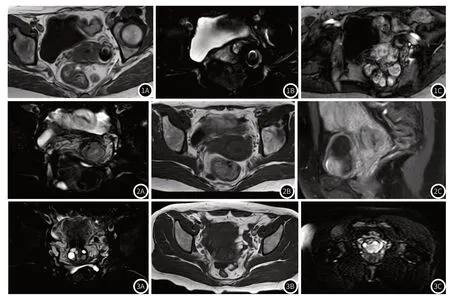
病例一,39岁,病理诊断为高分化黏液腺癌(胃型),病灶内可见囊状长T1长T2信号(图1A,图1B),增强扫描病灶呈不均匀较明显强化(图1C)。病例二,54岁,病理诊断为中分化黏液腺癌(宫颈内膜型),病灶呈实性,在T1WI上呈不均匀等、高信号(图2A),T2WI上呈不均匀少高信号(图2B),宫颈间质环受累断裂,增强扫描病灶呈较明显强化(图2C)。病例三,43岁,病理诊断为宫颈中分化黏液腺癌(普通型);病灶为宫颈囊实性肿块,囊内可见分房,T2WI(图3B)为不均匀高信号,T1WI(图3A)实性部分为稍低信号,而囊性部分为不均匀稍高信号,宫颈间质环T2低信号消失,弥散(图3C)明显受限。
在2018年的宫颈癌FIGO分期[18]中,宫体受侵并不影响分期,但在分期中并没有提及病灶转移到卵巢的情况,经与妇科专家讨论,认为宫颈癌卵巢转移应该被视为远处转移,应归为第Ⅳ期。宫颈黏液腺癌的癌变部位通常位于宫颈管较深部位,在早期局限于宫颈管内[19-20],而常规宫颈细胞学筛查在取材中一般较为表浅,容易漏诊;高分化宫颈黏液腺癌的细胞结构与正常宫颈管上皮细胞相似也是TCT漏诊的原因之一[21];并且约20%的患者在早期缺乏临床表现[22],在临床上约有1/2的宫颈癌患者未进行过宫颈癌筛查[23],而MRI因为有良好的软组织分辨率,MRI平扫诊断宫颈癌的灵敏性可达97.06%[24],而结合弥散加权成像其敏感性更是可达到100%[25],目前已经成为发现大于1cm的宫颈黏液腺癌的首选检查[26-27]。本组19例病例中,沿宫颈管或呈内生性生长者共9例,其中在9例IB期及IA期的病例中,有5例仅沿宫颈管或呈内生性生长;肿块向上侵犯宫颈交界区及宫体者共9例,占47.4%,而肿块向下侵犯阴道者共5例,占26.3%,说明以此次研究来看,肿块更倾向于向宫颈内口生长侵犯,与文献报道相一致[19]。
宫颈黏液腺癌病灶内出现囊性病变较多见[28],MRI表现为T1WI、T2WI均为高信号的多发囊样信号,囊壁不规则强化[29],本研究中病灶质地呈囊实性者占36.8%(7/19),其中囊性病灶内含T1WI高信号者占85.7%(6/7),病灶内出现囊状改变多是因为黏液腺癌含有大量的富含黏液的细胞,而囊内出现T1WI高信号多是因为囊内富含黏液及(或)出血的原因[28],有报道称多个小囊灶可组成类似不规则的“花瓣型”的多房囊性病灶[30]。多囊性黏液腺癌与宫颈良性囊性病变在常规MRI图像上往往不易区别,有些多囊性黏液腺癌在MRI上可以表现为假性良性病变,如纳氏囊肿[31],但其病灶内并不含实性成分,可以将二者进行鉴别。
病灶内实性成分在DWI序列弥散受限均为高信号,这不仅是因为病灶T2WI投射效应增强及肿瘤浸润扩散受限所致,而肿瘤内较大的细胞密度和细胞胞浆内较多的黏蛋白也可能是弥散受限的原因[32]。病灶内出现坏死者占67.9%(11/19),但多为少量坏死,且多出现在肿瘤较大者。
在本组病例中,病灶增强扫描呈早期明显强化,强化程度高于肌层,延迟期轻度强化,强化程度低于肌层者多见,占47.4%(9/19),推测其原因为病灶为富血供肿瘤,双侧子宫动脉下行支同时或者不对称增粗向肿瘤供血[33],所以在增强早期发生明显强化。
在本研究中,宫颈内膜浸润者占94.7%(18/19),且宫颈间质环受累者占94.7%(18/19),宫颈肌层不同程度受累者占大部分,为 89.5%(17/19),推测其原因为肿瘤腺细胞多深达肌层或及宫颈管外壁[20],以及病变位置较深,早期检查容易漏诊[23]。19例病例中1例宫颈内膜未受累,是因为其位于宫颈后唇,推测其或起源于宫颈外口腺鳞交界区。
宫颈黏液腺癌主要与其他宫颈恶性肿瘤进行鉴别。
在宫颈恶性肿瘤中发病率第一的是宫颈鳞癌[34],T1WI序列表现为低(等)信号,T2WI序列表现为高(稍高)信号,肿瘤内出现坏死囊变者较少,多表现为实性肿块,增强扫描时实性部分大多呈快进慢出的强化方式,且鳞癌的最大强化程度大多显著高于腺癌[35];肿块内因为没有黏液成分,所以在T1WI上出现高信号的几率不大;另外鳞癌是起源于宫颈复层扁平上皮,位于宫颈的表面,因此鳞癌多为外生性生长,所以在MRI图像上将宫颈黏液腺癌及宫颈鳞癌进行鉴别是有可能的,但对于实性的黏液腺癌,其MRI影像征象不典型,很难与宫颈鳞癌相区别,最后还需要根据病理结果进行确诊。
宫颈淋巴瘤多表现为T1WI等信号为主,T2WI可为等、高信号的宫颈外生性软组织肿块,增强扫描往往强化程度较弱,一般信号比较均匀,出现坏死囊变者少见,且宫颈黏膜及宫颈间质环很少受累,通过MRI图像与宫颈黏液腺癌进行鉴别较容易实现[36]。
综上所述,宫颈黏液腺癌少见,但其在MRI上的影像表现有一定的特点,肿瘤在较早期更倾向于沿宫颈管内生性生长,宫体受侵犯较阴道受侵犯更常见;肿瘤出现囊变者较多,且可出现分房,T1WI序列囊液因为含有黏液的原因可为高信号;实性部分均呈弥散受限高信号,且增强多出现早期明显强化,强化程度高于肌层,延迟期轻度强化,强化程度低于肌层;宫颈内膜及宫颈间质环受累者占绝大多数,且早期病灶可局限于宫颈管内,但最后确诊还是需要通过病理诊断。由于本病少见,本研究搜集病例数量较少,未对每个病理亚型进行影像病理分析,而且为回顾性研究,存在一定程度的偏倚,仍需进一步研究加以证实。
