肉制品中总磷含量测定及国际标准制定研究
2022-06-09褚佳玥葛淑丽马跃龙
褚佳玥 葛淑丽 马跃龙

摘要:本研究采用电感耦合等离子体发射光谱仪(ICP-OES)测定肉与肉制品中的总磷元素。以磷元素特征谱线波长定性,在一定浓度范围内,磷元素的谱线信号强度与其浓度成正比,采用标准曲线法进行定量。再通过对标准物质和一系列有代表性的肉制品样品的系统性实验分析,验证了该方法的适用性、准确度和精密度。通过组织国内外14家分析实验室进行的国际实验室间比对,依据ISO 5725-2:2019《测量方法与结果的准确度(正确度与精密度) 第2部分:确定标准测量方法重复性与再现性的基本方法》,使用科克伦(Cochran) 检验以格拉布斯(Grubbs)检验对收集到的数据进行了离群值筛选,并计算得到目标离子测定的重复性与再现性标准差,最终拟合得到精密度值和平均水平之间的函数关系,统计结果表明该方法适用性广且精密度高,因而被推荐为新的ISO国际标准。
关键词:总磷 肉制品 国际标准 ICP-OES
Determination of Total Phosphorous Content in Meat Products and the Development of International Standard
Chu Jiayue, Ge Shuli, Ma Yuelong
(Shanghai Institute of Quality Inspection and Technical Research)
Abstract: This research is to determine the total phosphorous content in meat products by Inductively coupled plasma optical emission spectrometry(ICP-OES) method. Based on the characteristic spectral line wavelength of phosphorus, within a certain concentration range, the spectral line signal intensity of phosphorus is directly proportional to its concentration, and the standard curve is used for quantification. The applicability, accuracy and precision of the method is verified by systematic experimental analysis on both reference materials and a series of representative meat products. An international ring comparison test with 14 participating labs around the world was conducted. According to ISO 5725-2:2019 Accuracy of measurement methods and results (trueness and precision)—Part 2: Basic method for the determination of repeatability and reproducibility of a standard measurement method, using Cochran (Cochran) test with Grubbs test on the collected data for the selection of outliers, and calculate the target ion determination repeatability and reproducibility of the standard deviation, the end fitting precision value and the function relationship between the average level. Statistical analysis revealed that the new method is both universal and precise, thus it is recommended as new ISO standard.
Key words: total phosphorous content, meat products, international standard, ICP-OES
0 引言
人們日常饮食中磷的摄入量70%~80%来自食物本身的磷[1-2],20%~30%来自于含磷的磷酸盐的食品添加剂[3-5]。磷酸盐作为世界范围内肉制品产业无可替代的食品添加剂[6],在肉制品加工中,添加磷酸盐能用于控制肉制品的颜色、微生物等[7-8],同时可以增强肌肉蛋白质在盐水体系中的溶解性,提高持水性 [9-10]。但是过量地摄入,会危害身体健康。多年来对磷酸盐进行了数次安全性评估,欧盟食品安全局(EFSA)最新规定它的每日容许摄入量(ADI)≤40 mg/kg[11]。世界各国在肉与肉制品标准中磷酸盐的使用限量均有严格规定。CAC最大使用量2200 mg/kg[11],腌制肉制品天然含有和添加的磷酸盐8000 mg/kg,肉汤等磷酸盐总量1000 mg/kg(以P2O2 计)[11]。欧盟最大使用量5 g/kg与我国GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中对肉制品中磷酸盐限量值一样[4-5]。
目前肉及肉制品总磷定量测定方法主要分为重量法、分光法和电感耦合等离子体发射光谱法(ICP-OES)等方法[12-13]。欧美等国家目前都有各自的检测标准,例如,ISO 13730:1996《肉及肉制品总磷含量的测定 分光法》和ISO 2294:1972《肉及肉制品 总磷含量的测定 重量法》;欧盟标准BS EN 16943:2017和FDA EAM以及ISO 27085:2009都是用ICP-OES方法检测多种元素其中就包括了磷。考虑到当前世界各国检测磷元素的方法多已发展为电感耦合等离子体发射光谱法(ICP-OES),现有国际标准ISO 2294:1994和ISO 13730:1996无法满足世界各国对于食品中总磷含量的检测趋势,本项目的研究将在原有标准重量法和分光法的基础上,增加世界主流国家均采用的ICP-OES方法,检出限降低至1.0 mg/kg,并扩大标准的适用范围至多种可食部位。从而建立起一套检出限低、定性定量准确、使用范围广泛的国际标准检测方法。
现有重量法检测总磷的方法耗时长,检测灵敏度低;分光法步骤烦琐,前处理湿法消解试验危险性大[12,14]。本试验以GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》为基础,综合考虑世界各国总磷含量的检测方法[12-14],选用微波消解为前处理方法,用ICP-OES法检测肉与肉制品中总磷含量,并向国际标准化组织“肉、禽、鱼、蛋及其制品标准技术委员会”提出建立新的总磷国际标准的工作提案,项目申请获得了投票批准。新的检测方法大大缩短检测时间,降低方法检出限,适用于鲜肉和熟肉及其制品、动物内脏、肠等各种肉类。并且该方法通过对标准物质和一系列有代表性的肉类样品系统性实验分析[15-16],证实了该方法具有较宽的线性范围、较高准确度和精密度。经技术委员会的推荐,由14家分析实验室进行了国际实验室间比对[17-18],统计结果表明该方法的适用性广且精密度高,新的国际标准已发布。
1 材料与方法
1.1 材料与试剂
超纯水(一级):Millipore制备;硝酸(优级纯或更高纯度,国药集团化学试剂有限公司);硝酸溶液(5+95,国药集团化学试剂有限公司):取50 mL硝酸,缓慢加入950 mL水中,混匀;磷元素标准储备液(1000 mg/L,国药集团化学试剂有限公司)。
1.2 仪器与设备
Avio 500电感耦合等离子体发射光谱仪(美国,珀金埃尔默PerkinElmer);ME-T电子天平(瑞士梅特勒):感量为0.0001 g;CEM Mars6微波消解仪(美国培安公司):配有聚四氟乙烯消解内罐;IKA T25样品粉碎设备:匀浆机(德国)。
1.3 实验方法
样品微波消解后,采用电感耦合等离子体发射光谱仪测定,以磷元素特征谱线波长定性;在一定浓度范围内,磷元素的谱线信号强度与其浓度成正比,采用标准曲线法进行定量。每个样品测两次,再计算方法检出限、线性、精密度、加标回收率等。
1.4 试样样品
方法开发与研制阶段使用的样品种类做到了尽可能覆盖各种肉类,包括A牛肉、B鸡肉、C鸭肉、D羊肉、E猪肉共5个样品。5种肉类基质(猪肉、牛肉、羊肉、鸡肉、鸭肉)的冻干粉末(上海食品研究所提供),每瓶样品净含量为6 g,共10瓶样品。每种基质2瓶样品,检测1瓶,备样1瓶。
1.5 试样制备
实验前,需等待干粉样品恢复至室温后,充分摇晃样品瓶,保证样品均匀性。称取干粉样品0.1g(m0),精确至0.0001 g,至消解罐中。取样品量4倍质量的超纯水m1,复溶冻干粉末,等干粉复水膨胀约10 min后(平衡样品),按照实验前处理要求处理样品。(m= m0+m1)
1.6 磷元素标准系列溶液
磷元素标准系列溶液(国药):精确吸取适量标准贮备液,用硝酸溶液(5+95)逐级稀释配成标准系列溶液,质量浓度分别为0 mg/L、10.0 mg/L、20.0 mg/L、40.0 mg/L、60.0 mg/L、80.0 mg/L。可根据仪器灵敏度及样品中磷元素实际含量,适当调整标准系列溶液质量浓度范围。
1.7 ICP-OES条件
水平观测;功率:1200 W;等离子气流量:15 L/min;辅助气流量:0.5 L/min,雾化气气体流量:0.65 L/min,待测谱线:213.6 nm。
1.8 微波消解
向复溶后的样品基质中加入5 mL~10 mL硝酸,加盖消解罐放置1 h或过夜,旋紧罐盖,按照微波消解仪标准操作步骤进行消解,消解参考条件为一阶段110 ℃,升温5 min,恒温10 min,二阶段150 ℃,升温5 min,恒温10 min,三阶段195 ℃,升温5 min,恒温20 min。冷却后取出,缓慢打开罐盖排气,用少量水冲洗内盖,将消解罐放在控温电热板上于100 ℃加热30 min,用水定容至25 mL。
1.9 测定
标准曲线绘制:将标准系列工作溶液注入电感耦合等离子体发射光谱仪中,测定分析谱线的强度信号响应值,以元素浓度为横坐标,其谱线强度响应值为纵坐标,绘制标准曲线。 试样测定:将空白溶液和试样溶液分别注入电感耦合等离子体发射光谱仪中,测定分析谱线强度的信号响应值,根据标准曲线得到消解液中磷元素浓度。
1.10 结果计算
试样中磷含量按下式计算:
其中,m = m0+ m1
式中:
X ——试样中磷含量,单位为毫克每千克(mg/
kg);
ρ ——试样溶液中磷质量浓度,单位为毫克每升
(mg/L);
ρ0——试样空白液中磷质量浓度,单位为毫克每
升(mg/L);
V ——试样消化液定容体积,单位为毫升(mL);
f ——試样稀释倍数;
m ——样品和超纯水称样量,单位为克(g);
m0——样品称样量,单位为克(g);
m1——超纯水称样量,单位为克(g)。
计算结果保留三位有效数字。
2 结果与分析
2.1 检出限
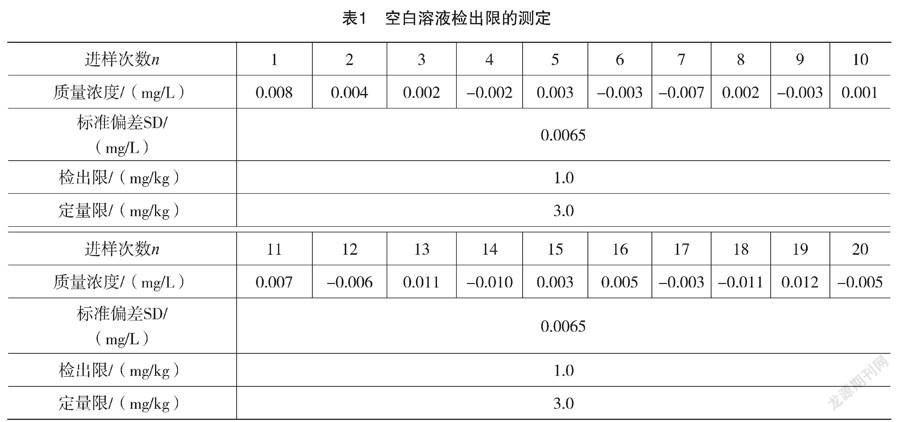
依次测定标准空白溶液,得到标准工作曲线,在相同条件下测得20次试样空白,得到20次空白值的标准偏差SD。3倍的SD值以称样量和定容体积计算即为方法的检出限,10倍的SD值以称样量和定容体积计算即为方法的定量限,检出限和定量限见表1所示(以称样量0.5 g,定容体积25 mL计)。
2.2 标准曲线及线性范围
用电感耦合等离子体发射光谱仪测定标准系列工作溶液的吸光度,以元素的响应值为纵坐标,元素的浓度为横坐标,绘制标准曲线,所得的线性回归方程及相关系数见表2,磷元素标准溶液浓度在0 mg/L~100 mg/L,范围内线性良好,相关系数R>0.999。
2.3 精密度
以豬肉作为基质,在相同检测条件下,对样品进行测定,重复6次,所得数据重复性结果见表3,RSD为0.75%<2%,符合美国公职分析化学家协会(AOAC)制定的关于方法精密度验证的相关要求[19],即精密度良好。
2.4 准确度
以猪肉作为基质,在待测样品中加入一定已知浓度的标准溶液,按与基质相同的前处理方法和检测方法进行测定[15-16],加标分为三个梯度水平,每个加标水平重复做三次,结合方法的检测限及肉品中的普遍含量,回收数据见表4。样品中不同浓度的加标回收率在95.8%~107.7%,符合美国公职分析化学家协会(AOAC)制定的关于方法准确度验证的相关要求[19],即回收率要求在85%~110%,表明该方法的准确度良好。
2.5 国际实验室间比对研究
通过上述研究可以确定,新的肉制品中ICP-OES检测方法能得到有效精确的检测结果。经技术委员会的推荐,由14家分析实验室进行了国际实验室间比对,考察新方法的普适性和精密度(重复性和再现性),进而确认方法的有效性。试验样品包括A牛肉、B鸡肉、C鸭肉、D羊肉、E猪肉共5个样品[15-16,20],每个样品做双平行实验。
在国际标准的制定过程中,为了确定检测方法的再现性,组织开展了国际实验室间比对,收集了14家实验室对5种肉类制品分别进行测定,数据见表5。依据ISO 5725-2:2019《测量方法与结果的准确度(正确度与精密度) 第2部分:确定标准测量方法重复性与再现性的基本方法》,使用科克伦(Cochran) 检验以格拉布斯(Grubbs)检验对收集到的数据进行了离群值筛选,并计算得到目标离子测定的重复性与再现性标准差[17-18],最终拟合得到精密度值和平均水平之间的函数关系。
2.5.1 数据一致性和离群性检验
根据ISO 5725-2:2019,在对采用实验室间比对所得的检测数据进行平均值和精密度参数计算前,必须对数据的有效性(一致性)进行统计检验,剔除对结果可能造成干扰的离群值。
(1)Mandel检验
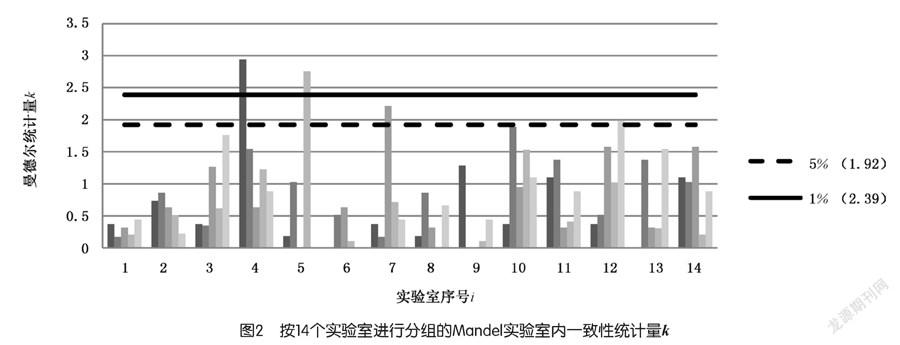
本研究首先采用Mandel的实验室间一致性统计量h和实验室内一致性统计量k来检验上述原始数据的一致性,即对每个实验室i的每个水平j计算实验室间的一致性统计量h和每个实验室内的一致性统计量k,以每个实验室的不同水平为一组(组内数据按缩二脲质量分数水平次序排列)进行描点作图,结果如图1和图2所示,图中水平虚线分别表示显著性水平为1% 及5% 时的Mandel 统计量h 与k的临界值。
图1可以看出,实验室6在样品水平C,实验室4在样品水平E上出现了歧离值。
图2可看出:实验室4在样品水平A和实验室5在样品水平D上出现了离群值(即重复性测试结果有较大的变异)。实验室7在样品水平C,实验室12在样品水平E上出现了歧离值。
Mandel统计图提示需要采用数值离群Cochran和Grubbs检验法对数据做进一步分析。
(2)Cochran检验
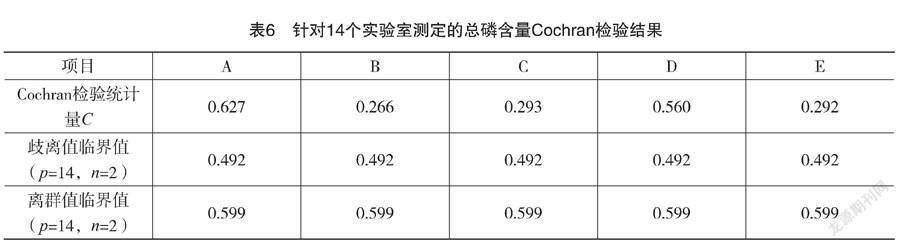
实验室间比对数据有效性的一项重要假设是各参与实验室所提交数据的实验室内方差没有显著差异[19]。按 ISO 5725-2:1994的要求,首先采用针对实验室内一致性的 Cochran 检验法对各实验室的数据进行分析,如果计算所得Cochran 统计量C大于置信水平 5% 临界值但小于等于置信水平1%临界值,则对应被检验项目为歧离值;若计算所得 Cochran 统计量C大于置信水平 1% 临界值,则对应被检验项目为离群值见表6。
表6显示,在水平A,Cochran统计量C的计算结果为0.627,超过了其离群值临界值0.599;在水平D,Cochran统计量C的计算结果为0.560,接近临界值上限0.599。表明针对这2个水平的样品测试中,有实验室数据不能使用,基本与图2的直观结果符合。经过进一步分析,实验室4在水平A和实验室5在水平D所测数据的绝对差值最大,应当拒绝这2个结果。
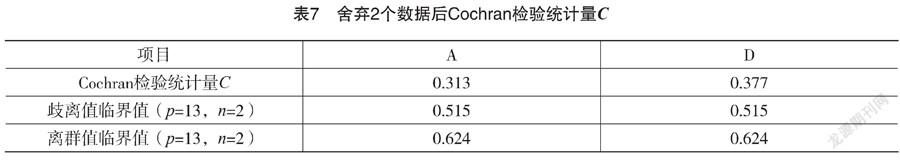
舍弃2个数据后,对其余13家实验室在水平A和D的测试值分别再次进行Cochran检验。如表7所示,不存在离群值和歧离值。
(3)Grubbs检验
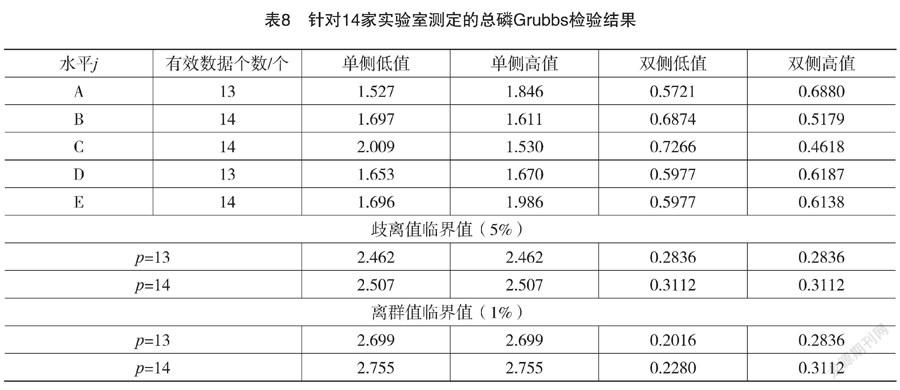
Grubbs 检验是针对实验室间数据一致性进行的数理检验[15-16],此处检验是针对通过 Cochran 检验后保留的数据,其在水平A和水平D剩余13个数据,计算得到的Grubbs检验结果见表8。
对于单侧离群值的Grubbs检验,如果计算所得Grubbs检验统计量G大于置信水平5%临界值,但小于或等于置信水平1%临界值,则对应被检验项目为歧离值。如检验统计量G大于置信水平1%临界值,则对应被检验项目为离群值。
对于双侧离群值的Grubbs检验,如果计算所得Grubbs检验统计量G小于置信水平5%临界值为歧离值。如检验统计量G小于置信水平1%临界值为离群值。
表8表明,14家实验室的现存所有数据(经Cochran统计检验保留的有效数据)中不存在离群值和歧离值,均为通过数理统计检验的有效数据。
2.5.2 平均值和标准偏差的计算分析
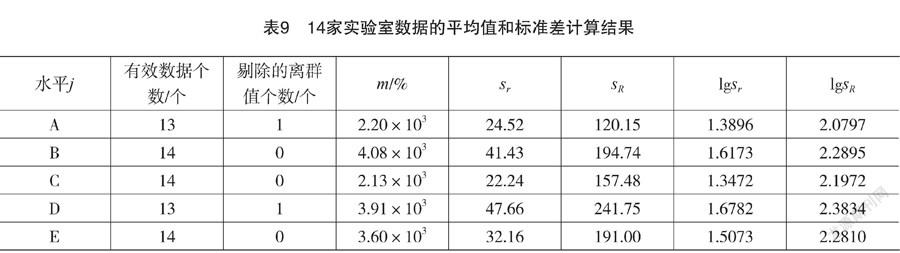
通过上述数据一致性和离群值的统计检验,将14家实验室采用ICP-OES法测定肉与肉制品中总磷质量分数的平均值(m),重复性标准差(sr)和再现性标准差(sR)进行了计算。
考察表9中标准差与m的关系,发现标准差与m没有明显的线性关系,但是有对数关系;sr,sR,lgsr,lgsR与平均值m的关系,发现lgsr和lgsR与m存在较强的正相关系。数据拟合结果证实了这一猜测,两者存在如下线性关系:
lgsr=0.9574lgm-1.8295 R2=0.8787
lgsR=0.698 lgm-0.1868 R2=0.7252
重復性限lgsr=2.6807lgm-5.1226
再现性限lgsR=1.9544 lgm-0.5230
3 结论与讨论
通过国际实验室间比对活动,不仅考察了肉制品研究开发的ICP-OES的普适性及精密度,还在试验过程中得到了参与实验室的反馈意见,对该方法进一步规范化具有积极意义。
一部分参与实验室,如实验室4和5在前处理过程中,没有把硝酸赶尽,会导致最终的ICP检测结果偏高。这也是在标准中规定缓慢打开罐盖排气,将消解罐放在控温电热板上于100℃加热30min的原因。
为确定试验方法的精密度,对肉与肉制品中总磷含量开展国际实验室间比对试验,在试验方案实施过程中共收集到14个实验室并提供了试验结果。本标准以国家标准为基础,优化和统一了前处理肉制品的步骤,统一用微波消化,收到的国内外14家实验室的数据都在误差范围内,说明该实验方案有高度的统一性。
对于最后的实验数据统计,我们按照ISO的统计原理和要求,对试验结果的精密度按ISO 5725-2:1994 进行统计,共发现有 2个离群值,没有离群实验室,所产生的离群值是由随机误差引起的。精密度结果表明研究开发的ICP-OES测定肉与肉制品中总磷含量是可行的,各实验室间的测定值有较好的一致性,经统计得到的精密度结果能用来确定试验方法的重复性标准差和再现性标准差。此方法有较宽的线性范围、较高的准确度和精密度,通过组织国内外 14个分析实验室进行国际实验室间比对,统计结果表明该新方法适用性广且精密度高,因而被推荐作为新的国际标准。
参考文献
[1] 吴永宁,赵云峰,李敬光. 第五次中国总膳食研究[M]. 北京: 科学出版社,2018:102-104.
[2] 孙平, 张津凤, 姚秀玲. 化工产品手册: 食品添加剂[M]. 6版.北京:化学工业出版社,2015: 189-199.
[3] 郝为民. 磷酸盐在肉制品中的作用[J]. 黑龙江农业科学,2008(4): 101-102.
[4] 李苗云, 张秋会, 柳艳霞, 等. 不同磷酸盐对肉品保水性的影响[J]. 河南农业大学学报,2008,42(4):439-442.
[5] 臧明伍, 王守伟, 乔晓玲, 等. 肉制品磷酸盐含量调查与限量研究[J]. 肉类研究,2012,26 (7):16-20.
[6] U.S. Food and Drug Administration. Food Additives Status List (2019)[EB/OL]. https:// www.fda.gov/food/food-additives-petitions/food-additive-status-list#ftnP Accessed 13 November 2019.
[7] 张俭波, 鲁杰, 杨大进, 等. 生鲜肉及肉制品中磷酸盐含量调查分析[J]. 中国食品卫生杂志,2008,20(4):298-301.
[8] 毕会芳, 刘瑞, 孙嵛林, 等. 肉及肉制品中磷酸盐含量分析[J]. 食品安全质量检测学报,2019,10(16): 5329-5333.
[9] Muguruma M, Tsuruoka K, Katayama K, et al. Soybean and milk proteins modified by transglutaminase improves chicken sausage texture even at reduced levels of phosphate [J]. Meat Science, 2003(63) :191- 197.
[10] Pilar T, Reyes P. Synergistic action of trans glutaminase and high pressure on chicken meat and egg gels in absence of phosphates[J]. Food Chem, 2007(104): 1718-1727.
[11] 刘宗敏,江红波,王鹏,等. 磷酸盐在肉制品中应用研究现状及发展趋势[J]. 肉类工业, 2010(8): 37-39.
[12] IAMMARINO M, HAOUET N, TARANTO AD, et al. The analytical determination of polyphosphates in food: A point-to-point comparison between direct ion chromatography and indirect photometry[J]. Food Chem, 2020, 325(126937):1-9.
[13] Jastrzebska A, Hol A, Sz1yk E. Simultaneous and rapid determination of added phosphorus (V) compounds in meat samples by capillary isotachophoresis[J] . Food Science and Technology, 2008: 1-7.
[14] Iammarino M, Di Taranto A, Palermo C, Centonze D. Polyphosphates in products of animal origin: validation of an analytical method based on ion chromatography with electrochemical conductivity detection[C]//ⅩⅩⅢ Congresso Nazionale della Societa Chimica Italiana. Sorrento: 5-10 luglio 2009.
[15] American Society for Testing and Materials. Standard Practice for Conducting an Interlaboratory Study to Determine the Precision of a Test Method: ASTM E691- 16[S].Philadelphia: American Society for Testing and Materials,2016:1-10.
[16] GRUBBS F E,BECK G. Extension of sample sizes and percentage points for significance tests of outlying observations [J]. Technimetrics, 1979(4):847-854.
[17] 章明洪, 储德韧, 刘刚. 尿基肥料中缩二脲含量测定及国际标准制定研究[J]. 化肥工业,2017,44(3):1-10.
[18] 黄河清, 储德韧, 段路路.Excel在国际实验室间比对数据处理中的应用[J]. 磷肥与复肥,2019,34(1): 41-45.
[19] Official Methods of Analysis of AOAC International: Appendix F: Guideline for Standard Method [M].19th ed.Gaithersburg: AOAC International,2012:1-16.
[20] GRUBBS F E. Procedures for detecting outlying observations in samples [J]. Technometrics, 1969(1):1-21.
