非水溶性样品用的细菌内毒素标准品的研制
2022-06-08裴宇盛赵小燕
裴宇盛,陈 晨,赵小燕,高 华,蔡 彤
(中国食品药品检定研究院,北京 102629)
新型制剂及其所用的辅料(胆固醇、蛋黄卵磷脂、乙胶脂丙胶脂共聚物等)多不溶于水,需采用非水性溶剂溶解,如无水乙醇、二甲基亚砜等。但在进行内毒素的检测研究过程中,关键一步为供试品阳性对照(回收试验)的制备,即向供试品中添加细菌内毒素标准物质。由于目前国内外的细菌内毒素标准品中均含有聚乙二醇和乳糖等水溶性赋形剂[1-3],不能溶于非水溶性溶剂,尤其聚乙二醇具有一定表面活性,当遇到非水溶性溶剂时会在萃取、稀释等过程中会出现乳化现象,最终使检验无法进行[4-6]。
因此,需制备一批专用的细菌内毒素标准品,用于新型制剂及其辅料等非水溶性药品的内毒素检测,即细菌内毒素国家标准品(非水溶性样品用)。
1 材料与方法
1.1 仪器Synergy HT型多功能酶标仪(美国Biotek公司);Multireax型旋涡混合器(德国Heidolph);WNE45型恒温水浴(德国Memmert公司);BET-72型内毒素测定仪(天大天发科技有限公司)MultiFlo FX型多功能微孔板分液器(美国Biotek公司)。
1.2 试剂细菌内毒素精品原料,购于SIGMA公司,批号:024M4019V,该批原料是使用酚水法从菌号为O111B4的大肠杆菌中提取制备得到,生物效价为4×109EU·g-1,由中国食品药品检定研究院分装为1 mg/支。细菌内毒素国家标准品,中国食品药品检定研究院,批号:150800-201601。细菌内毒素检查用水:购于湛江安度斯生物有限公司,货号:W-050。鲎试剂:购于湛江安度斯生物有限公司;厦门鲎试剂生物科技股份有限公司;湛江博康海洋生物有限公司;福州新北生化有限公司。
1.3 标准品候选品的冻干制备共制备2批标准品候选品。分别于2018年1月24日生产了1批候选品,编号为A;于2018年4月18日生产了1批候选品,编号为B。溶液配制的总体积及冻干分装体积如Tab 1。
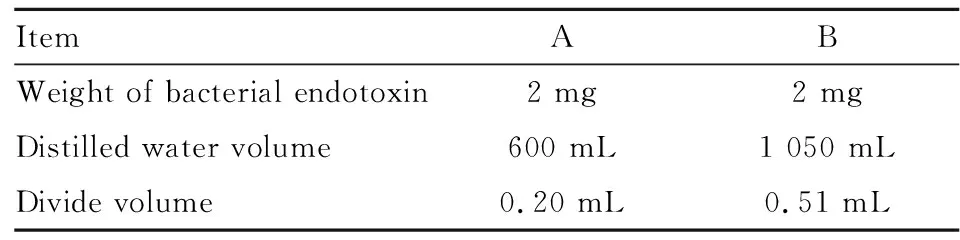
Tab 1 Preparation of standard solution and divide volume
具体操作:取细菌内毒精品2支,用细菌内毒素检查用水溶解,封口膜封口后在旋涡混合器上混匀15 min,然后用刻度吸管将精品溶液吸出,放入装有200 mL灭菌蒸馏水的1 000 mL锥形瓶中,重复2次,在磁力搅拌器上混匀30 min。分别加入内毒素检查用水补至Tab 1中规定的体积,在4 ℃下混合搅拌2 h。然后将溶液灌装于2 mL的安瓿中,每支装量按Tab 1中的分装体积制备。约2.5 h时结束,放入冻干机进行48 h冻干之后机器封口。
1.4 标准品的效价标定该标准品是用于非水溶性新型制剂的细菌内毒素检测,在检测中使用的方法主要为凝胶法、动态浊度法和动态显色法。故使用以上三种内毒素检查方法,以现行的细菌内毒素国家标准品(150800-201601)为基准,采用组织协作标定的形式,对2批候选品进行效价的标定。候选品A预估效价为每支800 EU;候选品B预估效价为每支2 500 EU。参加本次协作标定的单位共13家,标定单位名称及各单位所使用的方法详见Tab 2。
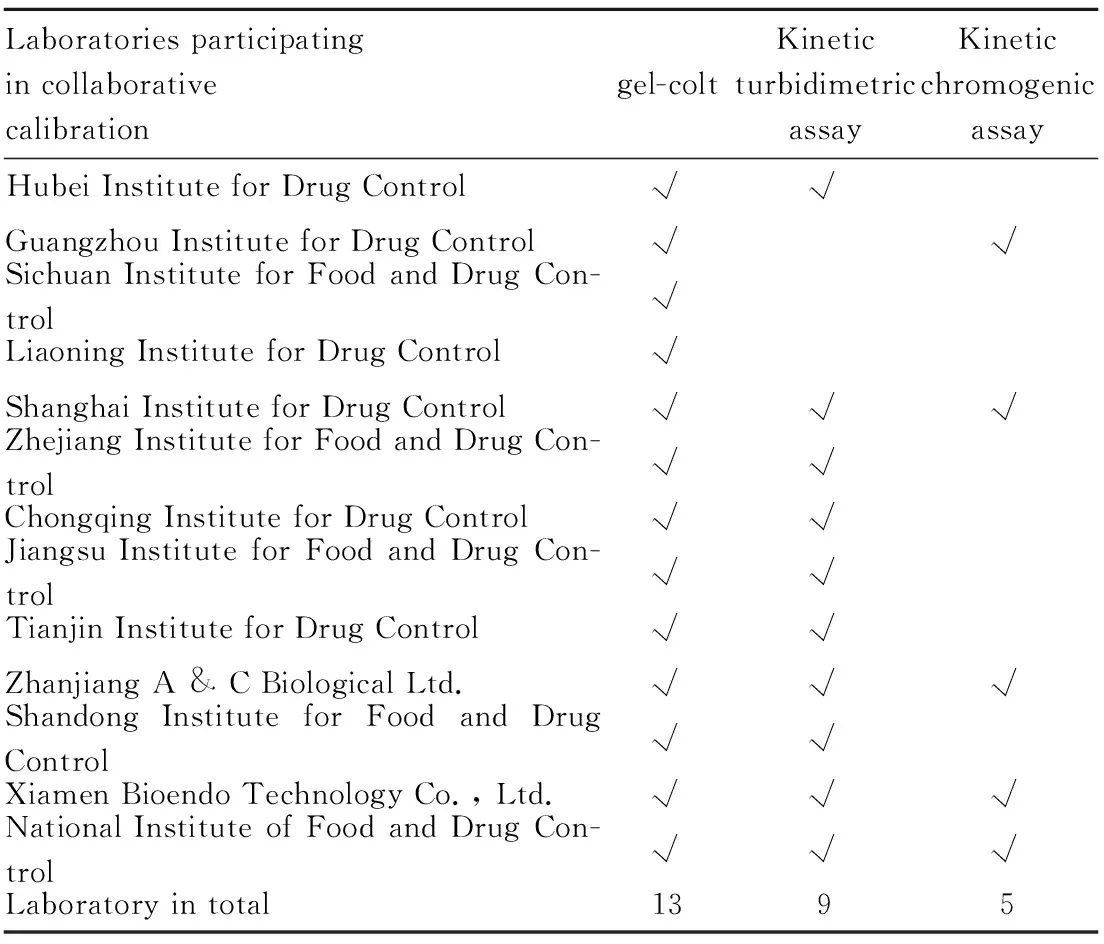
Tab 2 Information of laboratories participating in collaborative calibration
1.4.1标定方法要求 标定具体方法参考《中国药典》2015年版四部附录1143细菌内毒素检查法。其中凝胶法标定数量为:每个协作单位提供候选品A、B各3支,共6支。要求使用2个批号的凝胶法鲎试剂,分别对6支候选品进行效价标定。其中动态浊度法或动态显色法标定数量为:每个协作单位提供A、B批候选品各3支,共6支。要求使用1个批号的光度法鲎试剂,对6支候选品进行效价标定。
最终将标定结果汇总统计,在2批候选品中选择3种方法标定结果间差异小且可信限率小的1批,作为新型制剂专用的细菌内毒素国家标准品。
1.4.2协作标定结果统计与定值 因生物测定方法所得数据的对数值方为正态分布,故生物测定方法的数据统计分析均采用其对数值进行计算。
2 结果
2.1 各单位标定结果汇总具体结果见Tab 3~8。

Tab 3 Results of Gel clot test of candidate A
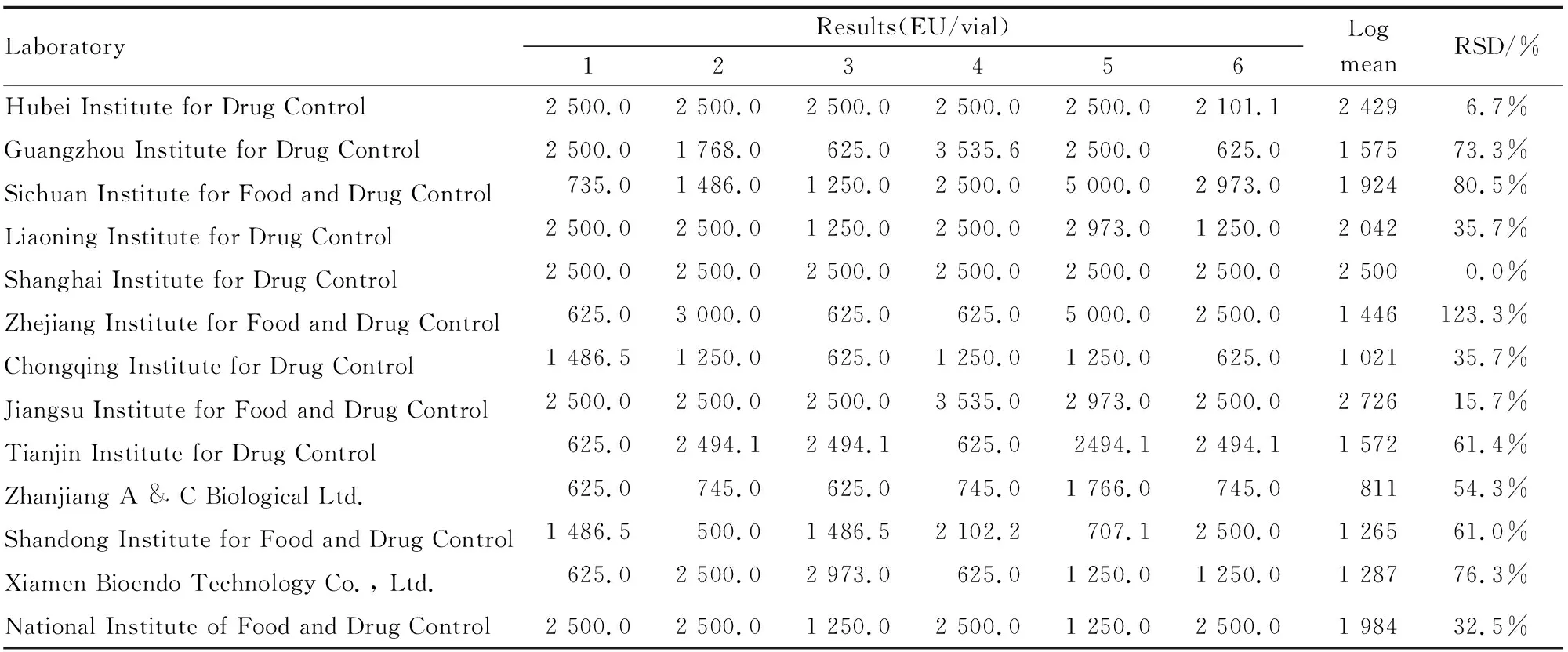
Tab 4 Results of Gel clot test of candidate B
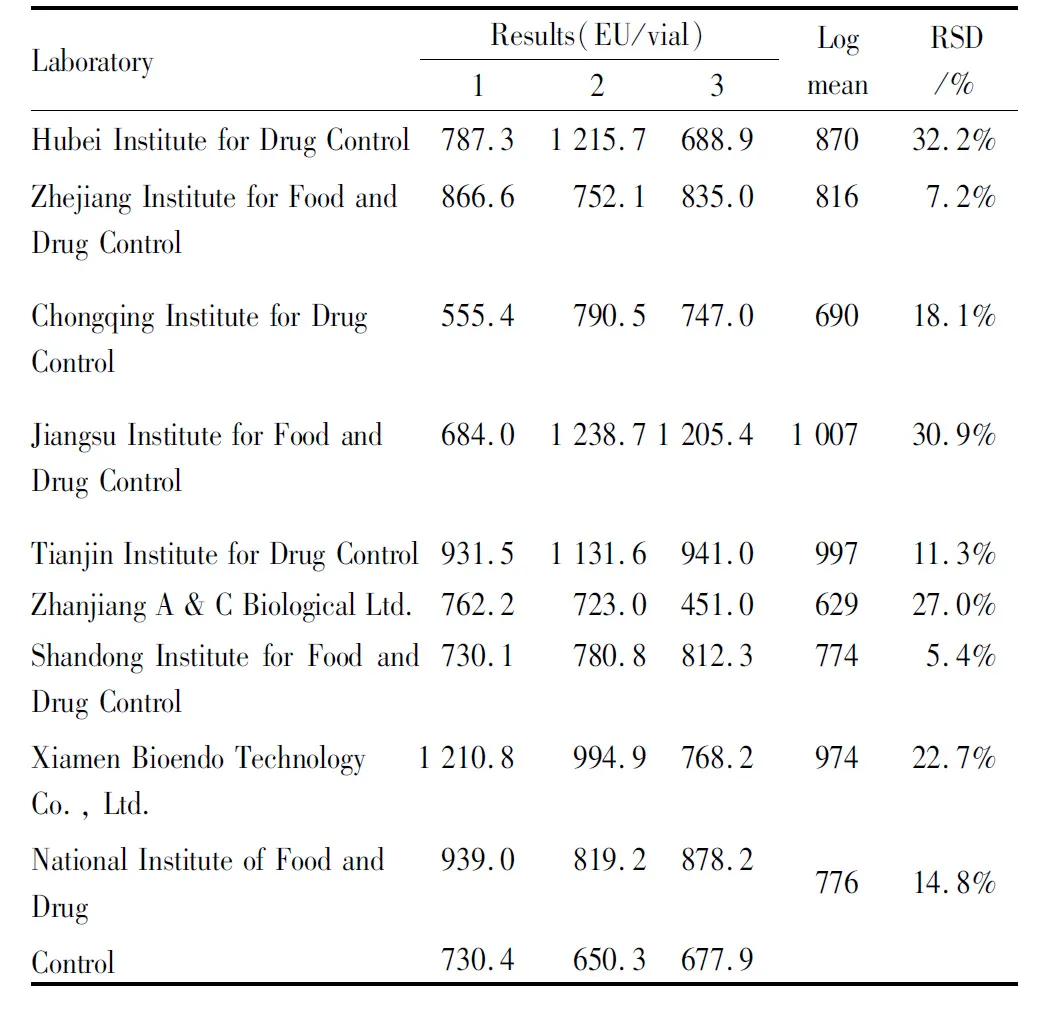
Tab 5 Results of kinetic turbidimetric assay of candidate A
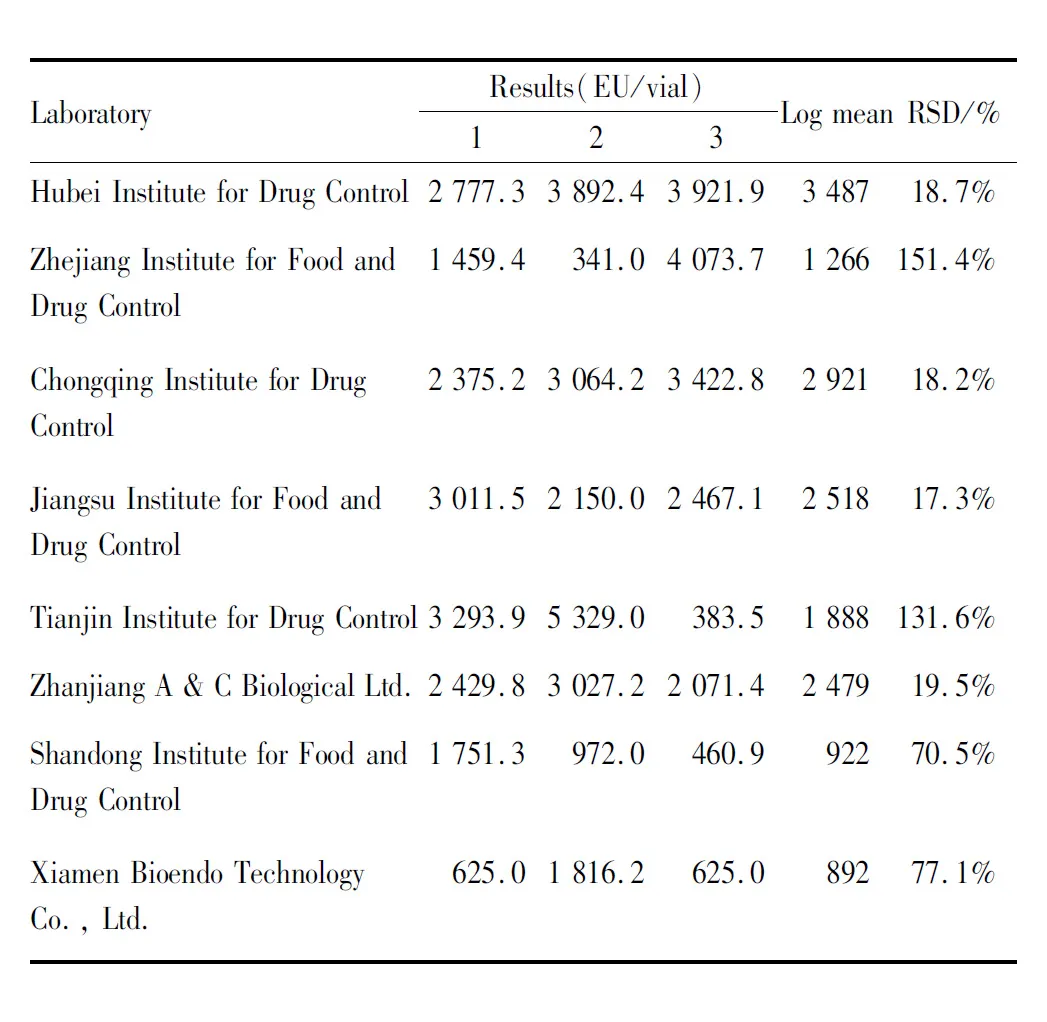
Tab 6 Results of kinetic turbidimetric assay of candidate B
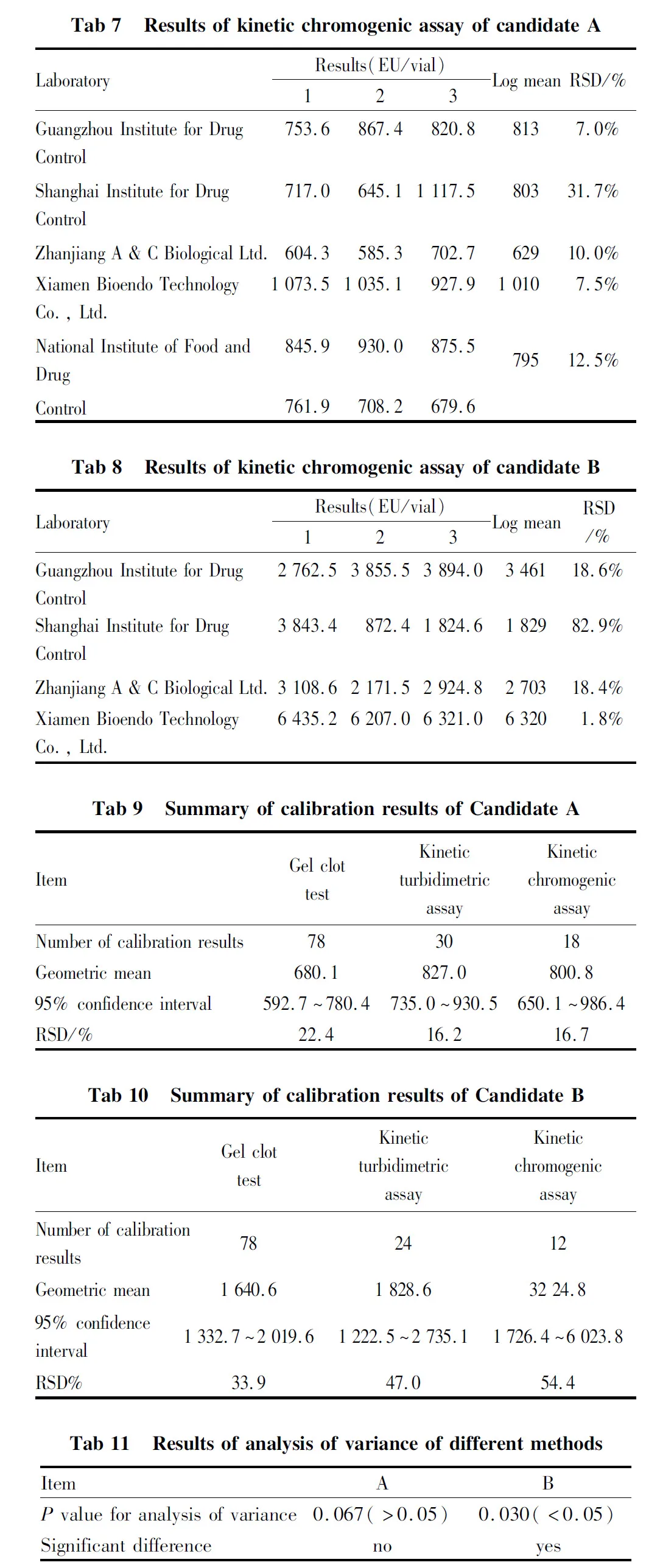
2.2 标定结果汇总统计分析按照细菌内毒素国家标准品的统计方法,经汇总统计、分析计算,标定结果见Tab 9,10。
为检验每批候选品3种方法标定的结果间差异有无显著性,是否能够合并计算,使用方差分析对3种标定方法的结果进行统计分析,结果见表11。
经检验,候选品B的3种方法的标定结果间差异均有显著性,候选品A的3种方法的标定结果间差异无显著性。
候选品B需使用卡方检验,对每种方法的权重进行校正,使用校正后的权重,对3种方法的结果进行加权平均,最终得到效价值和可信限率。候选品A可直接对3种方法的结果进行加权平均,得到效价值和可信限率。
2.3 效价定值按照细菌内毒素国家标准品统计方法计算,结果显示,候选品A的3种方法的标定结果间差异无显著性,可信限率最小。最终选择候选品A为细菌内毒素国家标准品(非水溶性样品用),并根据国际上内毒素标准品效价取整原则,将其效价定值为每支700 EU。

Tab 12 Potency and FL/%
2.4 标准品的均一性研究细菌内毒素国家标准品(非水溶性样品用)的使用方法为整支复溶后一次性使用。故符合瓶内均匀性较好的前提,可以使用简化法均匀性方差分析。方案为抽取12支样品,使用动态浊度法对其中11瓶测量一次计算,计算其方差作为其组间方差S1;其余1支样品重复测量4次,计算其方差作为组内偏差S2。每次测量均为2个平行孔。详见Tab 13。

Tab 13 Uniformity test results

2.5 非水溶性样品检测试验大豆油(供注射用)在建立细菌内毒素检查方法时,需要将细菌内毒素预先添加到大豆油中,通过回收试验检测出已知添加量的细菌内毒素,回收率结果应在50%~200%之间,而其他细菌内毒素国家标准品只能用水来复溶,复溶后添加到大豆油中会产生分层。若直接用大豆油溶解其他内毒素国家标准品则会出现浑浊,影响进一步实验。
使用本标准品进行试验,用0.5 mL大豆油溶解标准品,混匀时间不少于15 min,再进行稀释或者萃取等步骤,如采用加入等体积细菌内毒素检查用水,萃取15 min,静止取水相进行检测,其回收率在50%~200%,说明该萃取方法能将内毒素提取。
3 讨论
3.1 结果分析本次标定结果中,候选品B的RSD值非常高,最高达151.4%,表明支间差异很大。分析原因,是由于本标准品不能使用赋形剂造成的。在内毒素标准品制备冻干的生产过程中,赋形剂不仅起到使标准品成形的支架作用,还可以帮助内毒素在分装前的水溶液中分散更均匀、在冻干过程中减少升华损失,以上作用均可降低标准品冻干后的支间差异。但本标准品不能使用赋形剂,对分装、冻干工艺的要求比其他标准品高。从标定数据也可以看出,候选品A的RSD比候选品B小很多,说明其产品的支间差异较小,生产工艺的精度更好。
虽然无赋形剂的标准物质与有赋形剂标准物质比较,支间差异略大,但其可信区间在内毒素检测的可接受范围内(50%~200%),不会影响到内毒素检测的准确性。
3.2 应用性此批标准品不仅可用于新型制剂及其辅料的内毒素检测,其他非水溶性药品均可使用该标准物质制备供试品的阳性对照和内毒素的检测。故命名其为“细菌内毒素国家标准品(非水溶性样品用)”。为了避免与现有细菌内毒素国家标准品出现结果冲突,该标准品作为现有国家标准品在特殊情况无法使用时的补充。
以胆固醇(供注射用)为例:胆固醇在建立细菌内毒素检查方法时,无法将内毒素标准品直接添加到胆固醇中,需要用乙醇溶解胆固醇,用水溶解内毒素标准品,需要预先摸索合适的微量高浓度内毒素添加到胆固醇的乙醇溶液中,否则胆固醇或者乳糖会析出体系。使用本标准品进行试验,用胆固醇乙醇溶液直接溶解标准品,则直接完成了供试品阳性对照。
