miR-18a-3p在肝癌中的表达及其调控ADCY1表达对肝癌细胞侵袭及增殖的影响
2022-06-08彭婀敏欧阳锡武王文龙郑璐姚磊白宁
彭婀敏,欧阳锡武,王文龙,郑璐,姚磊,白宁
(1.中南大学湘雅公共卫生学院,湖南 长沙410078;中南大学湘雅医院2.国际医疗部3.普通外科,湖南 长沙 410008)
肝癌是世界上第2 位最常见恶性肿瘤[1-3]。在中国,其发病率及致死率分别位于第4 位及第2 位[4]。肝癌预后差,具有高转移率和复发率,大多数患者被诊断时已处于晚期,并且5年生存率通常低于15%[5]。因此,进一步探讨肝癌的复发及转移机制,寻找新的治疗靶点以提高肝癌的治疗效果,是临床医生所面临的重要问题。
microRNA(miRNA)是大小为17~25 个核苷酸的短RNA 分子,可通过转录后调控来抑制靶基因的表达。单个miRNA 可以靶向数百个mRNA,并影响通常参与功能相互作用途径的许多基因的表达。miRNA 已被证明与许多疾病的发病机制有关,并且参与众多肿瘤的发生、发展、转移及耐药等过程[6-12]。
腺苷酸环化酶1(adenylate cyclase 1,ADCY1)是ADCY 超家族的成员,其位于7p12.3,包含22 个外显子;蛋白质产物的分子量为130 kD。已有相关研究报道了ADCY1 在结肠癌[13]、黑色素瘤[14]、肺癌[15]、胰腺癌[16-17]等肿瘤中发挥重要作用,但尚未有研究报道其与肝癌发生发展与转移的联系。
本研究通过筛选并分析相关测序数据,证实了miR-18a-3p 在肝癌进展中发挥重要作用,并能通过转录后调控抑制下游ADCY1 基因的表达来增加肝癌细胞的侵袭及生长能力。
1 材料与方法
1.1 材料
1.1.1 细胞株 本研究中所使用正常肝组织细胞L-02、肝癌细胞SK-HEP-1、HA22T 均来自中科院上海细胞库,由本实验室保存。选取中南大学湘雅医院普通外科30 例肝癌患者的癌组织及癌旁组织作为临床标本,患者入院时均签署知情同意告知书。
1.1.2 主要试剂 TRIzol™Reagent、Lipofectamine™3000 试剂均购自Invitrogen 公司(美国);SYBR Green qPCR Mix、4×Reverse Transcription Master Mix均购自TaKaRa 公司(美国);8 μm Transwell 小室、6 孔盘、24 孔盘均购于Corning 公司(美国);DMEM 培养基购于Invitrogen 公司(美国),胎牛血清购于Gibco 公司(美国)。
1.2 方法
1.2.1 细胞培养 正常肝细胞L-02 使用1640 培养基进行培养、肝癌细胞SK-HEP-1、HA22T 使用DMEM培养基进行培养(加入10%胎牛血清、1%谷氨酰胺、1%青霉素-链霉素双抗),并置于含5%CO2的37 ℃细胞培养箱中进行培养。
1.2.2 Transwell 侵袭实验 将基底胶按1∶20 比例稀释后,每个transwell 小室加入100 μL,并置于37 ℃细胞培养箱中使其凝固。2 h 后,于上室加入150 μL 含100 000 个细胞的无血清培养基,下室加入含血清培养基,再放入37 ℃细胞培养箱中培养12~24 h。取出上室,进行清洗、固定、染色、显微镜下观察、拍照等。每组实验设置3 个副孔。
1.2.3 qRT-PCR 实验 TRIzol 试剂提取肝癌细胞总RNA,取2 μg 总RNA 进行逆转录。 使用Bio-Rad CFX96 系统进行实验, 计 算RNA (mRNA 和miRNA) 的表达。GAPDH (用 于mRNA) 或U6(用于miRNA)标准化数据,并通过ΔΔCt 值评估相对表达。 所有引物均购自Integrated DNA Technologies 公司(美国)。
1.2.4 MTT 增殖实验 用含10%胎小牛血清的培养液配成单个细胞悬液,以每孔1 000~10 000 个细胞接种到96 孔板,每孔体积200 μL。培养3~5 d后,每孔MTT 溶液(5 mg/mL 用PBS 配)20 μL 继续孵育4 h,终止培养,小心吸弃孔内培养上清液,对于悬浮细胞需要离心后再吸弃孔内培养上清液。每孔加150 μL DMSO,振荡10 min,使结晶物充分溶解。选择490 nm 波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.5 过表达miR-18a-3p 质粒的构建 过表达miR-520F-3p 采用pLV 慢病毒质粒作为载体,序列(上游: CGC GTA CTG CCC TAA GTG CTC CTT CTG GGT CGA CCC AGA AGG AGC ACT TAG GGC AGT TTT TTG, 下 游: CGC AAA AAA CTG CCC TAA GTG CTC CTT CTG GGT CGA CCC AGA AGG AGC ACT TAG GGC AGT A) 由 Integrated DNA Technologies 公司(美国)提供。新构建质粒经小提、酶切验证后再经大提扩增,然后经慢病毒包装、转染,形成稳定转染细胞后行下一步功能实验。
1.2.6 miR-18a-3p 抑制剂质粒构建及瞬转 miR-18a-3p 抑制剂质粒购买于Integrated DNA Technologies 公司(美国),具体序列为rCrCrA rGrArA rGrGrA rGrCrA rCrUrU rArGrG rGrCrA rGrU。瞬转具体步骤:⑴当肝癌细胞长至60%~80%汇合度时转染,6 孔板:贴壁细胞0.25~1×106;⑵使用无血清DMEM培养基稀释Lipofectamine™3000 试剂,充分混匀:无血清DMEM 培养基125 μL,Lipofectamine™3000试剂5 μL;⑶使用无血清DMEM 培养基稀释DNA,制备DNA 预混液,充分混匀:无血清DMEM 培养基125 μL,miR 抑制剂2.5 μg;⑷在每管已稀释的Lipofectamine™3000 试剂中加入稀释的miR 抑制剂(1∶1 比例):稀释的DNA 125 μL,稀释的Lipofectamine™3000 试剂125 μL;⑸孵育:室温孵育10~15 min;⑹加入DNA-脂质复合物至细胞中:每孔miR 抑制剂-脂质体复合物250 μL,miR 抑制剂2 500 ng,Lipofectamine™3000 试剂用量5 μL;⑺分析转染细胞37 ℃孵育细胞2~4 d,然后分析转染细胞。
1.2.7 ADCY1 的3'UTR 野生型和突变型质粒构建 根据Targetscan 网站(https://www.targetscan.org/vert_71) 对ADCY1 3'UTR 序列分析结果,发现ADCY1 3'UTR 共9 121 个碱基序列,为分析miR-18a-3p 对ADCY1 3'UTR 的调控功能,选取ADCY1 3'UTR 前2 200 个碱基序列构建野生型及突变型质粒。ADCY1 的3'UTR 采用psiCHECK-2 质粒为载体。野生型引物序列(上游:CAG TAA TTC TAG GCG ATC GCA GGA GCC CAC GTG GGC CTCT,下游:AGA TAT TTT ATT GCG GCC AGC CCC AGT AGC AGC GAG AGG CC);突变型引物序列(上游:CAG TAA TTC TAG GCG ATC GCA GGA GCC CAC GTG GGC CTCT,下游:AGA TAT TTT ATT GCG GCC AGC CAA AGT CTC CAG TGG GTC CA) 由Integrated DNA Technologies 公司(美国) 提供。新构建质粒经小提、酶切验证后再经大提扩增,然后经慢病毒包装、转染,形成稳定转染细胞后行下一步功能实验。
1.3 统计学处理
采用SPSS 22.0 统计软件对本研究数据进行统计学分析,计量资料采用均数±标准差(±s)表示,应用单因素方差分析和LSD-t检验比较两组间各指标水平差异,P<0.05 为差异有统计学意义。
2 结 果
2.1 同时在肝癌组织及血清/血浆中都差异表达的miRNA筛选并验证
首先,从已发表[18]的在肝癌肿瘤组织及血清/血浆中都差异表达的miRNA(与正常组织/血液标本相比)中筛选出同时在癌组织及肝癌患者血清/血浆中均差异表达的miRNA 共6 个(4 个上调:miR-18a-3p、miR-221-3p、miR-222-3p、miR-224-3p;2 个下调:miR-26a-3p、miR-125b-3p)(图1A)。然后用qRT-PCR 实验验证了这些miRNA 在细胞中的表达情况,结果提示,与正常肝细胞相比,miR-18-3p 在肝癌细胞中表达上调,miR-26a-3p 在肝癌细胞中表达下调(图1B-C)。
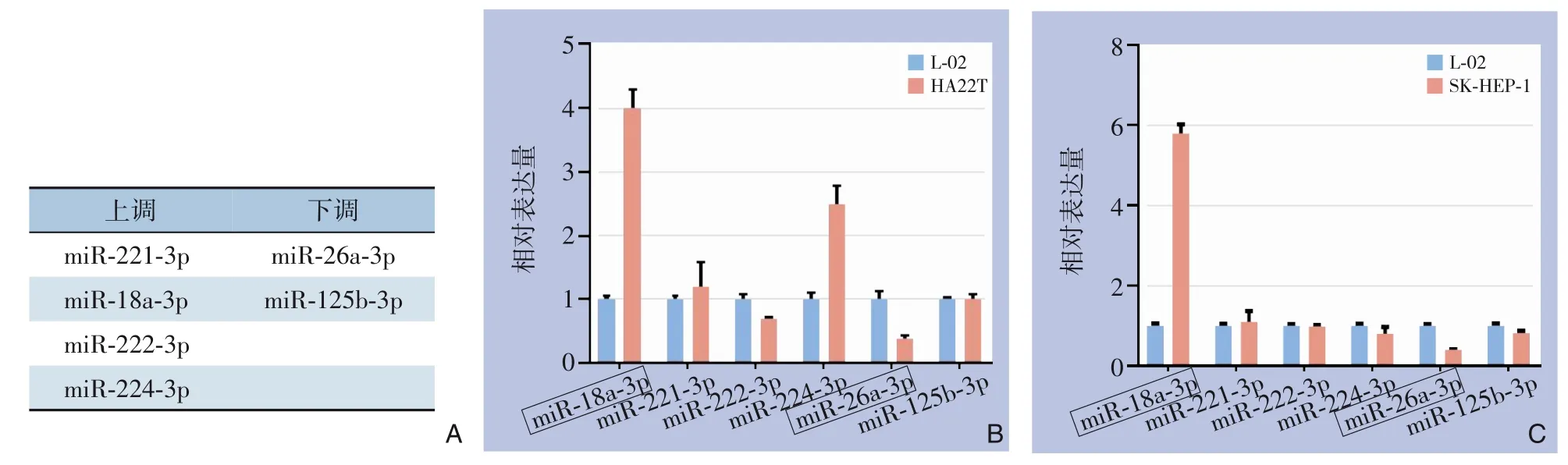
图1 差异表达miRNA筛选及验证 A:从已发表文章中筛选出肝癌中差异表达的6个miRNA;B:6个miRNA在正常肝细胞L-02及肝癌细胞HA22T中的表达情况;C:6个miRNA在正常肝细胞L-02及肝癌细胞SK-HEP-1中的表达情况Figure 1 Screening and validation of the differentially-expressed miRNAs A: Six miRNAs screened out from the published studies; B: Expression of 6 miRNAs in normal hepatic L-02 cells and liver cancer HA22T cells; C: Expression of 6 miRNAs in normal hepatic L-02 cells and liver cancer SK-HEP-1 cells
2.2 miR-18a-3p 与miR-26a-3p 对肝癌细胞的侵袭及增殖能力的影响
过表达miR-18a-3p/miR-18a-3p 抑制剂能明显促进/抑制肝癌细胞的侵袭及增殖能力(均P<0.05)(图2A-D),而过表达miR-26a-3p/miR-26a-3p 抑制剂无法得到一致性结果(图2E-H)。
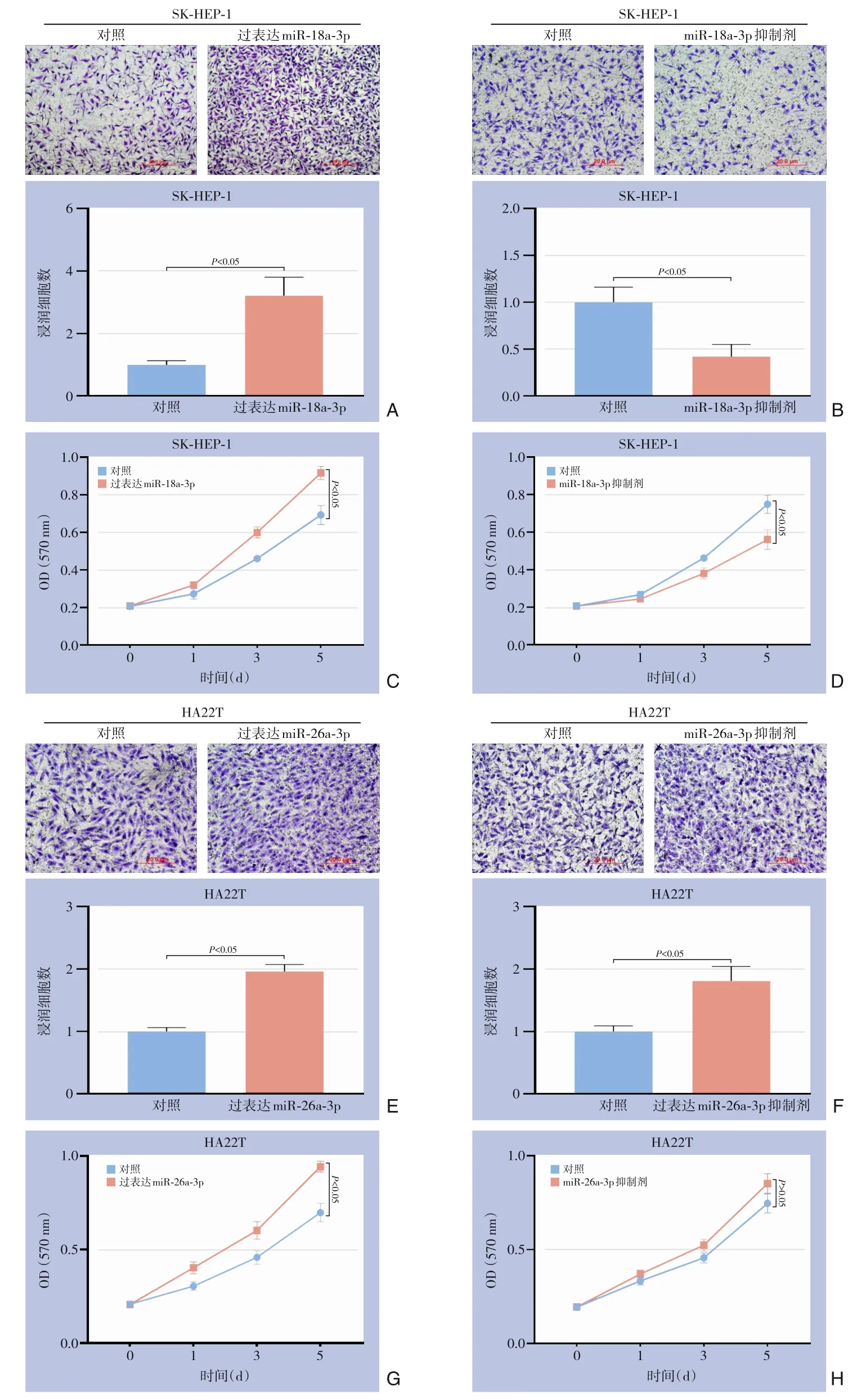
图2 miR-18a-3p、miR-26a-3p对肝癌细胞侵袭及增殖能力的影响 A-B:过表达miR-18a-3p/抑制miR-18a-3p后肝癌细胞侵袭能力的变化;C-D:过表达miR-18a-3p/抑制miR-18a-3p 后肝癌细胞增殖能力的变化;E-F:过表达miR-26a-3p/miR-26a-3p 抑制剂后肝癌细胞侵袭能力的变化;G-H:过表达miR-26a-3p/miR-26a-3p 抑制剂后肝癌细胞增殖能力的变化Figure 2 Influences of miR-18a-3p and miR-26a-3p on invasion and proliferation abilities of liver cancer cells A-B:Changes in invasion ability of liver cancer cells after overexpression miR-18a-3p/miR-18a-3p inhibitor; C-D: Changes in proliferation ability of liver cancer cells after overexpression miR-18a-3p/miR-18a-3p inhibitor; E-F: Changes in invasion ability of liver cancer cells after miR-26a-3p overexpression/miR-26a-3p inhibiton; G-H: Changes in proliferation ability of liver cancer cells after miR-26a-3p overexpression/miR-26a-3p inhibiton
2.3 临床组织样本检验miR-18a-3p 的表达及miR-18a的表达与肝癌的生存关系
在30 例肝癌患者的癌和癌旁组织标本中检验了miR-18a-3p 的表达情况,结果显示肝癌组织中miR-18a-3p 的表达明显高于癌旁组织(P<0.01)(图3A)。 同时,通过KM plotter 网站(http://kmplot.com)分析了miR-18a 的表达与肝癌的生存关系,结果表明,miR-18a 表达越高,肝癌患者的生存预后越差(P=0.001 9)(图3B)。
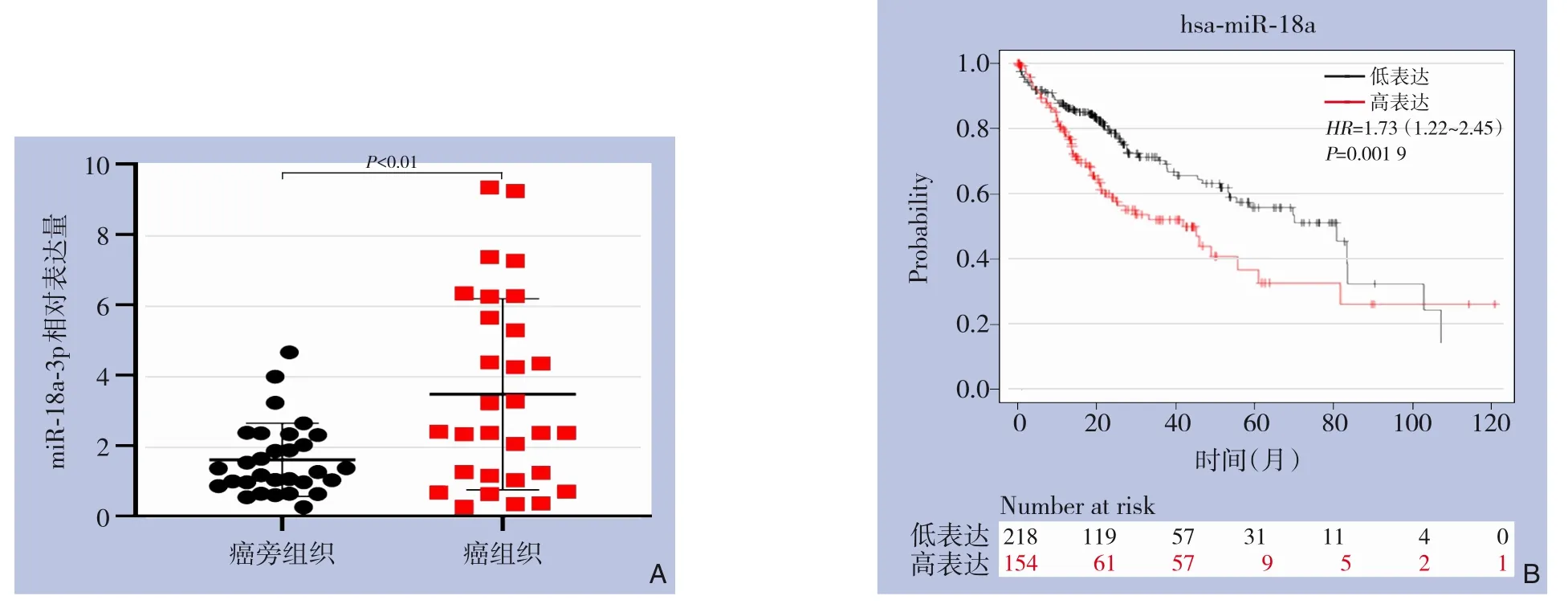
图3 组织标本验证miR-18a-3p的表达及miR-18a的表达与肝癌患者的生存关系 A:30对临床标本中miR-18a-3p的表达情况;B:KM plotter网站分析miR-18a的表达与肝癌的生存关系Figure 3 Validation of miR-18a-3p expression in tissue samples and relationship between miR-18a expression and survival of liver cancer patients A: The miR-18a-3p expressions in 30 paired clinical specimens; B:Analysis of the relationship between miR-18a expression and survival of liver cancer patients using KM plotter website
2.4 miR-18a-3p靶基因分析及逆转实验验证
为了进一步研究miR-18a 调控肝癌进展的具体机制,通过miRDB 网站(http://mirdb.org/) 预测能被miR-18a-3p 靶向调控的下游基因,并选取其中得分>95 分的基因(SNX8、FNDC5、EFNA1、ZBBX、ADCY1、PDP1)(图4A)。然后,通过GEPIA 数据库分析以上6 个基因在肝癌组织及癌旁组织中的表达情况,结果显示SNX8 在肝癌组织中表达升高,ADCY1 在肝癌组织中表达明显降低(图4B)。由于通常miRNA 能够通过转录后调控来抑制下游基因的表达, 因此推测miR-18a-3p 可能通过调控ADCY1 的表达来调节肝癌细胞的侵袭及增殖能力。逆转实验结果显示,过表达ADCY1 能部分逆转miR-18a-3p 对肝癌的调控作用(图4C-D)。

图4 miR-18a-3p与ADCY1的关系分析 A:miRDB网站预测能被miR-18a-3p靶向调控的6个下游基因;B:GEPIA数据库分析以上6个基因在肝癌组织及癌旁组织中的表达情况;C-D:同时过表达miR-18a-3p及ADCY1后检测肝癌细胞的侵袭及增殖能力Figure 4 Analysis of relationship between miR-18a-3p and ADCY1 A:The 6 downstream genes potentially regulated by miR-18a-3p predicted by miRDB website; B:Analysis the expressions of the 6 genes in liver cancer and adjacent tissues using GEPIA database; C-D: Invasion and proliferation abilities of liver cancer cells after co-overexpression of miR-18a-3p and ADCY1
2.5 miR-18a-3p与ADCY1 mRNA的关系分析
为研究miR-18a-3p 调控ADCY1 的机制,预测ADCY1 mRNA 3'UTR 前2 200 bp 区域能与miR-18a-3p结合的靶点,并构建相应的野生型和突变型质粒(图5A)。双荧光素酶报告实验结果表明,过表达miR-18a-3p/miR-18a-3p 抑制剂能降低/增加转染野生型ADCY1 3'UTR 肝癌细胞的荧光素酶活性,而对转染突变型质粒的细胞无明显影响。由此表明miR-18a-3p 能通过直接结合到ADCY1 mRNA 3'UTR区域转录后调控ADCY1 的表达(图5B)。

图5 双荧光素酶报告实验 A:miR-18a-3p与ADCY1结合位点的模式图及野生型、突变型质粒构建原理;B:转染野生型或突变型质粒后肝癌细胞的荧光素酶活性Figure 5 Dual-luciferase reporter assay A: Pattern of the binding site between miR-18a-3p and ADCY1, and construction principle of the wild-type and mutant-type plasmids;B:Luciferase activities of the liver cancer cells after transfection with wild-type and mutant-type plasmids
3 讨 论
全世界每年有超过850 000 例诊断为肝癌的患者[19],肝癌目前是全球癌症相关死亡的第二大原因,并且这一数字还在逐年上升[20]。在所有原发性肝癌中,肝细胞癌(HCC)是原发性肝癌最常见的类型,约占所有病例的90%[19,21-22]。肝癌的预后差,具有高转移率和复发率,且5年生存率低。肝癌治疗领域的特点是多学科参与、多种治疗方法共存,常见治疗方法包括肝切除术、肝移植术、消融治疗、TACE、放射治疗、系统抗肿瘤治疗等多种手段,不同分期的肝癌患者选择合理的治疗方法可以使疗效最大化[23]。目前肝癌的研究致力于寻找肝癌新的治疗靶点,开发治疗新策略,这对于那些手术治疗效果欠佳或相关抗肿瘤药物治疗效果不好的患者尤为重要。本研究探讨了肝癌进展的新的分子信号通路,对肝癌新治疗靶点的开发、增加肝癌治疗效果、促进肝癌患者预后提供了理论支撑。
非编码RNA 已经被证实在多种疾病发生、发展、转移及耐药过程中发挥重要作用[24],miRNA正是其中一种起重要作用的非编码RNA。miRNA的定义基于它们在Dicer 的作用下生成,Dicer 是一种核糖核酸酶,可将发夹结构的前体(称为premiRNA)加工成成熟的miRNA[25]。miRNA 通过识别目标mRNA 的3'UTR 中的互补目标位点,在转录后抑制基因表达。miRNA 已经被证实可以参与多种生物学进程,包括肿瘤的发生、发展及转移。Wei等[26]报道miR-223 可以抑制FOXO1 的表达,并可作为乳腺癌的潜在的肿瘤标志物。Liu 等[27]研究表明来源于巨噬细胞的miR-92a-2-5p 能够通过外泌体转运到肝癌细胞并促进肝癌进展。Chen 等[28]报道miR-206 可以通过靶向调节ZEB2 的表达来影响肾透明细胞癌细胞的生长。以上研究都表明miRNA 在肿瘤的生物学行为中发挥重要作用,并可作为多种肿瘤的生物标记物。本研究通过收集肝癌相关miRNA 的统计数据,并通过相关实验证实了miR-18a-3p 在肝癌细胞及组织中表达上调,并能促进肝癌细胞的生长及迁移能力还能通过调控下游基因ADCY1 的表达来影响肝癌细胞的侵袭及增殖能力,从理论水平进一步证实了miRNA 在肝癌中发挥重要作用,并为寻找肝癌诊治的新靶标提供了实验基础。
ADCY1 是ADCY 超家族的成员, 它位于7p12.3,包含22 个外显子;其蛋白质产物的分子量为130 kD。ADCY1 主要表达于脑、睾丸、甲状腺、肝脏、前列腺、子宫内膜、心脏等组织器官。已有相关研究报道了ADCY1 在许多疾病中发挥重要作用。研究[29]表明ADCY1 与黑色素瘤患者的总生存期显著相关,并在黑色素瘤的转移中起重要作用。此外,有研究[30]报道ADCY1 在非小细胞肺癌中高表达,并与其患者的预后相关。Ma 等[31]报道了ADCY1 在胶质母细胞瘤中高甲基化并与恶性胶质瘤患者的生存时间相关。目前尚未有研究报道ADCY1 在肝癌中的作用机制。本研究通过miR-18a-3p 预测了ADCY1 可能是其作用的靶基因,并通过相关数据库证实了ADCY1 在肝癌组织中表达明显下调,相关功能实验证实ADCY1 能抑制肝癌的生长及侵袭能力,逆转实验表明过表达ADCY1 能够部分逆转过表达miR-18a-3p 对肝癌生长及侵袭能力的影响,进一步证实miR-18a-3p 可以通过ADCY1发挥调节作用,双荧光素酶实验也验证了miR-18a-3p 通过结合到ADCY1 mRNA 3'UTR,转录后调控ADCY1 而抑制ADCY1 的表达。由此,本研究从多方面证实了ADCY1 可以在miR-18a-3p 的调节下影响肝癌的进展,进一步表明ADCY1 可以作为肝癌诊治的潜在标志物。
miR-18a-3p 在肝癌组织及细胞中高表达,并可通过转录后调控抑制下游ADCY1 基因的表达,以此促进肝癌细胞的侵袭及增殖能力。本研究结果可为寻找肝癌治疗的新靶点提供实验基础。
利益冲突:所有作者均声明不存在利益冲突。
