低分子透明质酸片段对红细胞聚集诱发作用及其种属特异性
2022-06-08郭田田王家麒贾潇潇LAZCANOSILVEIRARaykoHUISHOFAROJessica王凤舞马泽芳惠觅宙
郭田田,王家麒,贾潇潇,LAZCANO SILVEIRA Rayko,HUI SHOFARO Jessica,王凤舞,马泽芳,惠觅宙
(青岛农业大学动物科技学院,山东青岛 266109)
目前,对透明质酸的结构、理化性质和生理功能的研究已经较为充分,其在医药和临床上的应用也日益广泛。大量研究表明,透明质酸的部分生物活性与其分子量的大小有密切关系[1]。近年来,透明质酸片段广泛的应用前景已经引起了国内外研究者的广泛关注[2-20],逐渐成为透明质酸研究的热点。因此大规模生产透明质酸片段是进一步研究的前提,意义重大,值得深入研究。
分子量大小不同的透明质酸和透明质酸片段与人体多种受体相互作用,包括淋巴管内皮透明质酸受体(Lymphatic Vessel Endothelial Hyaluronic Acid Receptor 1,LYVE-1)、CD44、透明质酸介导运动性受体(Hyaluronanmediated Motility Receptor,RHAMM)、免疫球蛋白样凝集素(Sialic Acid-binding Immunoglobulin-type Lectins 9,SIGLEC-9)、Toll样受体2(Toll-like Receptor 2,TLR2)、透明质酸内吞受体(Hyaluronan Receptor for Endocytosis,HARE)、细胞迁移诱导与透明质酸结合蛋白(Cell Migration-inducing and Hyaluronanbinding Protein,CEMIP)和跨膜蛋白2(Transmembrane Protein 2,TMEM2)。透明质酸和透明质酸片段参与调节白细胞(包括中性粒细胞、巨噬细胞、DC细胞、T细胞、B 细胞)迁移[21-22]和白细胞(包括中性粒细胞、巨噬细胞、DC细胞、T细胞、B细胞和小胶质细胞)炎症因子分泌[23-24]。作为受体之一的CD44是一种分布广泛的跨膜糖蛋白,介导细胞与细胞之间、细胞与细胞外基质之间的吸附作用,其肽链的N端可以和HA结合。红细胞作为血液循环中最多的细胞群体,自身具有识别和结合抗原物质、参与免疫反应的作用,失去细胞核的成熟红细胞表面依旧保持CD44蛋白的高表达[25]。CD44在机体正常生理和病理生理的状态下,绝不仅仅是单纯的存在[26-29]。
因此,本研究利用重组人透明质酸酶PH20,制备了一种人体组织渗透性好的平均分子量35 kDa的透明质酸片段HA35注射液,并以HA35注射液和不同分子量透明质酸片段为研究对象,探索两者与人和不同种属动物红细胞之间的相互作用,为HA35注射液在临床应用方面提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 主要试剂
中国仓鼠卵巢细胞CHO-S和pMH3表达载体质粒由绍兴惠荟生物科技有限公司提供;注射级平均分子量1 600 kDa透明质酸原料、普通平均分子量300 kDa透明质酸原料和平均分子量24 kDa透明质酸片段购自华熙福瑞达生物医药有限公司;平均分子量60 kDa透明质酸片段购自丽阳生物科技有限公司;anti-human CD44 antibody、anti-dog antibody、anti-mouse CD44 antibody、non-specific rabbit IgG、non-specific dog IgG、non-specific mouse IgG购自Abcam公司(英国);琼脂糖(Agarose)购自北京索莱宝科技有限公司。
1.1.2 主要仪器
酶解反应器(杭州安普生物工程有限公司)、渗透压摩尔浓度测定仪(天河医疗仪器有限公司)、激流式动物细胞反应器(杭州安普生物工程有限公司);重组人透明质酸酶PH20纯化用QFF层析柱、Phenyl HP疏水层析柱、CHT I型陶瓷羟基磷灰石层析柱、SP HP阳离子交换层析柱由军事医学科学院生物工程研究所提供;黑背景2016型显微镜(哈尔滨康邦黑背景光学仪器有限公司);电泳仪(美国Bio-Rad公司);恒温摇床(天津市莱玻特瑞仪器设备有限公司)。
1.1.3 血样
人静脉血:健康志愿者共12人,年龄(24±4)岁,静脉采血经长春嘉和外科医院医学伦理委员会批准和本人同意。
动物静脉血:比格犬、BALB/c小鼠、内蒙古山羊、内蒙古黄牛、迷你猪、美洲羊驼、蒙古马、红颜白水貂、恒河猴和田园猫的静脉血由青岛农业大学动物医院提供。动物静脉采血经青岛农业大学动物伦理委员会批准。
1.2 人重组透明质酸酶PH20的生产
以RISHTON等[30]中记载的方法为基础,将人工合成重组人透明质酸酶PH20的cDNA插入富含GC的pMH3载体,构建pMH3-PH20表达载体;再将pMH3-PH20表达载体转入CHO-S细胞系,筛选高表达PH20的CHO-S细胞系,并在激流式动物细胞反应器进行放大和大规模培养;将含有PH20的丰收液经0.22 μm滤膜过滤后经QFF层析柱、Phenyl HP疏水层析柱、CHT I型陶瓷羟基磷灰石层析柱和SP HP阳离子交换层析柱4步纯化,再经0.22 μm滤膜过滤后制成纯度大于98.5%的无菌的有糖化的重组人透明质酸酶PH20[31-32]。
1.3 低分子量透明质酸片段的制备
1.3.1 使用重组人透明质酸酶PH20制备
取1支离心管加入10 mL超纯水,分多次加入1 600 kDa透明质酸原料200 mg,反复震荡混匀,直至透明质酸全部溶于水;按表1加入MgCl2、NaCl调节渗透压,反复混匀;加入人PH20(27 000 U/mL)至终浓度为20 000 U/g。置于37 ℃摇床,于处理后8 min、16 min、24 min、32 min、40 min、48 min、56 min、64 min取降解产物1 mL于离心管中,取完的样品标记后迅速置于-20 ℃冰箱。

表1 人重组透明质酸酶PH20酶解透明质酸原料的反应体系
1.3.2 使用牛睾丸透明质酸酶PH20制备
取1支离心管加入10 mL超纯水,分多次加入1 600 kDa透明质酸原料200 mg,反复震荡混匀,直至透明质酸全部溶于水;按表2加入MgCl2、NaCl调节渗透压,反复混匀;加入牛PH20(1 500 U/mL)至终浓度为20 000 U/g;置于37 ℃摇床,于处理后1 h、2 h、3 h、4 h、5 h、6 h取降解产物1 mL于离心管中,取完的样品标记后迅速置于-20 ℃冰箱。

表2 牛睾丸透明质酸酶PH20酶解透明质酸原料的反应体系
1.3.3 琼脂糖凝胶电泳法测定透明质酸片段的分子量
将全部样品置于95 ℃的水浴锅内加热45 min,使残留透明质酸酶失活,将加热完成的全部样品置于4 ℃冰箱。取0.3 g琼脂糖溶于30 mL TBE溶液中,微波炉中加热沸腾3次以上,稍冷却倒入插有制胶梳的制胶板中,待胶冷却凝固。取15 μL标准品加入45 μL超纯水制备标准品溶液,取5 μL待测样品加入15 μL超纯水制备样品溶液,标准品和样品终浓度均为5 mg/mL。标准品和样品分别与上样buffer按4∶1比例混匀。将制备好的凝胶板置于含1×TBE的电泳槽中,每个胶孔里按顺序各加入20 μL的标准品和样品,人PH20降解样品电泳20 min,牛PH20降解样品电泳1 h,电压均为80 V。
1.3.4 GPC-MALLS法测定HA35的分子量及分子量分布
采用GPC-MALLS在线检测方法分析样品的分子量。(1)色谱条件:仪器,高效液相色谱仪(配示差检测器);Shodex SB-804 HQ凝胶柱(Φ8 mm×300 mm);流动相,0.02%叠氮钠水溶液;流速,1 mL/min;进样量,100 μL;温度,40 ℃;检测器,示差检测器、十八角激光散射检测器。(2)样品相对分子质量测定:称取适量样品,用流动相溶解配成1 mg/mL样品溶液,用0.22 μm滤器过滤后进样,进行高效液相分析。(3)分子质量分布检测采用示差检测器和激光检测器,分别记录供试品质量浓度和供试品在不同角度的光散射强度,折光指数增加量(dn/dc)值为0.138,通过数据处理软件ASTRA获取供试样品的分子质量分布图。
1.4 红细胞钱串状凝集研究
使用表3中不同分子量的透明质酸与人、小鼠、比格犬、羊、牛、猪、羊驼、马、水貂、猴和猫的静脉血混合至终浓度分别为12 mg/mL、6 mg/mL、3 mg/mL、1.5 mg/mL、0.75 mg/mL、0.375 mg/mL。制备红细胞涂片,显微镜下观察不同分子量的HA引发的红细胞钱串状聚集情况,得出其诱发人、小鼠、比格犬、羊、牛、猪、羊驼、马、水貂、猴和猫的红细胞钱串状聚集的最低浓度。
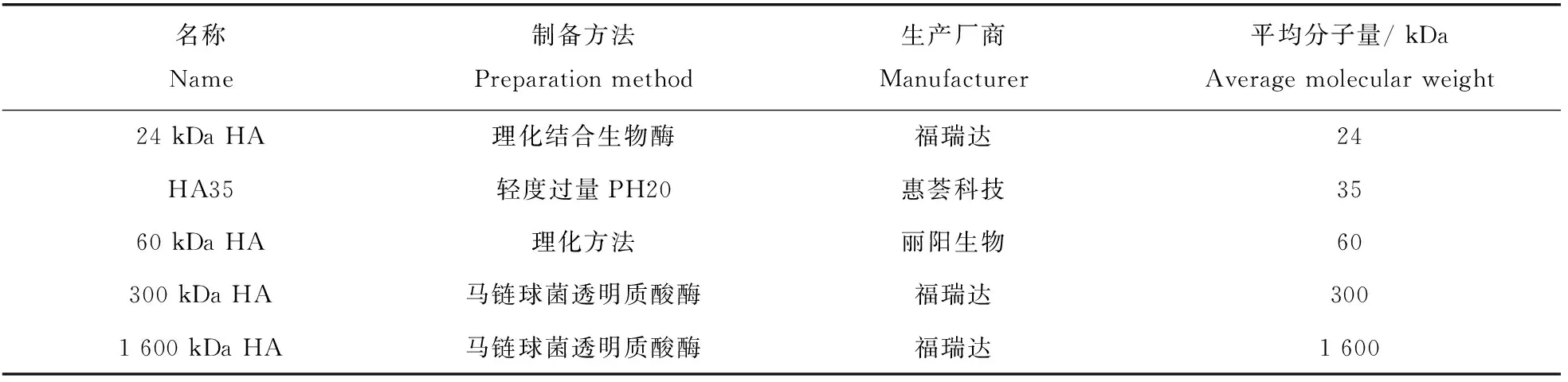
表3 不同分子量的透明质酸和透明质酸片段
1.5 红细胞钱串状凝集的CD44阻断研究
使用分子量为35 kDa的HA35分别与人、小鼠、比格犬的静脉血混合至终浓度为1.5 mg/mL,制备红细胞涂片,显微镜下观察和验证HA35引发的红细胞钱串状聚集。进一步使用CD44抗体、非特异性IgG抗体、人PH20(27 000 U/mL)与人、小鼠、比格犬的静脉血混合,终浓度分别为CD44抗体10 μg/mL、IgG抗体10 μg/mL、人PH20 1 927 U/mL。37 ℃孵育25 min,再加入HA35至浓度1.5 mg/mL。制备红细胞涂片,显微镜下观察红细胞钱串状聚集程度。
1.6 红细胞沉降试验
HA35与新鲜采集的人、比格犬、小鼠静脉血混合至终浓度分别为1.5 mg/mL、1.1 mg/mL、0.75 mg/mL,吸取400 μL混合血液至血沉管中,静置25 min,记录血沉管中血红细胞的沉降率。
2 结果与分析
2.1 低分子量透明质酸片段的分子量测定
2.1.1 琼脂糖凝胶电泳法检测HA35的分子量
图1结果显示琼脂糖凝胶电泳的全部条带都处于同一水平位置,表明20 000 U/g的人重组透明质酸酶PH20酶切效果非常强,作用8 min就已经产生了酶切,而且切割制备的35 kDa透明质酸片段HA35分子量差异非常小。
图2结果显示琼脂糖凝胶电泳条带参差不齐,第4、5、6条带明显比第1、2、3条带远,说明牛透明质酸酶PH20切割制备的HA35分子量随时间延长变小。

条带1: 8 min;条带2: 16 min;条带3: 24 min;条带4: 32 min;条带5: 40 min;条带6: 48 min;条带7: 56 min;条带8: 64 min;条带9: 10 kDa透明质酸标准品;条带10: 50 kDa透明质酸标准品
图1和图2相比,图2中第1、2、3条带和图1中条带位置相同,说明相同浓度下,人PH20切割8 min和牛PH20切割1 h产生的透明质酸片段分子量相同,表明相同条件下,人重组透明质酸酶PH20比牛睾丸透明质酸酶PH20切割效果更快更好。

条带1: 1 h;条带2: 2 h;条带3: 3 h;条带4: 4 h;条带5: 5 h;条带6: 6 h;条带7: 10 kDa透明质酸标准品;条带8: 50 kDa透明质酸标准品
2.1.2 GPC-MALLS法测定HA35的分子量及分子量分布
选取6次人PH20制备的不同批次HA35样品,使用GPC-MALLS测定平均分子量。如表4所示,结果表明6个HA35样品的平均分子量为(35±8)kDa,其批间变异系数CV=22%。

表4 GPC-MALLS测定的6个HA35样品的平均分子量
分子量分布结果如表5所示,(92.75±2.42)%的HA35分布在10~70 kDa之间,其分布范围相对较小,表明生产方法比较稳定可靠。

表5 GPC-MALLS测定的6个HA35样品的分子量分布
2.2 红细胞钱串状凝集及CD44阻断结果
如图3、图4、图5所示,HA35与人、犬、小鼠红细胞作用发生钱串状聚集(图3A、图4A、图5A),加入CD44抗体即可解除这种作用(图3B、图4B、图5B),而加入Ig抗体并不能解除这种作用(图3C、图4C、图5C)。CD44蛋白是红细胞表面表达量最多的免疫分子,也是HA的主要受体。因此,以上结果表明HA35可诱发人和动物的红细胞钱串状聚集,并且该现象是由红细胞表面的受体CD44介导的。

图3 HA35诱导人红细胞钱串状聚集

图4 HA35诱导比格犬红细胞钱串状聚集

图5 HA35诱导小鼠红细胞钱串状聚集
2.3 HA35和不同分子量透明质酸片段诱发红细胞聚集与分子量的关系
不同分子量透明质酸片段(包括HA35)诱发人、比格犬、BALB/c鼠、迷你猪、田园猫、美洲羊驼、蒙古马、红颜白水貂的红细胞钱串状聚集的最低浓度与其分子量大小呈负相关关系(图6,表6~13)。例如,明显诱发红细胞钱串状凝集的平均分子量24 kDa的透明质酸片段的最低浓度是6 mg/mL,明显诱发红细胞钱串状凝集的平均分子量35 kDa的透明质酸片段的最低浓度是1.5 mg/mL,而明显诱发红细胞钱串状凝集的平均分子量60 kDa的透明质酸片段的最低浓度是0.375 mg/mL。这一负相关关系可被用来检测低分子量透明质酸片段(包括HA35)的分子量,经验证此方法灵敏可靠。

图6 诱发人、比格犬、小鼠、猪、猫、羊驼、马、水貂红细胞钱串状聚集的透明质酸和透明质酸片段的最低浓度和分子量之间的负相关曲线

表6 不同透明质酸和透明质酸片段诱发人红细胞钱串状聚集的终浓度

表7 不同透明质酸和透明质酸片段诱发比格犬红细胞钱串状聚集的终浓度

表8 不同透明质酸和透明质酸片段诱发小鼠红细胞钱串状聚集的终浓度
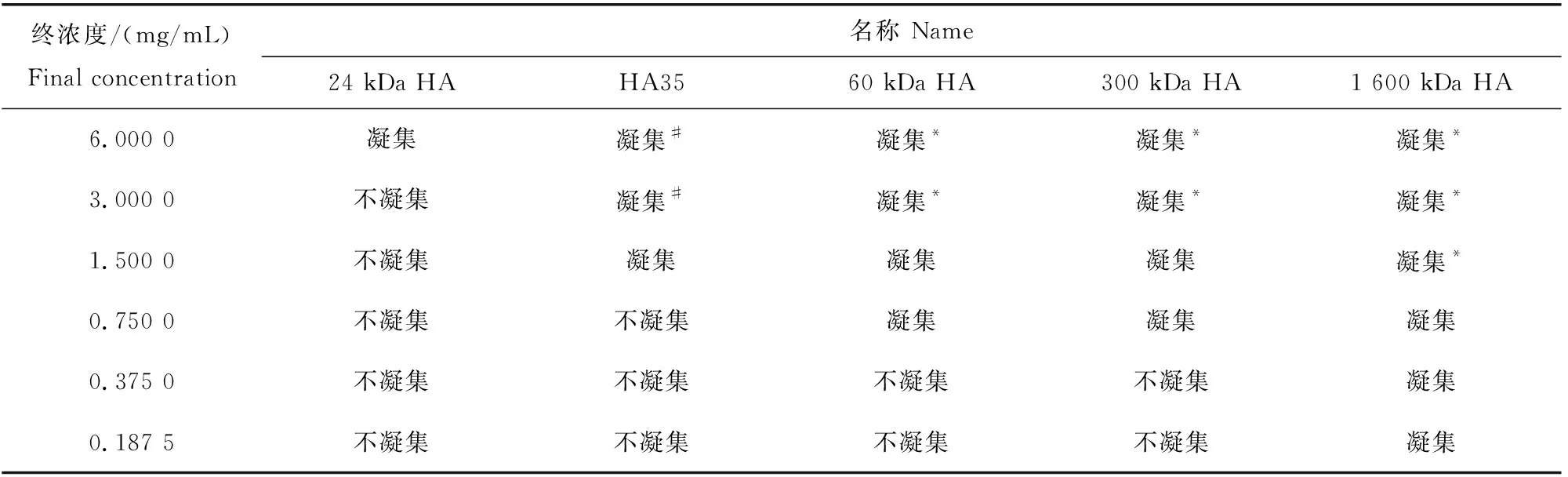
表9 不同透明质酸和透明质酸片段诱发猪红细胞钱串状聚集的终浓度

表10 不同透明质酸和透明质酸片段诱发猫红细胞钱串状聚集的终浓度
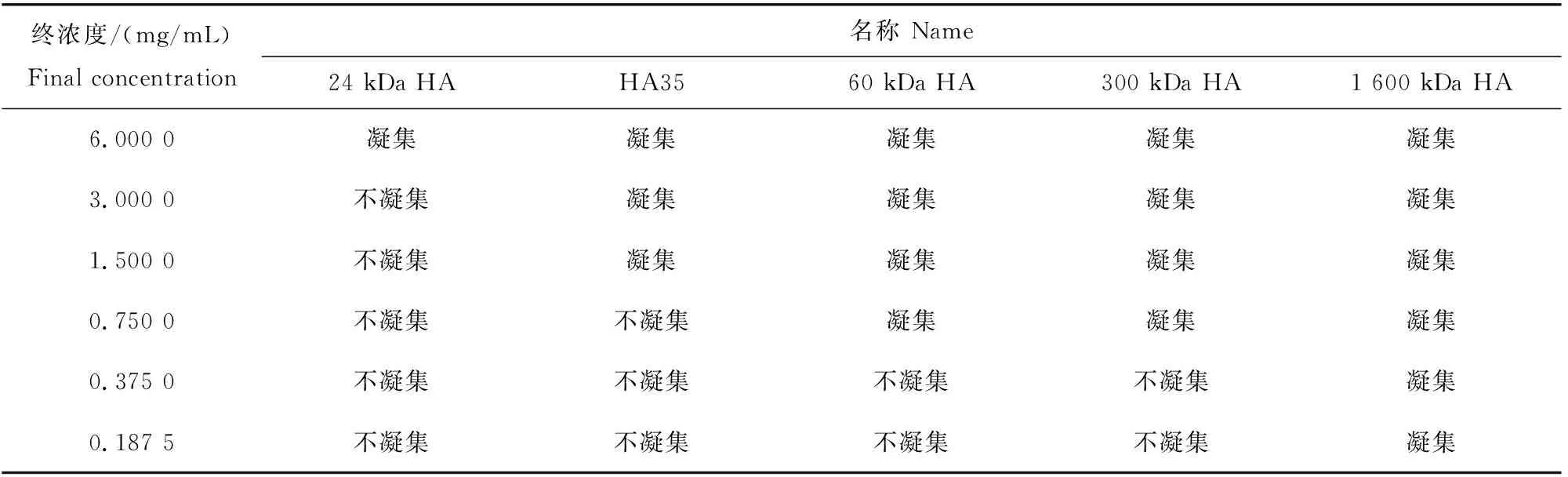
表11 不同透明质酸和透明质酸片段诱发羊驼红细胞钱串状聚集的终浓度

表12 不同透明质酸和透明质酸片段诱发马红细胞钱串状聚集的终浓度

表13 不同透明质酸和透明质酸片段诱发水貂红细胞钱串状聚集的终浓度
2.4 低分子量透明质酸片段诱发红细胞聚集的种属特异性
本研究另选取羊、牛、恒河猴作为研究对象,以研究低分子量透明质酸片段(包括HA35)在不同种属动物中诱发红细胞聚集是否存在差异。结果显示低分子量透明质酸片段不诱发羊、牛、恒河猴红细胞聚集(表14~表16),提示低分子量透明质酸片段(包括HA35)对人和不同动物的生理作用和使用剂量不同。

表14 不同透明质酸和透明质酸片段诱发羊红细胞钱串状聚集的终浓度
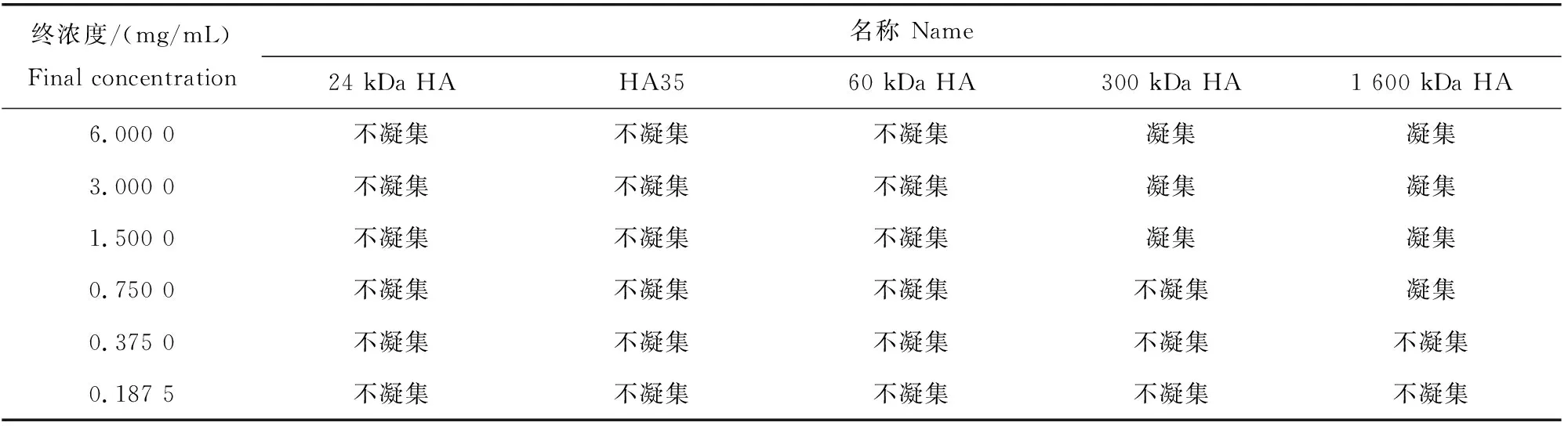
表15 不同透明质酸和透明质酸片段诱发牛红细胞钱串状聚集的终浓度

表16 不同透明质酸和透明质酸片段诱发猴红细胞钱串状聚集的终浓度
2.5 低分子量透明质酸片段影响红细胞沉降
通过使用人、比格犬、小鼠的静脉血与HA35混合进行红细胞沉降试验,发现HA35诱发红细胞沉降率增加,且一定浓度下分子量不同引发沉降率增加程度不同(表17~表19)。HA35不但诱发人和动物红细胞钱串状聚集,而且还诱发红细胞沉降率增加,这个结果提示低分子量透明质酸片段诱发红细胞沉降率改变直接和间接影响红细胞和白细胞血液流变学,进而产生对白细胞渗出的生物效应。利用低分子量透明质酸片段分子量不同引发沉降率增加程度不同,来检测制备的HA35不同批次间的分子量变异,从而进行生产质量控制。

表17 HA35对人红细胞沉降率的影响

表18 HA35对比格犬红细胞沉降率的影响

表19 HA35对小鼠红细胞沉降率的影响
3 讨论
中国仓鼠卵巢细胞(CHO)生产的有糖化的纯度大于98.5%的重组人透明质酸酶PH20被用来皮下输液、免疫球蛋白皮下给药和治疗性抗体皮下给药[20,26],和牛睾丸提取的透明质酸酶PH20相比,人PH20注射前不需皮肤敏感试验,静脉注射不诱发人中和抗体产生[26]。
本文分别使用人工合成重组人透明质酸酶PH20和牛睾丸透明质酸酶PH20降解高分子透明质酸注射级原料,制备了平均分子量为35 kDa的HA35(图1,图2),并使用琼脂糖凝胶电泳和十八角度激光方法(GPC-MALLS)测定透明质酸片段的平均分子量和分子量分布范围(图1,图2,表2,表3,表4)。使用重组人透明质酸酶PH20降解高分子透明质酸HA制备的HA35和高分子HA相比,黏度降低,组织渗透性增强;使用重组人透明质酸PH20降解制备的HA35和物理(加热或超声)、化学(酸或碱或活性氧)方法制备的低分子透明质酸片段相比,HA35没有非切割部位的结构理化损伤;使用重组人透明质酸PH20降解制备的HA35和有免疫原性动物、昆虫提取的或没有糖化的微生物生产的透明质酸酶制备的低分子透明质酸片段相比,加热使残留重组人透明质酸酶PH20失活后使用不引发过敏反应,注射前不需皮肤敏感试验。
本研究首次发现透明质酸片段HA35与其他平均分子量不同的透明质酸片段诱发人和多种试验动物的血红细胞钱串状聚集,这种诱发红细胞钱串状聚集的透明质酸片段的最小浓度与其分子量呈负相关(图3,图4,图5,图6),为低分子量透明质酸片段的分子量测定提供了新的细胞学方法,而且这种细胞学方法灵敏度高、重复性好。
CD44蛋白是一组分布广泛的膜整合蛋白,是红细胞表面表达量最多的免疫分子,介导细胞与细胞间及细胞与细胞外基质间的相互作用,进一步研究发现,这种透明质酸片段诱发红细胞钱串状聚集由透明质酸受体CD44介导(图3,图4,图5),提示透明质酸片段HA35通过红细胞表面透明质酸受体CD44参与机体功能调节[33]。
另外,本研究意外发现低分子量透明质酸片段诱发内蒙古山羊、内蒙古黄牛和恒河猴、人、比格犬、BALB/c小鼠、迷你猪、田园猫、美洲羊驼、蒙古马、红颜白水貂红细胞钱串状凝集的现象完全不同(表6~表16),存在种属特异性。通过以上结果我们推论透明质酸片段HA35对不同种属生物体的治疗作用和使用剂量可能不同,为透明质酸片段HA35的进一步临床研究提供了新的线索。
相关文献表明HA通过与红细胞受体CD44和白细胞受体SIGLEC-9相互作用间接影响白细胞的交通和白细胞激活[26-28],低浓度的透明质酸片段HA35和其他分子量不同的透明质酸片段不但诱发人和动物红细胞钱串状聚集,而且还诱发红细胞沉降率增加(表17~表19)。因此,我们推论以上与红细胞相关的变化直接或间接影响红细胞和白细胞血液流变学,可能与中性粒细胞在血管表面形成轴流和吸附有关,进而产生白细胞吸附血管壁渗出的生物效应[34-35]。目前,本研究利用不同分子量的透明质酸片段诱发红细胞沉降率改变来检测平均分子量35 kDa的透明质酸片段HA35产品生产批次间的分子量变异系数或产品质量控制情况。
综上所述,使用人工合成重组人透明质酸酶PH20制备的35 kDa的透明质酸片段HA35具有更好的组织渗透性、无理化损伤和过敏反应,并发现了HA35与人和不同动物的红细胞的相互作用和种属特异性,为HA35的进一步研究和应用奠定了理论基础。
