北虫草水提物对小鼠酒精性肝损伤保护作用及机制*
2022-06-08王千慧郑剑玲黄竹青曲思吉丛莉汇韩桃桃
王千慧,刘 颖,郑剑玲,黄竹青,卜 桐,曲思吉,丛莉汇,韩桃桃,齐 贺
(辽宁省基础医学研究所辽宁医药职业学院医学生物技术教研室,辽宁 沈阳 110101)
北虫草(Cordyceps militaris),又称为北冬虫夏草,属于子囊菌门(Ascomycota)粪壳菌纲(Sordariomycetes)肉座菌目(Hypocreales)虫草科(Cordycipitaceae)虫草属(Cordyceps)[6]。北虫草中富含腺苷、虫草素、虫草酸、小分子肽等多种活性物质,具有良好的免疫调节、抗氧化、抗肿瘤、抗感染等药理学作用[7-9]。
酒精性肝病(alcoholic liver disease,ALD)是目前世界范围内最常见的慢性肝病,同时也是我国最常见的肝脏疾病之一,其诱因为患者长期大量饮酒[1]。ALD初期通常表现为脂肪肝,进而发展成酒精性肝炎、肝纤维化和肝硬化;严重酗酒会诱发广泛肝细胞坏死,甚至引起衰竭,严重危害身体健康[2-3]。ALD的发病机制包括导致肝脏脂肪变性、氧化应激,乙醇代谢中间产物乙醛介导的毒性以及细胞因子和趋化因子诱导的炎症等[4-5]。
本课题组在前期研究中已发现北虫草水提物对小鼠酒精性胃损伤具有保护作用,在此基础上,以提升机体抗氧化能力、促进乙醇代谢,降低机体炎症反应等因素为切入点,进一步探讨北虫草水提物对小鼠酒精性肝损伤保护作用及其机制,为拓展开发北虫草相关产品提供试验依据。
1 材料与方法
1.1 试验动物
SPF级昆明小鼠,8周龄~10周龄,体重25 g~30 g,试验动物生产许可证号:SCXK(辽)2015-0001,购自辽宁长生生物技术股份有限公司。雌雄各半分笼饲养,每日12 h光照,饮水自由。
1.2 试剂
超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)含量检测试剂盒、谷胱甘肽S-转移酶(GST)活性检测试剂盒、乙醇脱氢酶(ADH)活性检测试剂盒、乙醛脱氢酶(ALDH)活性检测试剂盒,北京索莱宝生物科技有限公司;谷丙转氨酶(ALT)试剂盒、谷草转氨酶(AST)试剂盒,南京建成科技有限公司;一抗、二抗及ECL发光试剂,武汉赛维尔生物科技有限公司。
1.3 仪器
ST8R高速冷冻离心机,美国赛默飞世尔公司;LGJ-10N冻干机,北京亚星仪科科技发展有限公司;K6600-A酶标仪,北京凯奥科技有限公司;Scientz-950E细胞破碎仪,宁波新芝生物科技股份有限公司;Eclipse Ci-L正置白光拍照显微镜,日本尼康公司;BV-2垂直电泳仪、BT-2转印电泳仪,武汉赛维尔生物科技有限公司;6300化学发光仪,上海勤翔科学仪器有限公司。
1.4 试验方法
1.4.1 北虫草水提物制备方法
采用低温、高温提取相结合方法。低温提取温度为 45℃,料液比 1∶30,提取 3 h,4 000 r·min-1离心10 min,分离得到上清液Ⅰ;再对沉淀进行高温提取,温度为80℃,料液比为1∶30,提取3.5 h后4 000 r·min-1离心10 min,得上清液Ⅱ;合并2次上清液旋转蒸发进行浓缩,最后将浓缩液冻干得到粉末,置于-20℃冰箱中保存备用。使用时,用纯化水进行溶解,现用现配[10]。
1.4.2 造模及给药方法
将30只昆明小鼠随机分成5组,每组雌雄各半。
阴性对照组:常规饲料,饮食自由,每日上午用蒸馏水(10 mL·kg-1)灌胃,3 h后再次采用蒸馏水(0.1 mL·kg-1)灌胃。
病理模型组:常规饲料,饮食自由,参照参考文献[11-12]的造模方法和预试验情况,每日上午用35%酒精(10 mL·kg-1)灌胃,3 h后用蒸馏水(0.1 mL·kg-1))灌胃。
北虫草给药组(3组):常规饲料,饮食自由,每日上午用35%酒精(10 mL·kg-1)灌胃,3 h后分别用 0.5 g·kg-1、1.0 g·kg-1和 2.0 g·kg-1北虫草水提物进行灌胃。
各组皆饲养14 d,末次灌胃后禁食不禁水,24 h后处死小鼠并立刻取材[10]。
1.4.3 小鼠血液样本采集与血清谷丙转氨酶和谷草转氨酶酶活性检测
各组小鼠摘眼球取血,静止2 h,3 500 r·min-1、4℃条件下离心15 min。取上清液,严格按照酶活性试剂说明书进行检测。
1.4.4 小鼠肝组织相关酶活性及丙二醛含量检测
将各组小鼠肝组织按0.1 g·mL-1加入相应提取液,于冰浴下匀浆,然后将匀浆液置于超声波细胞粉碎仪中,功率200 W、超声3 s,间隔10 s,重复30次破碎细胞。按各试剂盒说明书要求分别离心获取各组小鼠肝组织上清液,分别测定各组小鼠肝组织上清液中超氧化物歧化酶SOD、乙醇脱氢酶ADH和乙醛脱氢酶ALDH活性及丙二醛MDA含量。
1.4.5 小鼠肝组织病理学检查
小鼠肝脏用冷生理盐水冲洗,剪取肝脏左叶用4%多聚甲醛溶液中固定,常规方法制作石蜡切片,采用苏木精-伊红染色法HE(hematoxylin-eosin staining,HE)进行染色并于光学显微镜下检查组织病理学变化。
1.4.6 小鼠肝组织NF-κB和TNF-α蛋白表达水平
运用蛋白质印迹法检测小鼠肝组织NF-κB(大小为65 KD),和TNF-α蛋白表达水平。用RAPI裂解液处理小鼠肝组织匀浆液30 min,4 000 r·min-1离心10 min后取上清。采用二喹啉甲酸法BCA(bicinchoninic acid assay,BCA)蛋白定量后进行SDS-PAGE电泳,蛋白经电泳分离后转移至PVDF膜上。采用脱脂奶粉封闭1 h后加入相应一抗(NF-κB和TNF-α),4℃孵育过夜。次日洗涤、室温孵育二抗2 h,用凝胶成像仪成像、进行数据分析。
1.5 数据处理
研究数据均采用SPSS 13.0分析,所得数据均用平均值±标准差表示,多样本间均值差异采用t检验,以P<0.05为差异具有统计学意义。
2 结果与分析
北虫草水提物对酒精性肝损伤小鼠血清谷丙转氨酶和谷草转氨酶活性影响试验结果(±s,n=6)见表1。
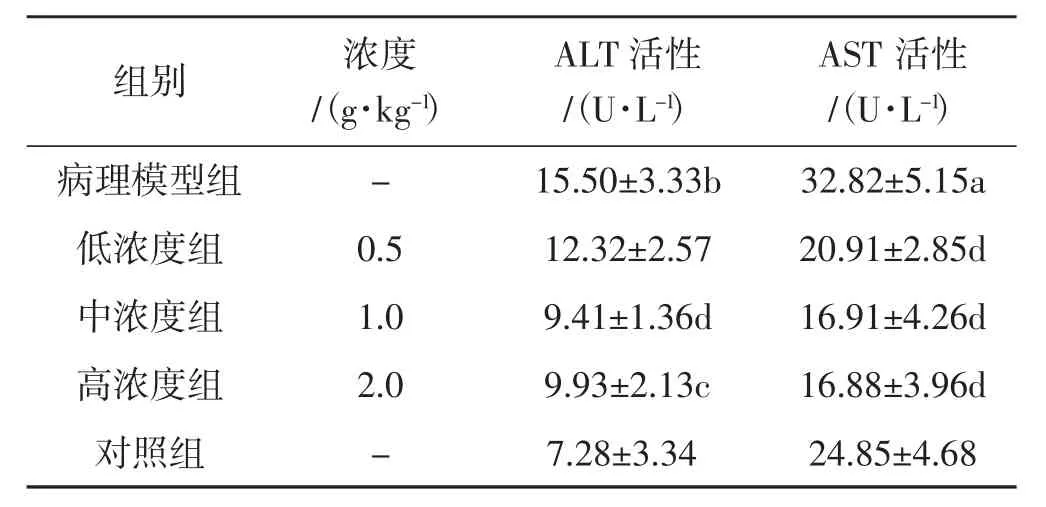
表1 北虫草水提物对酒精性肝损伤小鼠血清ALT、AST活性影响Tab.1 Effects of Cordyceps militaris water extract on serum ALT and AST activities in mice with alcoholic liver injury
如表1所示,与对照组小鼠相比,病理模型组小鼠血清中谷丙转氨酶ALT和谷草转氨酶AST活性均明显升高;与病理模型组相比,各浓度北虫草水提物均能不同程度的降低小鼠血清中ALT、AST活性,且AST活性呈现浓度依赖性。
北虫草水提物对酒精肝损伤小鼠肝组织超氧化物歧化酶SOD活性和丙二醛MDA含量影响试验结果(±s,n=6)见表 2。
如表2所示,与对照组相比,模型组小鼠肝组织中SOD活性均明显下降,而MDA含量明显增高(P<0.01);与模型组相比,各浓度组小鼠肝组织中的SOD活性增强,且存在浓度依赖性;同模型组相比,中浓度组和高浓度组小鼠肝组织中MDA含量明显下降,具有统计学意义(P<0.05),而低浓度组则无明显差异。
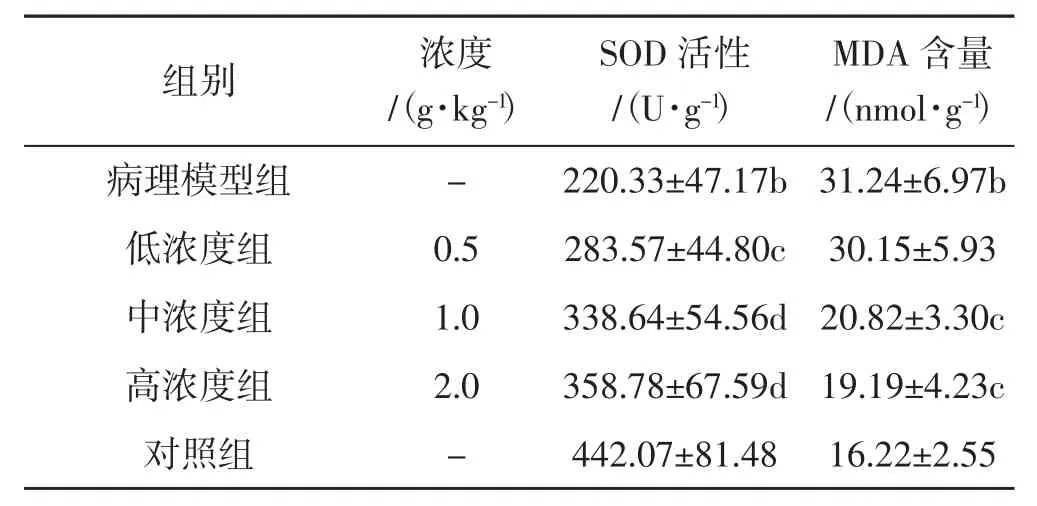
表2 北虫草水提物对酒精性肝损伤小鼠肝组织SOD活性和MDA含量影响Tab.2 Effects of Cordyceps militaris water extract on SOD,GST and MDA of hepatic homogenate in mice of liver injury
北虫草水提物对酒精肝损伤小鼠肝组织乙醇脱氢酶ADH和乙醛脱氢酶ALDH活性影响(±s,n=6)试验结果见表3。
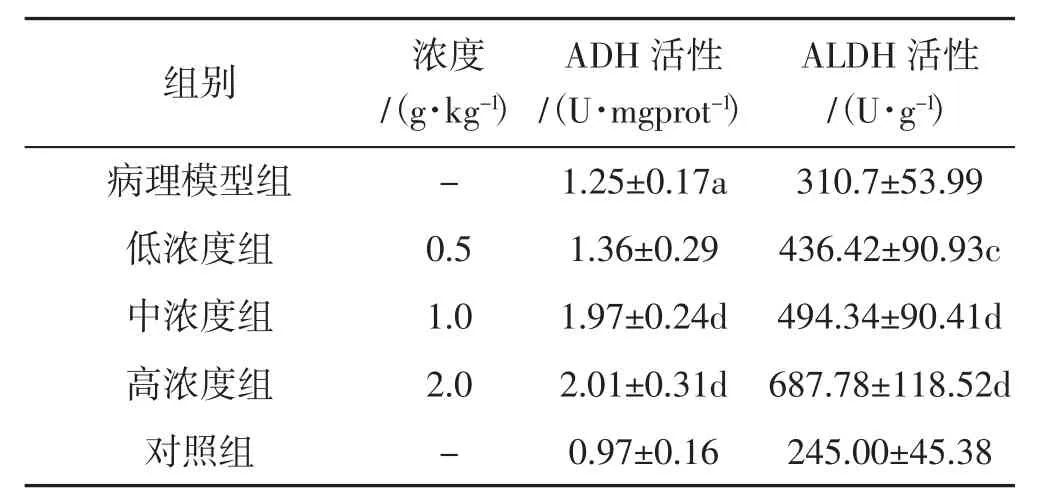
表3 北虫草水提物对酒精性肝损伤小鼠肝组织ADH和ALDH活性影响Tab.3 Effects of Cordyceps militaris water extract on SOD,GST and MDA of hepatic homogenate in mice of liver injury
如表3所示,与对照组相比,模型组小鼠肝组织中ADH活性均升高(P<0.05);与模型组相比,在分别给予北虫草水提物后,小鼠肝组织中ADH、ALDH活性进一步升高,且存在浓度依赖性。
200倍镜下观察各组小鼠肝脏组织病理学变化,小鼠肝组织石蜡切片HE染色结果见图1。
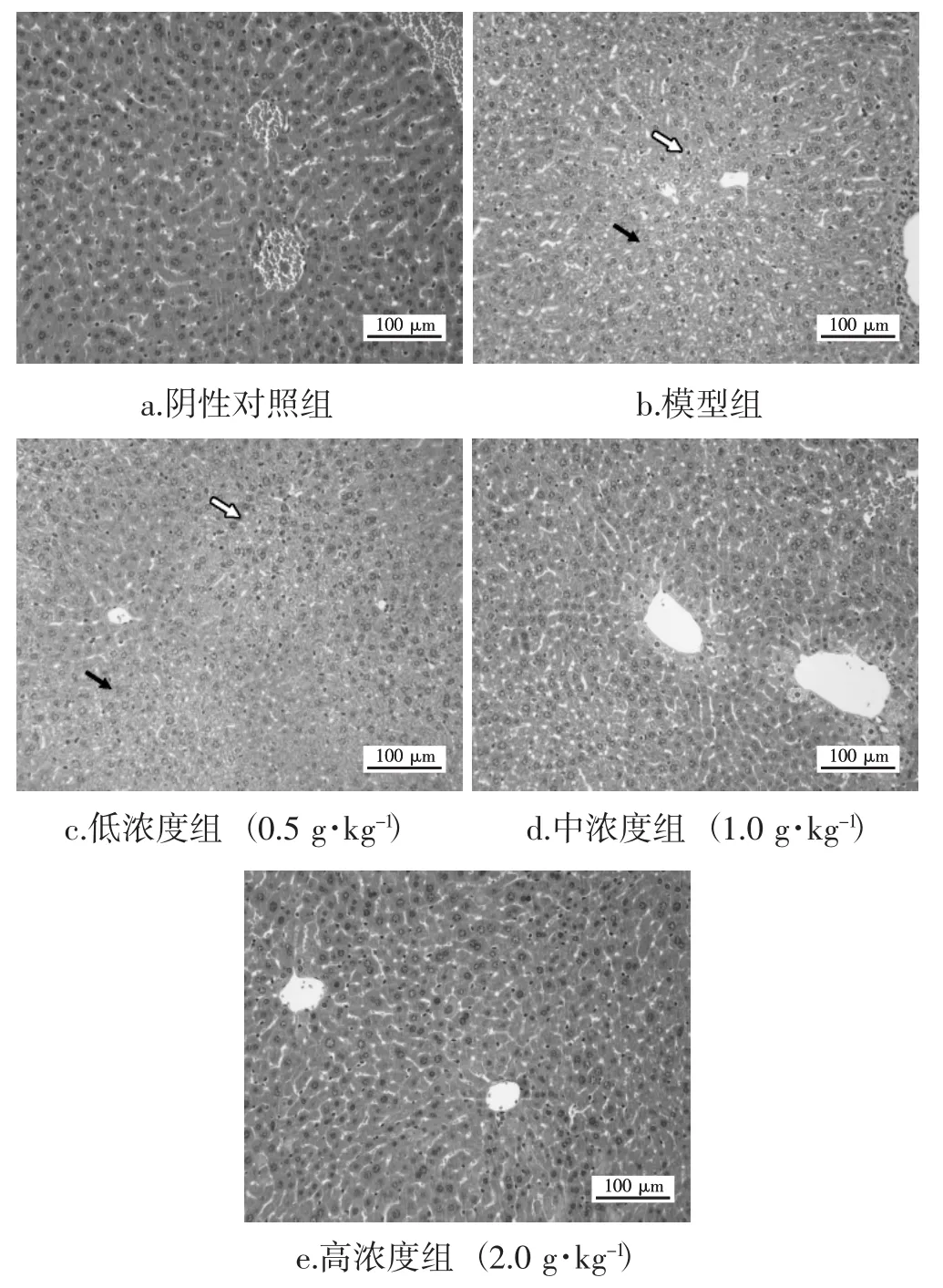
图1 北虫草水提物对小鼠酒精肝损伤组织病理变化的影响Fig.1 Effect of Cordyceps militaris water extract on alcoholinduced histopathological change
由图1可知,对照组小鼠肝组织结构正常,肝小叶结构完整,肝索排列整齐,肝细胞胞质丰富、形态结构正常;病理模型组小鼠肝组织广泛可见肝细胞脂肪变性,胞质内可见大小不一的圆形脂肪空泡(黑箭头),可见较多肝细胞水肿,胞质疏松(白箭头);北虫草水提物低浓度组与模型组小鼠相近,视野内可见肝细胞脂肪空泡、细胞水肿、胞质松散等情况,而中浓度组、高浓度组小鼠肝组织结构较为正常,虽可见散在脂滴,但肝索排列尚整齐,细胞形态较为正常,肝窦未见明显扩张或挤压,未见明显炎症。
各组小鼠肝脏组织中核转录因子NF-κB和肿瘤坏死因子TNF-α蛋白表达含量变化见图2。
如图2所示,与对照组相比,模型组小鼠肝组织中 NF-κB和 TNF-α蛋白表达明显上调(P<0.05);与模型组相比,给予北虫草水提物后,小鼠肝组织中NF-κB蛋白表达下调,其呈现浓度依赖性低浓度北虫草水提物对TNF-α蛋白表达量无明显影响,中浓度和高浓度北虫草水提物可使TNF-α蛋白表达量有所下降(P<0.05)。
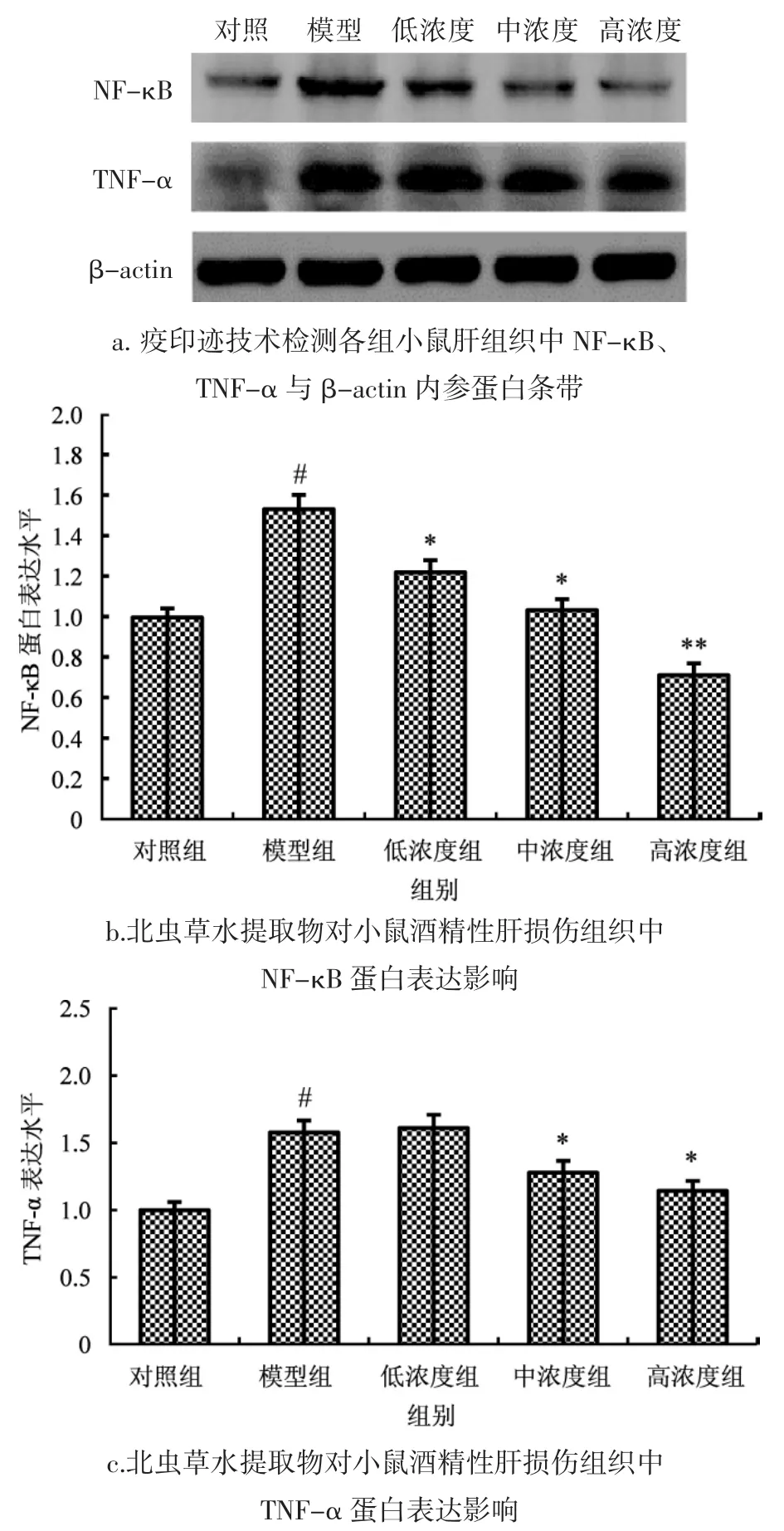
图2 北虫草水提物对小鼠酒精肝损伤组织中NF-κB和TNF-α蛋白表达影响Fig.2 Effect of Cordyceps militaris water extract on the expression of NF-κB and TNF-α protein in alcoholic liver injury in mice
3 讨论
酗酒是导致人类疾病与残疾的三大危险因素之一,约有200余种疾病与过度饮酒相关,使癌症风险上升[13]。肝脏是乙醇代谢的主要器官,乙醇代谢过程中,其本身及代谢产物如乙醇乙酸盐、脂肪酸乙醇酯、乙醇蛋白复合物均会对肝组织造成直接或间接的毒性作用[14]。通过观察病理切片可见:模型组小鼠肝细胞出现明显病理变化,肝索结构紊乱,细胞界限、细胞核模糊不清,胞质疏松,有明显的脂肪空泡,同时出现炎症和坏死区;北虫草水提物给药组镜下可见肝脏出现病理变化,但病变程度均较模型组轻,肝索排列尚整齐,细胞边界、细胞核较为清晰,细胞内可见散在脂滴,有轻微炎症和坏死区,表明北虫草水提物具有肝脏保护作用。
ALT、AST是机体内2种十分重要的转氨酶,临床上常用血清ALT、AST活性反映肝细胞损伤程度。研究中发现病理组小鼠血清ALT、AST活性明显升高,表明短期摄入高浓度酒精对小鼠肝细胞及细胞线粒体造成损伤;当给予不同浓度北虫草水提物后,各组小鼠血清中ALT、AST活性明显下降,同时各给药组小鼠其肝细胞病理损伤程度均有所缓解,表明北虫草水提物具有肝细胞保护作用。
机体氧化与抗氧化失衡时即产生氧化应激,目前大量证据表明氧化应激在酒精性肝损伤过程中发挥重要作用。乙醇经ADH代谢过程会增加还原性辅酶ⅠNADH(nicotinamide adenine dinucleotide,NADH)水平,增加了呼吸连中电子流;同时也可激活微粒体乙醇氧化酶系统(MEOS)和还原型辅酶Ⅱ NADPH(nicotinamide adenine dinucleotide phosphate,NADPH),产生大量活性氧(reactiveoxygen species,ROS),因此酒精代谢导致的氧化应激损伤可产生一系列级联反应,使细胞内生物大分子和细胞器损伤、生物膜发生脂质过氧化、细胞内信号传导通路改变、增加机体促炎细胞因子水平等[15-17]。SOD是机体抗氧化系统中最重要的酶类之一,对维持细胞与线粒体正常功能和结构完整性中起到重要作用[18]。MDA是脂质过氧化反应链式终止阶段的产物之一,其含量多少可直接反映机体产生自由基的情况和组织细胞脂质过氧化程度。在研究中模型组小鼠肝组织中SOD活性较正常组小鼠明显下降,而MDA含量却显著提升;当分别给予不同浓度北虫草水提物后,各组小鼠肝组织中SOD活性均有所升高,MDA含量均降低,表明短期大量摄入酒精可引起小鼠肝组织氧化应激,机体抗氧化能力减弱、脂质过氧化水平升高,但北虫草水提物可有效提高小鼠肝组织中SOD活性,降低MDA含量,提升机体抗氧化剂清除ROS能力,降低机体脂质过氧化水平,这也可能是北虫草水提物拮抗小鼠酒精性肝损伤作用机制之一。
机体摄入酒精后,乙醇主要经肝组织ADH介导先氧化生成乙醛[19];少部分乙醇则通过微粒体乙醇氧化酶转化成乙醛,乙醛经ALDH氧化成乙酸,进入三羧酸循环,最终氧化成二氧化碳和水排出体外。因此当肝脏中ADH活性下降时,会导致机体乙醇蓄积,从而加重乙醇对肝、脑、肾等重要脏器的毒害作用[20-21]。研究中发现,给予酒精后,小鼠肝组织中ADH活性有所提高;当给予北虫草水提物后,各组小鼠ADH活性进一步提高,表明北虫草水提物可通过提高肝ADH活性,促进乙醇代谢,降低乙醇对肝脏的损伤和刺激作用,进而保护肝脏和其他重要脏器。
乙醛作为中间产物可直接触发炎症反应、细胞外基质重塑和纤维化,同时还可直接刺激肝星状细胞中的转化生长因子(TGF)-β信号转导,进一步加重纤维化和炎症作用,直接损伤肝组织[22-23];此外乙醛还可与蛋白质、DNA共价结合,导致肝细胞中产生MDA,进一步加重肝损伤[24]。因此加速乙醛代谢对肝保护作用至关重要。研究中发现病理组小鼠肝组织中ALDH活性略微上升;当给予北虫草水提物后,各组小鼠肝组织中ALDH活性明显升高,呈现浓度依赖性,表明北虫草水提物可通过提高机体肝组织ALDH活性促进乙醛代谢、降低乙醛对肝脏刺激和毒害作用,进而保护肝组织。综上,北虫草水提物可通过增强肝脏ADH、ALDH活性,加速乙醇、乙醛代谢,降低其对肝细胞毒性作用和肝脏负荷,进而发挥肝保护作用。
目前已有大量的研究表明NF-κB广泛参与机体炎症反应、免疫反应等基因表达调控,是机体内重要的炎症转录调控因子[25-26]。正常情况下,其与抑制亚基IκB以复合物形式存在于细胞质中,当受到细胞外信号刺激时,如氧化应激刺激等信号,IκB被磷酸化并从复合物上解离下来,NF-κB迅速转位至细胞核中并与特定的κB序列结合,调控包括TNF-α和IL-6在内的众多炎症因子的转录和表达[27-29]。
TNF-α是由机体内多种免疫细胞产生的具有重要生物活性的炎症因子,目前与乙醇相关的肝组织疾病发病机制中,普遍认为最后共同通路由TNF-α介导,且已有研究发现TNF-α在酒精性肝损伤患者中过表达[30-31]。Masaki等[32]研究发现,对酒精性肝损伤大鼠给予抗TNF-α抗体或敲除TNF-α受体基因后,大鼠肝脏未出现炎症及坏死情况。机体饮酒后造成氧化应激损伤,同时产生大量ROS,此时核转录因子NF-κB被激活,进而激活细胞外信号调节蛋白1/2(ERK1/2),早期生长反应因子-1(Egr-1)和蛋白激酶P38途径,促使细胞产生大量TNF-α[33-35]。而TNF-α则通过多种途径诱导了肝细胞凋亡,包括死亡受体通路及线粒体通路。在研究中发现,病理组小鼠NF-κB和TNF-α蛋白表达明显上调,与病理组小鼠相比,北虫草水提物各组小鼠NF-κB蛋白下调,且呈浓度依赖性;在中浓度、高浓度北虫草水提物组中,小鼠TNF-α蛋白表达下调,表明北虫草水提物可通过调控小鼠肝组织中NF-κB信号通路,抑制TNF-α释放来避免肝细胞凋亡,保护肝组织。
综上,北虫草水提物具有良好的抗酒精所导致的氧化应激肝损伤作用,可帮助机体提高乙醇代谢能力,通过调节NF-κB信号通路,抑制TNF-α等炎症因子释放,从而发挥对酒精性肝损伤的保护作用。
