维生素 K 1联合 X射线对非小细胞肺癌细胞存活能力的影响
2022-06-08司少艳秦亚亚王宗烨宋淑军
司少艳,秦亚亚,王宗烨,宋淑军#
战略支援部队特色医学中心1综合基础研究室,2放疗科,北京 100101
肺癌是常见的恶性肿瘤之一,世界卫生组织国际癌症研究机构发布的统计数据显示,2020年全球肺癌新发病例220万,仅次于乳腺癌,死亡病例180万,居恶性肿瘤死亡例数第一;2020年中国肺癌新发病例和死亡病例均居恶性肿瘤首位,分别为82万和71万[1]。美国癌症协会报道非小细胞肺癌占全部肺癌的80%~85%[2]。放疗是肺癌的重要治疗手段,特别是局部晚期非小细胞肺癌、转移肺癌不能进行其他治疗时,放疗显得尤为重要。然而,放疗也存在一定的不良反应,许多患者会逐渐产生放疗抵抗或对放疗不敏感。因此,为了提高疗效、减轻不良反应或减少放疗抵抗,开发一些与放疗具有协同作用的药物可能会减少不良反应或增加放疗敏感性,对改善肿瘤患者的临床预后具有非常重要的意义。但大多数药物存在不良反应,因此近年来人们越来越关注无不良反应的天然食品。维生素是维持人体正常功能所必需的营养素,在新陈代谢中发挥着重要作用。维生素K(vitamin K,VK)是一种脂溶性维生素,于1929年首次被发现[3],是参与凝血过程的一种必需因子,天然形式的VK1和VK2及人工合成的VK3、VK4和VK5均含有2-甲基-1,4-萘醌环结构[4]。VK1属于天然营养素,主要存在于绿色蔬菜和植物中,又称叶绿醌,是VK在食物中的主要存在形式,很少产生不良反应,对多种人类肿瘤细胞表现出一定的抗肿瘤特性[4-5],而且可以增强索拉非尼对结肠癌细胞的抑制作用[6]。目前有关VK1对肿瘤放疗影响的研究尚未见报道,本研究探讨VK1联合X射线对非小细胞肺癌细胞存活能力的影响,现报道如下。
1 材料与方法
1.1 材料
人非小细胞肺癌细胞A549由美国模式菌种收集中心(American Type Culture Collection,ATCC)提供,细胞培养基RPMI-1640购自美国GE医疗生命科学部,胎牛血清由上海依科赛生物制品有限公司提供,Axesse医用电子直线加速器购自瑞典Elekta公司,瑞氏-姬姆萨染液购自北京雷根生物技术有限公司,VK1购自江苏华阳制药有限公司。
1.2 实验方法
1.2.1 细胞培养应用改良的RPMI-1640培养基培养细胞,培养基中含10%胎牛血清、青霉素(100 IU/ml)和链霉素(100 IU/ml),于 37 ℃、5%CO2培养箱中培养,每2~3天换液1次,取对数生长期细胞进行传代接种及后续实验。
1.2.2 细胞照射采用瑞典Elekta公司生产的Axesse医用电子直线加速器,室温下6MV-X射线照射细胞,照射源轴距为100 cm。照射剂量为2 Gy,剂量率为4 Gy/min。对照组细胞不进行实际照射,但同样运至照射地点。
1.2.3 细胞集落形成实验将对数生长期的A549细胞稀释成单细胞悬液,然后接种于6孔板中,每孔400个细胞,待细胞贴壁后,换成含有0、6.25、12.50、25.00 μg/ml VK1的培养基处理细胞,分别作为对照组、低浓度组、中浓度组、高浓度组,1天后进行X射线照射(每个VK1剂量组均设未照射对照组),单次照射总剂量为2 Gy。然后把细胞置于培养箱中继续培养,应用含原相同浓度VK1的培养基每2~3天换液1次,药物处理时间为8天,于照射后第8天(照射后7天整),应用4%多聚甲醛固定细胞,然后应用瑞氏-姬姆萨染液进行染色,显微镜下观察细胞,对≥50个细胞的细胞团(集落)进行计数,集落形成效率=每孔集落数量/每孔接种细胞数量×100%,存活分数=实验组集落数量(/该组每孔细胞接种数×未照射对照组集落形成效率)×100%。
1.2.4 药物相互作用的评价根据Cohen等[7]的方法计算药物相互作用系数(coefficient of drug interaction,CDI),计算公式:CDI=AB(/A×B),其中AB为VK1与射线联合作用后细胞的存活率,A为单独VK1处理后细胞的存活率,B为单独射线作用后细胞的存活率。CDI=1时两者为相加作用,CDI>1时两者为拮抗作用,CDI<1时两者为协同作用,CDI<0.7时两者为显著的协同作用。但一般为了补偿生物实验的自然偏差,相加作用的判断可扩展至0.9≤CDI≤1.1。
1.3 统计学方法
采用SPSS 22.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。绘制剂量-反应曲线,计算半抑制浓度(half maximal inhibitory concentration,IC50)。以P<0.05为差异有统计学意义。
2 结果
2.1 VK 1对 A549细胞集落形成能力的影响
不同浓度VK1处理后A549细胞集落数量明显不同(图1)。VK1高浓度组、中浓度组、低浓度组、对照组细胞集落数量分别为(50.0±8.7)、(158.7±5.2)、(201.0±3.8)、(188.7±3.4)个。其中高浓度组细胞集落数量最少,仅为对照组的26.5%,中浓度组次之,为对照组的84.1%,而低浓度组与对照组细胞集落数量无明显差异。高浓度组细胞集落数量低于中浓度组、低浓度组、对照组,且中浓度组细胞集落数量低于对照组和低浓度组,差异均有统计学意义(P<0.05)。VK1能够使A549细胞集落数量减少,且呈剂量依赖性,IC50为20.22 μg/ml。

图1 不同浓度VK 1处理后 A549细胞集落数量
2.2 VK 1与 X射线对 A549细胞存活分数的影响
对于未照射X射线的A549细胞,VK1中浓度组和高浓度组细胞存活分数均低于对照组和低浓度组,高浓度组细胞存活分数低于中浓度组,差异均有统计学意义(P<0.05)。对于照射X射线的A549细胞,低浓度组、中浓度组和高浓度组细胞存活分数均低于对照组,中浓度组和高浓度组细胞存活分数均低于低浓度组,高浓度组细胞存活分数低于中浓度组,差异均有统计学意义(P<0.05)。照射X射线的各组细胞存活分数均低于未照射X射线的各组细胞,差异均有统计学意义(P<0.05)。X射线(2 Gy)照射后A549细胞集落数量明显减少,在对照组中,与未照射X射线的细胞比较,照射X射线的细胞存活分数下降了44.5%;低浓度、中浓度和高浓度VK1与X射线联合作用后细胞存活分数较单独X射线照射分别下降了39.5%、72.1%和98.1%,较未照射X射线的对照组分别下降了66.4%、84.5%和98.9%,其下降程度与VK1浓度呈剂量依赖性。与未进行X射线处理的细胞比较,低浓度、中浓度和高浓度VK1与X射线联合作用后细胞存活分数分别下降了68.5%、71.5%和96.0%,其下降程度与VK1浓度呈剂量依赖性。(表1)
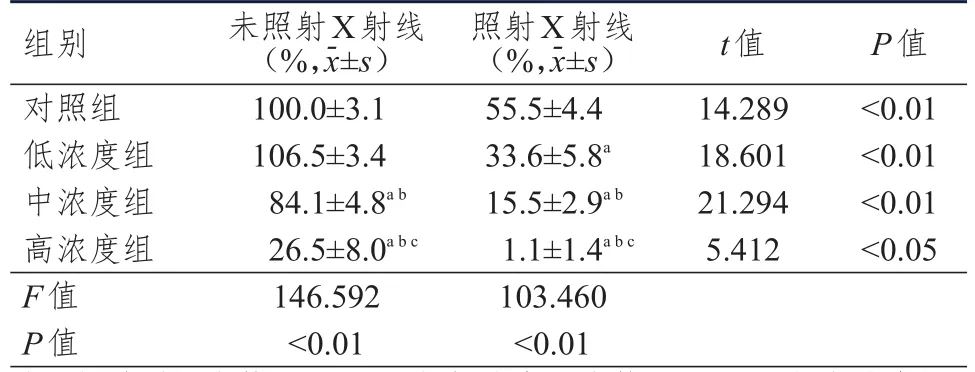
表1 VK 1与 X射线对 A549细胞存活分数的影响
2.3 不同浓度VK 1与 X射线联合作用的CDI
低浓度、中浓度、高浓度VK1与X射线联合作用的CDI分别为0.57、0.33和0.07,均明显小于0.7。
3 讨论
体外集落或克隆形成实验于60多年前由Puck和Marcus[8]建立,是检测单个细胞在体外增殖并形成细胞群体(50及以上的细胞团称为一个集落)的能力,该技术是评价肿瘤细胞存活和增殖能力的良好方法[9],可以用来评估各种治疗方法的细胞毒性效应,被广泛用于检测化学药物或辐射对肿瘤细胞的抑制效果[10-11],与其他体外生物活性实验相比,集落形成实验更为敏感[12]。已有研究证明,集落形成实验结果与临床药物的实际反应具有一定的相关性[13]。本研究应用体外集落形成实验评估VK1与X射线对非小细胞肺癌细胞A549存活能力的影响。
VK属于脂溶性维生素,通常被认为是血液凝固的关键因素,近年来在体内试验和体外实验中均观察到各种VK的抗肿瘤作用。动物实验结果显示,给荷肝癌大鼠腹腔内注射VK3,每周1次,每次10 mg,持续给药4周,其存活期从对照组的17天延长至治疗组的60天[14]。研究者对皮下肉瘤模型小鼠进行VK2治疗,结果显示,静脉或灌胃两种给药方式均可显著抑制肿瘤生长[15]。在临床试验中,晚期肝癌患者服用VK3后,17%的患者肿瘤体积缩小,而且患者的平均生存时间也有所增加[16]。在一项24 000多人参与的调查研究中,通过10年以上的随访调查发现,VK2能够在一定程度上降低恶性肿瘤病死率,膳食VK2摄入量与男性肺癌和前列腺癌的发生风险呈显著负相关,但未发现其与VK1的摄入量具有相关性[17]。然而对美国人群的一项调查研究并未发现食物中VK(VK1、VK2和总VK)的摄入量与全部前列腺癌或晚期前列腺癌的发生有关[18]。一项10万多人参与的调查研究发现,饮食中VK1和二氢VK1的摄入量与胰腺癌的发生风险呈负相关,而未发现VK2摄入量与胰腺癌具有相关性[19]。以上调查结果不一致可能与研究方式、地区、人种以及肿瘤类型不同有关。但多数的体外实验显示VK对多种类型的肿瘤细胞具有抗肿瘤特性[5,20],VK3和 VK5能够抑制白血病细胞增殖,诱导白血病细胞凋亡[21]。VK2对多种肺癌细胞系,包括小细胞癌、腺癌、鳞状细胞癌以及大细胞癌的生长均具有剂量依赖性抑制作用,其抑制效果与肺癌细胞系的组织类型无关[22]。VK1可以诱导人类胃癌和结肠癌细胞凋亡并抑制细胞增殖,而且不同的肿瘤细胞对VK的敏感性不同,结肠癌细胞比胃癌细胞对VK1的反应更明显[23]。目前,有关VK1对非小细胞肺癌A549细胞的影响尚未见报道。本研究结果显示,VK1呈剂量依赖性抑制A549细胞集落形成,高浓度VK1(25.00 μg/ml)单独处理细胞即可以抑制近75%的细胞集落形成,提示VK1在体外对A549细胞的生长及存活具有明显的抑制作用。这为进一步研究VK1的抗肿瘤作用提供了依据。本研究中VK1对A549细胞的IC50为20.22 μg/ml(相当于55.5 μmol/L),明显小于以往报道的6~9 mmol/L[20],造成这种差异的原因可能与采用的实验方法不同有关,本研究中采用的集落形成实验比其他细胞存活实验更敏感[12]。而且研究的肿瘤细胞种类不同,不同的肿瘤细胞对VK1的敏感性不同。此外,药物处理时间不同也会影响IC50,本研究中药物处理时间为8天,细胞一直处于含有VK1的培养基中,因此,如果临床应用VK1协助治疗肿瘤,在治疗期间持续维持体内VK的充足水平可能也是影响治疗效果的重要因素。
VK1作为一种天然产物,具有一定的抗肿瘤活性,近年来研究显示VK1与化疗药物索拉非尼联合使用可以明显增强索拉非尼对人类肿瘤细胞(如肝癌、胰腺癌、结肠癌以及恶性胶质瘤细胞)的抗肿瘤作用,VK1可以增强化疗药物对肿瘤细胞存活、迁移、增殖的抑制作用以及对肿瘤细胞凋亡的促进作用[24]。因此,VK1有可能是放疗增效作用的潜在制剂。本研究结果显示,VK1可以呈剂量依赖性增强2 Gy照射对A549细胞存活的抑制作用,虽然低剂量VK1单独处理对细胞的集落形成能力没有抑制作用,但低剂量VK1与X射线联合作用可以使X射线对细胞的抑制能力提高近40%,因此,VK1有可能成为放疗潜在的增敏剂。而高剂量VK1的抑制作用明显提高,较单独照射组的抑制作用提高98%以上,接近1倍,说明VK1对X射线具有增效作用。而且两者联合使用较单独使用的抑制效果更明显,说明两者可能具有协同作用。曾有研究报道,VK1与索拉非尼联合使用对肝癌细胞的迁移和增殖具有协同抑制作用[25]。
两种药物或治疗方法联合使用时,其相互作用结果的判断可以通过CDI进行评估[7]。CDI<1时两者为协同作用,CDI<0.7时两者为显著的协同作用,本研究结果显示,低浓度、中浓度、高浓度VK1与X射线联合作用的CDI分别为0.57、0.33和0.07,均明显小于0.7,说明VK1与X射线之间的相互作用为显著的协同作用,而不是简单的加性效应。本研究为VK1和X射线联合治疗非小细胞肺癌提供了一定的实验依据。在放射治疗期间适当补充VK1,使体内VK1处于充足状态,可能会增强放射治疗对肿瘤细胞的杀伤效果。
综上所述,VK1对非小细胞肺癌细胞具有剂量依赖性抑制作用,其与X射线联合使用对非小细胞肺癌细胞具有协同抑制作用。然而,VK1增强X射线疗效的机制目前还不清楚,本研究仅对A549细胞的集落形成能力进行了研究,VK1对肿瘤细胞其他生物学特性(如细胞周期、凋亡、自噬以及增殖)的影响同样重要,也需要进行研究。此外,体外培养时细胞的增殖、生长以及生命力的体现均与体内环境有明显差异,因此,体内试验也有待进一步开展。
