基于小RNA深度测序技术鉴定侵染我国部分省市草莓种苗的病毒种类
2022-06-07王佳白莹雪祝宁齐长红任俊达韩成贵尚巧霞
王佳 白莹雪 祝宁 齐长红 任俊达 韩成贵 尚巧霞

摘要 随着草莓保护地栽培面积的增加和无性繁殖种苗的繁殖与调运,草莓病毒病的发生与流行日益严重。为明确侵染我国部分省市草莓种苗的病毒种类,应用小RNA深度测序技术进行检测,并利用RT-PCR技术对结果进行验证及序列分析。結果表明,从来自我国7省市的41株具有典型病毒病症状的草莓种苗样品中检测到草莓斑驳病毒strawberry mottle virus (SMoV)、草莓镶脉病毒strawberry vein banding virus(SVBV)和草莓轻型黄边病毒strawberry mild yellow edge virus (SMYEV)3种。SMoV、SVBV和SMYEV的检出率分别为34.1%、24.4%和2.4%。选取不同产地草莓种苗上检出的不同病毒进行部分序列测定和分析,获得了3个SMoV分离物(四川分离物schhy13、辽宁分离物lnhy23和河北分离物hbhy28)的部分RNA1 3′端非编码区606 bp核苷酸序列,其一致性为98.12%~99.34%。测定并获得了5个SVBV分离物(辽宁分离物lnhy15、lnhy17、lnhy24、河北分离物hbhy28和陕西分离物shaxhy35)的ORF6的部分基因及其5′端非编码区的核苷酸序列,其中部分ORF6基因序列的一致性为97.98%~99.8%。仅1个辽宁样品中检测到SMYEV,获得了辽宁分离物lnhy26,其CP基因序列与中国甘肃分离物sy02的一致性为99.02%。病毒侵染草莓植株产生的典型症状有叶片畸形、变色和植株矮化。存在2种病毒和3种病毒复合侵染的情况,占所有阳性样品的41.2%。辽宁和河北的‘红颜种苗中检出SMoV和SVBV或SMoV、SVBV和SMYEV的复合侵染情况;四川和陕西的‘红颜种苗仅检出SMoV或SVBV,而其他省市和品种均未检出病毒。研究结果可以为草莓病毒的检测以及草莓病毒病的科学防治提供依据。
关键词 草莓病毒病;小RNA深度测序技术;RT-PCR;病毒检测
中图分类号: S436.639
文献标识码: A
DOI: 10.16688/j.zwbh.2021079
Abstract With the increase of protected cultivation area, propagation and transportation of strawberry asexual reproductive seedlings between different regions are increasingly frequent, and the occurrence and prevalence of strawberry viral disease are also becoming more and more serious. To identify the viruses infecting strawberry plants from different provinces of China, small RNA deep sequencing assay was used to detect the viruses in strawberry seedling samples, and then the detected viruses were further verified by RT-PCR and sequence analysis. The results showed that strawberry mottle virus (SMoV), strawberry vein banding virus (SVBV) and strawberry mild yellow edge virus (SMYEV) were detected in 41 strawberry seedlings with typical symptoms from seven provinces of China. The positive rates of SMoV, SVBV and SMYEV detection were 34.1%, 24.4% and 2.4%, respectively. Strawberry seedling samples infected by different viruses from different regions were selected, from which the partial viral nucleotide sequences of the detected viruses were sequenced and analyzed. The partial 3′ UTR nucleotide sequences of RNA1 of three samples infected by SMoV from Sichuan, Liaoning and Hebei were sequenced, which was 606 bp in length. The partial SMoV nucleotide sequences among Sichuan isolate schhy13, Liaoning isolate lnhy23 and Hebei isolate hbhy28 shared identity from 98.12% to 99.34%. The sequences of partial ORF6 gene and its 5′ UTR of SVBV Liaoning isolates lnhy15, lnhy17, lnhy24, Hebei isolate hbhy28 and Shaanxi isolate shaxhy35 were obtained. The partial ORF6 gene nucleotide sequences of five SVBV samples shared identity from 97.98% to 99.8%. Only one sample with SMYEV was detected from Liaoning, and the CP gene sequence of Liaoning isolate lnhy26 shared identity of 99.02% with that of Gansu isolate sy02. Symptoms of strawberry plants infected by virus included leaf deformity, leaf discoloration and dwarf. The detection results showed that combined infection by two or three viruses existed, and the detection rate accounted for 41.2% of virus-positive samples. ‘Benihoppe seedlings from Liaoning and Hebei were simultaneously infected by SMoV and SVBV or SMoV, SVBV and SMYEV. ‘Benihoppe seedlings from Sichuan and Shaanxi were only infected by SMoV or SVBV, but no virus was detected in strawberry seedlings sampled from other provinces or in other varieties. This study provided important information and techniques for virus detection and strawberry viral disease management.1617EC4E-91A2-4AC0-96D3-3A8AA5458DFA
Key words strawberry viral disease;small RNA deep sequencing technology;RT-PCR;virus detection
草莓因具有种植周期短、投资少、经济收益高等优点成为重要的经济作物,在全球范围内广泛种植[1]。我国的草莓产业经过近40年的迅猛发展,生产面积和产量已跃居世界首位[2]。
在我国,草莓以冬春保护地栽培和依赖匍匐茎无性繁殖种苗为主,高温高湿的生长环境和无性繁殖的种植方式导致草莓斑驳病毒strawberry mottle virus (SMoV)、草莓镶脉病毒strawberry vein banding virus (SVBV)、草莓轻型黄边病毒strawberry mild yellow edge virus (SMYEV)和草莓皱缩病毒strawberry crinkle virus(SCV)引起的病毒病发生日益严重,同时伴有这些病毒的新株系和病毒种类产生,严重影响草莓的品质和产量,对草莓产业构成威胁[1,3-5]。2008年杨洪一等[6]从起源自我国甘肃的‘五叶草莓和自育的‘长虹2号中分离到1个SMYEV的新株系类型。2014年Chen等[7]首次报道黄瓜花叶病毒cucumber mosaic virus (CMV)对我国的草莓产业构成威胁,2017年Ding等[8]首次发现福建的草莓感染草莓白化病毒strawberry pallidosis-associated virus (SPaV)。
小RNA深度测序技术相对于ELISA和RT-PCR等检测方法,其结果更全面,也更易发现未知的病毒[9]。我国学者已利用该技术从福建和湖南等地的草莓上发现了一些新的病毒种类[8,10]。因此,笔者采用小RNA深度测序技术对来自北京、河北、辽宁、内蒙古、陕西、四川和云南的草莓种苗进行检测,并利用RT-PCR对检测结果进行验证,对所得序列进行比对分析,以明确我国不同省市草莓种苗病毒病的发生情况和病毒种类,为进一步繁育草莓脱毒种苗和病毒病的科学防控提供理论依据。
1 材料与方法
1.1 樣品采集
2019年11月27日,从北京市昌平区南邵镇草莓种植园采集41株具有明显畸形、矮化、斑驳和皱缩等典型病毒病症状的草莓种苗叶片样品,种苗的来源和品种包括产自北京的‘白雪公主(1株)和‘隋珠(4株),河北的‘光点(2株)、‘红颜(4株)和‘圣诞红(2株),辽宁的‘红颜(10株),内蒙古的‘红颜(2株),陕西的‘红颜(2株),四川的‘红颜(10株)和云南的‘圣诞红(4株)。
1.2 主要试剂
EASYspin植物RNA快速提取试剂盒、2×Taq PCR Mix购自北京爱博森生物科技有限公司;dNTPs、5×M-MLV逆转录反应缓冲液、M-MLV反转录酶、RNase抑制剂购自TaKaRa公司;DEPC水购自生工生物工程(上海)股份有限公司。
1.3 方法
1.3.1 具有典型病毒病症状的草莓种苗叶片样品的小RNA深度测序
文库构建、测序及原始数据整理:由北京优吉科技有限公司完成。提取41株具有典型病毒病症状的草莓种苗叶片样品的总RNA,并使用Agilent 2100和NanoDrop测定总RNA的浓度、完整性和纯度。质量合格的RNA样品采用NEBNext Multiplex Small RNA Library Prep Set for Illumina构建小RNA文库。先后在3′端和5′端加上接头,再反转录合成cDNA。然后用Qubit 2.0和实时荧光定量PCR对文库的浓度进行定量,并用Agilent 2100对文库的插入片段长度(insert size)进行检测。最后,使用Illumina Hiseq 2000测序平台对检测合格的小RNA文库进行测序。从获得的序列中筛除低质量、长度小于18 nt或大于40 nt、带polyA或polyN等条件的小RNA序列,获得有效数据(clean reads)[11]。使用PFOR软件和Velvet软件对clean reads中的序列进行拼接得到重叠群(contigs),与NCBI中的病毒数据库进行BLASTn和BLASTx比对分析并注释,获得可能存在的病毒序列信息。
对获得的病毒序列信息进行整理分析,初步确定感染病毒的草莓叶片样品,以及可能存在的病毒种类。
1.3.2 RT-PCR验证小RNA深度测序结果
1.3.2.1 草莓组织总RNA的提取
参照陈柳等[12]的方法从初步确定感染病毒的草莓叶片样品中提取总RNA。
1.3.2.2 RT-PCR
上述提取的总RNA进行反转录合成cDNA。以1.5 μL的总RNA为模板,加入随机引物 (9mer)(50 μmol/L)和Oligo(dT)18 Primer(50 μmol/L)各0.5 μL,dNTPs(10 mmol/L)2 μL,DEPC水将体系补至15.5 μL。65℃水浴5 min,冰浴5 min。向体系中加入5×M-MLV逆转录反应缓冲液4 μL,M-MLV反转录酶(100 U/μL)和RNase抑制剂(40 U/μL)各0.5 μL。42℃ 1 h,70℃ 15 min。合成的cDNA于-20℃保存。
根据小RNA深度测序确定的病毒种类,利用病毒的特异性引物(表1)对cDNA进行PCR扩增。扩增体系: cDNA模板2 μL,正向和反向引物(10 mmol/L)各1 μL,2×Taq PCR mix 12.5 μL,DEPC水将体系补至25 μL。PCR扩增程序: 94℃预变性 2 min;94℃变性 30 s,退火40 s(退火温度见表1),72℃延伸 60 s,共35个循环;最后72℃延伸5 min。取5 μL PCR产物用1%琼脂糖凝胶电泳检测。1617EC4E-91A2-4AC0-96D3-3A8AA5458DFA
SMoV[13]、SVBV[14]和SMYEV[15]的特异性引物由生工生物工程(上海)股份有限公司合成,分别能扩增出SMoV RNA1的3′端部分非编码区核苷酸序列、SVBV ORF6部分基因及其5′ 端非编码区核苷酸序列和SMYEV完整的外壳蛋白(coat protein, CP)基因及该基因两端部分非编码区核苷酸序列。
1.3.3 序列测定和分析比较
取目的条带明亮的PCR产物送交北京博迈德基因技术有限公司进行序列测定。测序结果在NCBI上与国内外已报道的相关序列进行同源性比对,并利用MEGA 7.0的邻接法构建系统发育树。
1.4 病毒检出率计算
统计检测样品中各种病毒的阳性样品数,并计算病毒检出率。病毒检出率=阳性样品数/总检测样品数×100%[16]。
2 结果与分析
2.1 小RNA深度测序检测结果
对41株具有典型病毒病症状的草莓种苗样品进行小RNA深度测序,经质量控制获得142 945 074条clean reads,其中长度为21、22 nt和24 nt的小RNA序列最多,分别占clean reads数量的50.35%、14.17%和12.13%。与NCBI中的病毒数据库比对结果显示,共有488 276条reads来自病毒,占clean reads数量的0.34%。
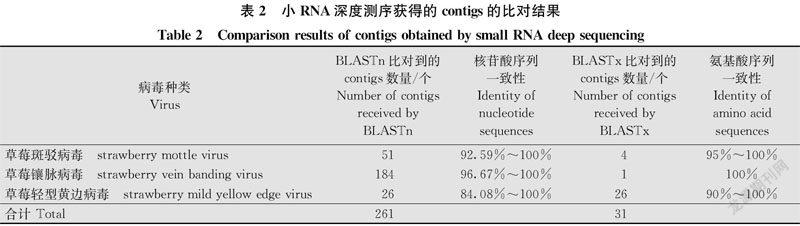
将长度为18~40 nt的序列拼接后获得16 202个contigs,经BLASTn比对分析表明,有261个contigs与SMoV、SVBV或SMYEV的核苷酸序列的一致性较高,未比对到其他植物病毒。其中51个contigs与SMoV核苷酸序列的一致性为92.59%~100%,184个contigs与SVBV核苷酸序列的一致性为96.67%~100%,26个contigs与SMYEV核苷酸序列的一致性为84.08%~100%。还有31个contigs利用BLASTn比对不到结果,使用BLASTx比对后显示,31个contigs与SMoV、SVBV或SMYEV的氨基酸序列具有较高的一致性,也未比对到其他的植物病毒。其中4个contigs与SMoV氨基酸序列的一致性为95%~100%,1个contigs与SVBV氨基酸序列的一致性为100%,26个contigs与SMYEV氨基酸序列的一致性为90%~100%(表2)。
2.2 RT-PCR检测结果
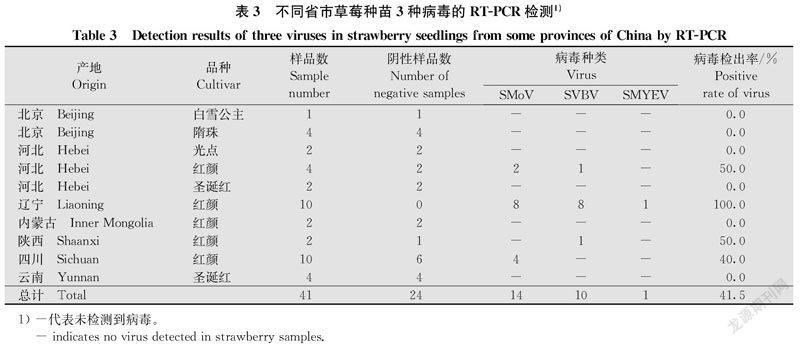
利用SMoV、SVBV和SMYEV的特异性引物对41株草莓种苗样品进行RT-PCR检测,并用DNAMAN和MEGA 7.0对获得的3种病毒分离物进一步分析,以验证小RNA深度测序结果的可靠性。结果表明,17份样品中检测到这3种病毒,总检出率为41.5%,SMoV、SVBV和SMYEV的检出率分别为34.1%、24.4%和2.4%(表3)。
2.2.1 SMoV不同分离物的序列分析
利用SMoV特异性引物SM6126F1/SM6732R1进行RT-PCR检测,可以扩增出约606 bp的目的片段,包含RNA1 3′端非编码区部分核苷酸序列。根据草莓种苗产地不同,选取不同阳性样品进行序列测定,获得SMoV四川分离物schhy13、辽宁分离物lnhy23和河北分离物hbhy28的序列,GenBank登录号分别为MW556623、MW556622和MW556621。利用DNAMAN进行序列比对分析,3个SMoV分离物的核苷酸序列一致性為98.12%~99.34%。与GenBank上已报道的核苷酸序列进行比对和系统进化分析表明,四川分离物schhy13、辽宁分离物lnhy23 和河北分离物hbhy28与加拿大分离物NB926序列(GenBank登录号:KU200453.1)的一致性较高,分别为97.68%、99.14%和98.19%;四川分离物schhy13和河北分离物hbhy28亲缘关系较近,与辽宁分离物lnhy23亲缘关系较远,形成两个独立的小分支(图1)。
2.2.2 SVBV不同分离物的序列分析
利用SVBV特异性引物SV5508F/SV6606R进行RT-PCR检测,可以扩增出SVBV约1 098 bp的目的片段,包含ORF6部分基因及其5′端非编码区的核苷酸序列。根据草莓种苗产地不同,选取不同地区草莓种苗阳性样品进行序列扩增,获得SVBV辽宁分离物lnhy15、lnhy17、lnhy24、河北分离物hbhy28和陕西分离物shaxhy35,GenBank登录号分别为MW556618、MW556617、MW556616、MW556619和MW556615。利用DNAMAN进行序列比对分析,5个SVBV分离物的部分ORF6基因序列一致性为97.98%~99.8%。与GenBank上已报道的基因序列比对分析,辽宁分离物lnhy15和lnhy17与北京分离物BJ1(GenBank登录号: KT250632.1)的核苷酸序列一致性分别为99.01%和99.42%;辽宁分离物lnhy24和河北分离物hbhy28与北京分离物BJHXTX1(GenBank登录号: MF197916.1)的核苷酸序列一致性分别为99.36%和99.44%;陕西分离物shaxhy35与贵州分离物GZ(GenBank登录号: MH894295.1)的核苷酸序列一致性为99.52%。系统进化树分析结果如图2所示,辽宁分离物lnhy15、lnhy17、lnhy24和河北分离物hbhy28亲缘关系较近,与陕西分离物shaxhy35亲缘关系较远,均与中国不同省市的分离物有较近的亲缘关系,而与美国和加拿大分离物亲缘关系较远。
2.2.3 SMYEV不同分离物的序列分析
利用SMYEV特异性引物YT1/Y2进行RT-PCR检测,可以扩增出SMYEV约861 bp的目的片段,包含完整的CP基因及该基因两端部分非编码区核苷酸序列[17]。仅获得1个辽宁分离物lnhy26的序列(GenBank登录号: MW556620),与GenBank的SMYEV CP基因进行序列比对和系统进化树分析,该分离物与中国甘肃分离物sy02(GenBank登录号: EU107084.1)的核苷酸序列一致性为99.02%,且亲缘关系较近(图3)。1617EC4E-91A2-4AC0-96D3-3A8AA5458DFA
2.3 草莓病毒病典型症状
经小RNA深度测序和RT-PCR检测不同地区草莓种苗的病毒侵染情况,结合表4中的田间症状调查结果表明,病毒单独侵染或2~3种病毒复合侵染时,草莓植株可表现出单一症状,也可同时表现出多种症状。被同一种病毒单独侵染的草莓植株表现出的症状也略有不同。主要症状如下:
叶片畸形:叶片皱缩;三出复叶的1~2片小叶生长较小(图4b-d)。
叶片变色:叶片呈不同程度的斑驳、镶脉或褪绿;叶脉变黑(图4b-f)。
植株矮化:株高较矮、叶片较小;叶柄细;长势弱(图4f)。
2.4 不同产地草莓种苗感染病毒的情况
对北京、河北、内蒙古、四川、辽宁、云南和陕西共7个省(市、自治区)生产的草莓种苗病毒病进行调查和检测,结果如表3所示。辽宁草莓种苗受病毒危害最为严重,病毒检出率高达100.0%,陕西、四川和河北种苗的检出率分别为50.0%、40.0%和25.0%,而北京、内蒙古和云南的草莓种苗未检测到病毒。
不同省市的草莓种苗检出病毒的种类也略有不同。调查结果显示,四川、辽宁和河北的草莓种苗中检出SMoV,辽宁、河北和陕西的种苗中检出SVBV,仅辽宁的种苗中检出SMYEV。病毒复合侵染发生较为严重,占总检出率的41.2%。辽宁和河北的草莓种苗中检出SMoV和SVBV两种病毒复合侵染,仅在1株辽宁草莓种苗中检出3种病毒复合侵染。
对不同省市的‘红颜‘白雪公主‘隋珠‘光点和‘圣诞红5个草莓品种调查发现,17个病毒阳性样品的品种均为‘红颜,而‘白雪公主 ‘隋珠‘光点和‘圣诞红均未检出病毒。
3 讨论
小RNA深度测序技术的出现提高了植物病毒病病原学的研究能力,该技术的原理是将植物被病毒侵染产生的源于病毒的特异小RNA分子序列进行拼接,以此来鉴定病毒种类[18]。此技术可快速、灵敏、全面检测植物体内已知和未知病毒的核酸分子,被广泛用于农作物、药用、园林和园艺植物病毒病的检测和鉴定[11,18-22]。但是,它用于单个样品的检测成本较高,也无法确定混合样品中感染病毒的具体样品,还会因较短的小RNA分子序列使比对结果产生一定程度的误判。因此,仍需要结合ELISA和RT-PCR等检测方法进行使用[23]。
本研究对来源于北京、河北、辽宁、内蒙古、陕西、四川和云南共7个省(市、自治区)的草莓种苗进行小RNA深度测序和生物信息学分析,并利用病毒特异性引物对检测结果进行RT-PCR验证。结果表明,侵染我国草莓种苗的病毒主要是SMoV、SVBV和SMYEV,且存在2种病毒和3种病毒复合侵染的情况。SMoV不同分离物的大外壳蛋白(large coat protein,CPL)基因和依赖RNA的RNA聚合酶(RNA-dependent RNA polymerase,RdRP)基因序列具有较大的差异,而3′非编码区的核苷酸序列较保守[24]。因此,测定了SMoV的RNA1 3′端非编码区部分核苷酸序列。经系统进化树分析,本文获得的SMoV四川分离物schhy13和河北分离物hbhy28与辽宁分离物lnhy23形成了两个不同的分支。SVBV中国不同分离物的核苷酸序列保守性相对较高,且ORF6编码的蛋白与寄主范围和症状表现有关[5,14]。因此,测定了不同省市SVBV分离物ORF6的部分基因序列。本文获得的5个SVBV分离物与GenBank中已登录的中国分离物形成一个独立的组群,与美国和加拿大分离物亲缘关系较远。上述SMoV和SVBV的分组差异可能与地理起源有关[24]。另外,仅在一个来自辽宁的样品中检测到SMYEV,通过测定其完整的CP基因及该基因两端部分非编码区核苷酸序列,SMYEV辽宁分离物lnhy26 的CP基因序列可能是与中国甘肃分离物sy02同属一个组群的新株系类型[6]。
被病毒单独侵染或2~3种病毒复合侵染的草莓植株可单独或同时表现出叶片畸形、叶片变色和植株矮化等症状,调查表明田间草莓植株表现出的症状与感染病毒的种类关系不明确。此现象的产生可能是病毒不同株系侵染后的症状略有不同;也可能是RT-PCR无法检出含量过低的病毒,使得检测结果不够准确;或是与水肥、药害、机械损伤等非病毒因素共同危害产生的[1,25]。在后续的研究中,可结合实时荧光定量PCR检测技术提高检测效率,使检测结果更加准确[1,26-27]。
不同省市的草莓种苗病毒检出情况差异显著,在四川、辽宁、河北和陕西种苗中检出病毒,而北京、内蒙古和云南种苗中未检出。其中,辽宁种苗的病毒检出率最高、病毒种类最多,可能与辽宁发展草莓种植业的时间早、规模大有关[28]。对不同品种进行病毒检测,仅在‘红颜中检出病毒,而‘白雪公主 ‘隋珠‘光点和‘圣诞红均未检出。可能是‘红颜作为重要的推广品种,因种植时间长、种植范围广导致病毒病发生严重[29]。本研究对不同产地草莓种苗检测的品种种类和数量不同,也可能对检测结果产生影响,今后会增加检测数量,进一步明确我国不同省市草莓种苗病毒病发生情况。
参考文献
[1] 王佳, 周宇, 祝宁, 等. 我国部分省市草莓种苗中黄瓜花叶病毒的检测分析[J]. 植物病理学报, 2020, 50(6): 649-656.
[2] 联合国粮食及农业组织. 粮食和农业数据[EB/OL]. [2021-01-30]http:∥www.fao.org/faostat/zh/#data/QC.
[3] 楊肖芳, 苗立祥, 张豫超, 等. 浙江省红颜草莓镶脉病毒(SVBV)的调查与茎尖脱毒技术研究[J]. 核农学报, 2015, 29(9): 1694-1700.
[4] 王丽红, 马俊文, 肖红, 等. 北方保护地草莓病害防治措施[J]. 中国果菜, 2019, 39(12): 95-98.1617EC4E-91A2-4AC0-96D3-3A8AA5458DFA
[5] 尚巧霞. 介体传播的草莓病毒研究进展[J]. 植物保护学报, 2015, 42(4): 488-496.
[6] 杨洪一, 代红艳, 李丽丽, 等. 草莓轻型黄边病毒3′末端序列多态性研究[J]. 植物病理学报, 2008, 38(1): 96-99.
[7] CHEN Liu, SHANG Qiaoxia, CHEN Xiaoyu, et al. First report on the occurrence of cucumber mosaic virus on Fragaria ananassa in China [J]. Plant Disease, 2014, 98(7): 1015.
[8] DING Xinlun, CHEN Dao, WANG Aiming, et al. First report of strawberry pallidosis-associated virus on strawberry in China [J]. Plant Disease, 2017, 101(12): 2154.
[9] 汤亚飞, 裴凡, 李正刚, 等. 基于小RNA深度测序技术鉴定侵染广东辣椒的病毒种类[J]. 中国农业科学, 2019, 52(13): 2256-2267.
[10]谢雪花. 小RNA深度测序鉴定草莓病毒的研究及草莓快繁体系的优化[D]. 长沙: 湖南农业大学, 2016.
[11]LIU Qili, LI Yongqiang, SONG Puwen, et al. Diversity of viruses infecting sweet potato in Beijing based on small RNA deep sequencing and PCR or RT-PCR detection [J]. Journal of General Plant Pathology, 2020, 86: 283-289.
[12]陳柳, 邢冬梅, 刘正雄, 等. 京郊设施蔬菜黄瓜花叶病毒的检测[J]. 中国农学通报, 2015, 31(20): 82-85.
[13]褚明昕, 魏然, 席昕, 等. 北京地区不同草莓品种5种主要病毒的检测[C]∥彭友良, 李向东. 中国植物病理学会2017年学术年会论文集. 北京: 中国农业科技出版社, 2017: 217.
[14]冉策. 京郊草莓病毒病调查及病毒检测技术应用[D]. 北京: 北京农学院, 2015.
[15]THOMPSON J R, JELKMANN W. Strain diversity and conserved genome elements in strawberry mild yellow edge virus [J]. Archives of Virology, 2004, 149(10): 1897-1909.
[16]王佳, 崔高峰, 祝宁, 等. 北京地区设施草莓8种病毒的酶联免疫吸附测定检测[J]. 微生物学通报, 2021, 48(3): 1048-1056.
[17]陈柳, 冉策, 尚巧霞, 等. 草莓轻型黄边病毒北京分离物的CP基因序列分析[J]. 中国农学通报, 2015, 31(3): 229-233.
[18]范旭东, 董雅凤, 张尊平, 等. ‘阳光玫瑰葡萄病毒小RNA测序鉴定及RT-PCR检测[J]. 植物病理学报, 2019, 49(6): 749-755.
[19]钱亚娟, 徐毅, 周琦, 等. 利用深度测序技术发掘植物病毒资源[J]. 中国科学: 生命科学, 2014, 44(4): 351-363.
[20]崔丽艳, 庞小静, 齐永红, 等. 利用小RNA深度测序技术鉴定半夏病毒病病原[J]. 中国生物化学与分子生物学报, 2018, 34(12): 1334-1341.
[21]苏秀, 徐毅, 陈莎, 等. 利用小RNA深度测序和组装技术鉴定紫藤花叶病病原[J]. 植物病理学报, 2015, 45(1): 88-92.
[22]HE Yan, YANG Zuokun, HONG Ni, et al. Deep sequencing reveals a novel closterovirus associated with wild rose leaf rosette disease [J]. Molecular Plant Pathology, 2015, 16(5): 449-458.
[23]刘晓璇, 李威霖, 张彤, 等. 番茄斑驳花叶病毒海南分离物全基因组序列分析[J]. 热带作物学报, 2019, 40(1): 139-144.
[24]杨洪一, 李丽丽, 代红艳, 等. 草莓斑驳病毒分子变异及PCR检测技术研究[J]. 中国农业科学, 2008, 41(7): 1983-1988.
[25]MRAZ I, PETRZIK K, FRNOV-HONETSLEGROV J, et al. Detection of strawberry vein banding virus by polymerase chain reaction and dot blot hybridization [J]. Acta Virologica, 1997, 41(4): 241-242.
[26]苗立祥, 荣宁宁, 张豫超, 等. 实时荧光定量PCR法检测草莓镶脉病毒[J]. 浙江农业学报, 2016, 28(6): 1030-1036.
[27]王建辉, 刘建军, 陈克玲, 等. 草莓轻型黄边病毒检测研究[J]. 西南农业学报, 2016, 29(12): 2866-2870.
[28]王玉坤, 张放, 祝庭耀. 国内草莓生产现状与发展趋势[J]. 北方园艺, 2003(6): 6-7.
[29]常琳琳, 董静, 钟传飞, 等. 中国育成草莓品种的系谱分析[J]. 果树学报, 2018, 35(2): 158-167.
(责任编辑:田 喆)1617EC4E-91A2-4AC0-96D3-3A8AA5458DFA
