褐飞虱对氟啶虫胺腈的抗性监测与生化抗性机制
2022-06-07裴新国张帅张彦超郑晨高聪芬吴顺凡
裴新国 张帅 张彦超 郑晨 高聪芬 吴顺凡
摘要 为明确我国褐飞虱田间种群对氟啶虫胺腈的抗性现状及生化抗性机制,2017年-2019年采用稻茎浸渍法测定了采集自7省共13个褐飞虱田间种群对氟啶虫胺腈的抗性,并研究了氟啶虫胺腈抗性种群与其他杀虫剂的交互抗性以及增效剂对氟啶虫胺腈的增效效果。结果表明:近3年来褐飞虱对氟啶虫胺腈产生了中等水平抗性(RR=10.3~30.9)。氟啶虫胺腈抗性品系对呋虫胺、噻虫嗪和烯啶虫胺分别产生了9.1倍、7.9倍和4.1倍的低水平交互抗性,与噻嗪酮、毒死蜱、吡蚜酮、三氟苯嘧啶和吡虫啉不存在交互抗性。增效剂PBO对氟啶虫胺腈抗性品系和浙江龙游19(Longyou-19)田间种群分别具有4.2倍和3.8倍的明显增效作用。综上,褐飞虱田间种群已对氟啶虫胺腈产生中等水平抗性。多功能氧化酶参与了褐飞虱对氟啶虫胺腈的代谢抗性。
关键词 褐飞虱;氟啶虫胺腈;抗药性监测;交互抗性;生化抗性机制
中图分类号: S435.112.3
文献标识码: A
DOI: 10.16688/j.zwbh.2021097
Abstract To understand the resistance status and mechanism of field populations of Nilaparvata lugens to sulfoxaflor, we determined the resistance to sulfoxaflor of 13 field populations of N. lugens collected from seven provinces in 2017-2019 by using the rice-stem dipping method. Cross-resistance and synergism tests were also investigated in this study. The results showed that all of the field populations had developed moderate resistance to sulfoxaflor (resistance ratio=10.3-30.9). Compared with the sensitive strain (SUL-S), the selected SUL-R strains showed low-level cross-resistance to dinotefuran, thiamethoxam and nitenpyram (9.1-fold, 7.9-fold and 4.1-fold, respectively). No cross-resistance to buprofezin, chlorpyrifos, pymetrozine, triflumezopyrim and imidacloprid was detected. Bioassays revealed that the P450 inhibitor, piperonyl butoxide (PBO) had 4.2-fold and 3.8-fold synergistic effects on sulfoxaflor to sulfoxaflor-resistant strains and field strains(Longyou-19). Our results indicated that all of the populations developed moderate resistance to sulfoxaflor. Enhanced metabolism mediated by cytochrome P450 monooxygenases was involved in the resistance of N. lugens to sulfoxaflor.
Key words Nilaparvata lugens;sulfoxaflor;resistance monitoring;cross-resistance;biochemical resistance mechanisms
褐飞虱Nilaparvata lugens (Stl) 属于半翅目飞虱科,是威胁我国水稻安全生产的重要害虫[1]。褐飞虱主要以刺吸和产卵为害水稻,其分泌物覆盖植物表面也会影响水稻的光合作用。此外褐飞虱还可传播水稻病毒病如草状矮缩病和齿叶矮缩病等[2]。目前对褐飞虱的防治主要依赖于化学农药,然而长期、大量、不科学地使用杀虫剂使得褐飞虱田间种群对多种常用杀虫剂产生了不同程度的抗性,导致杀虫剂的田间防治效果显著下降[3]。吡虫啉于20世纪90年代初进入我国市场后,以其优异的防治效果,迅速成为我国防治褐飞虱的主要药剂。但由于吡虫啉的不科学使用,导致我国褐飞虱对吡虫啉产生了高水平抗性,并致使2005年我国南方稻区褐飞虱的大暴发,造成了巨大经济损失[4],故2005年全国农业技术推广服务中心发文建议暂停使用吡虫啉防治褐飞虱[5]。吡虫啉停用后,噻嗪酮的用药量持续增加,2013年监测的13个田间褐飞虱种群对噻嗪酮均达到高水平抗性(100.8~247.5倍),2014年该药剂被暂停用于褐飞虱防治,同样由于抗性持续升高,2016年噻虫嗪在褐飞虱防治中暂停使用[6]。抗药性问题给褐飞虱的科学有效治理带来严峻挑战,而研发高效、低毒农药需要较长时间。因此,科学合理地使用现有杀虫剂,延缓其抗性发展对褐飞虱防控至关重要。
氟啶虫胺腈是美国陶氏益农公司开发的一种新型煙碱类杀虫剂,具有独特的亚砜亚胺基团,因此也被称为磺酰亚胺类杀虫剂[7]。按照其作用机制,氟啶虫胺腈被杀虫剂抗性行动委员会(Insecticide Resistance Action Committee, IRAC)归为Group 4家族烟碱型乙酰胆碱受体竞争性调节剂(nAChR competitive modulators)。由于其在化学结构和代谢抗性机制上区别于传统新烟碱类杀虫剂(Group 4a),如吡虫啉和烯啶虫胺等,而将其归为Group 4c,并且其为该组中唯一的有效成分[8]。氟啶虫胺腈在植物体内具有较好的渗透性和内吸性,同时对害虫也有一定的触杀作用,可有效防治褐飞虱、粉虱、蚜虫、蓟马等害虫[9]。随着氟啶虫胺腈的广泛使用,害虫对该药剂的抗性也见诸报道。氟啶虫胺腈于2013年5月在中国获得临时登记并应用于褐飞虱的防治。室内毒力测定显示,氟啶虫胺腈对褐飞虱的速效性较好,但持效性差于其他新烟碱类杀虫剂[10]。笔者实验室从2014年起开展了长江中下游和华南稻区褐飞虱对氟啶虫胺腈的抗性监测,连续多年的监测结果显示,2014年褐飞虱对氟啶虫胺腈的抗性处于敏感水平,2015年-2016年褐飞虱对氟啶虫胺腈已产生低至中等水平抗性(7.8~25.9倍)[6]。Liao等监测了2013年-2016年华中和华南稻区的褐飞虱对氟啶虫胺腈的抗性,发现褐飞虱对氟啶虫胺腈处于敏感性降低至低水平抗性(0.8~6.8倍)[11],随后在2017年-2018年的监测中,华南和华中稻区褐飞虱对氟啶虫胺腈的抗性依旧维持在敏感至低水平抗性(3.3~8.5倍)[12]。除褐飞虱外,2015年采集自北京昌平、江苏南京、福建宁德和河南洛阳的桃蚜Myzus persicae已对氟啶虫胺腈产生中等至高水平抗性(69~176倍)[13]。2019年采集自河北、山西、山东、河南、江苏和湖北的麦长管蚜Sitobion miscanthi(5.1~12倍)和禾谷缢管蚜Rhopalosiphum padi(6.3~19倍) 对氟啶虫胺腈均表现出低至中等水平抗性[14]。另外,2017年采集自山东滨州、山西运城和湖北荆州的棉蚜Aphis gossypii已对氟啶虫胺腈产生低至中等水平抗性(1.1~11.2倍)[15]。因此,要密切关注田间害虫对氟啶虫胺腈的抗性发展,为害虫抗药性治理提供帮助。
害虫对杀虫剂产生抗性的原因主要包括4个方面:一是杀虫剂穿透昆虫表皮的速率下降(穿透抗性,cuticular resistance)[16];二是昆虫的解毒代谢酶活性增强(代谢抗性,metabolic resistance)[17];三是靶标部位对杀虫剂的敏感性降低(靶标抗性,target-protein resistance)[18];四是杀虫剂被化学感受蛋白隔离(chemosensory protein sequestration)[19]。其中解毒代谢酶在害虫抗药性中发挥的作用较为普遍[17]。常见的与害虫抗药性相关的解毒代谢酶主要有3种,分别是多功能氧化酶、谷胱甘肽S-转移酶和羧酸酯酶。Vontas等发现在抗有机磷和氨基甲酸酯类杀虫剂的褐飞虱品系中,羧酸酯酶基因表达显著上调[20]。羧酸酯酶也介导了灰飞虱Laodelphax striatellus对毒死蜱的抗性[21]。谷胱甘肽S-转移酶的活性增强使得褐飞虱对拟除虫菊酯类杀虫剂的抗性增强[22]。在3种解毒酶中,多功能氧化酶介导了褐飞虱对多种杀虫剂的抗性[23]。Liu等[24]通过增效剂试验证实P450单加氧酶活性增加是褐飞虱对吡虫啉产生抗性的重要原因。Bass等[25]和Wu等[6]发现CYP6ER1可介导褐飞虱对吡虫啉和噻嗪酮的抗性,此外Bao等[26]发现除CYP6ER1外,CYP6AY1也参与褐飞虱对吡虫啉的代谢抗性。Mao等[27]报道了CYP6ER1在抗烯啶虫胺褐飞虱品系中高表达,Jin等[28]在噻虫胺抗性褐飞虱种群中发现CYP6ER1高表达。Liao等证明CYP6ER1在褐飞虱对氟啶虫胺腈的抗性中起重要作用[29]。由此可知,害虫的生化抗性在其抗性机制中扮演了举足轻重的角色,了解害虫的抗药性机制才能更有针对性地开展害虫抗药性治理工作。
为明确我国当前褐飞虱田间种群对氟啶虫胺腈的抗性现状、抗性发展动态及其抗性机制,笔者于2017年-2019年采用稻茎浸渍法,监测了我国7省13个地区的褐飞虱田间种群对氟啶虫胺腈的抗性,并进行了褐飞虱对氟啶虫胺腈的抗性筛选、交互抗性测定及增效剂对氟啶虫胺腈的增效作用等相关研究。以期为该药剂在褐飞虱的田间防治及抗药性治理提供依据。
1 材料与方法
1.1 供试昆虫
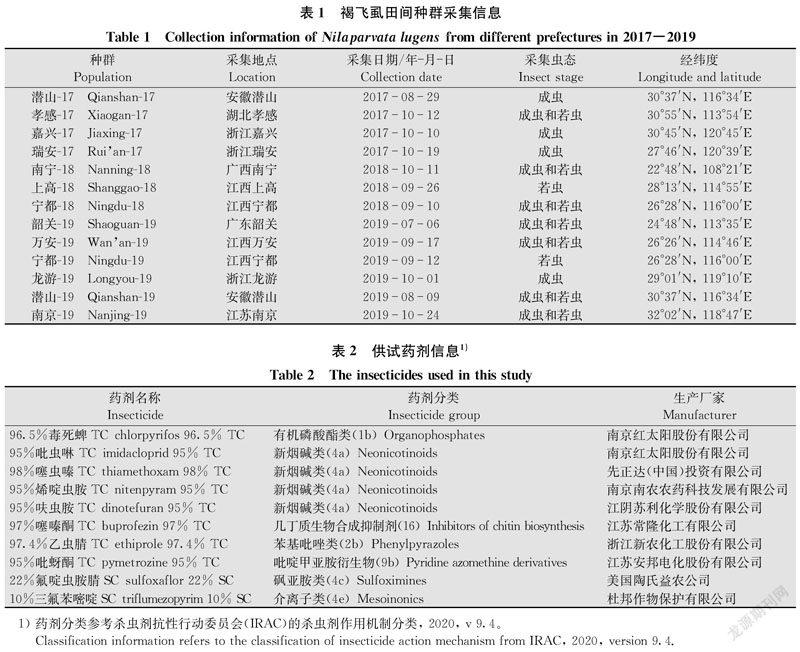
褐飞虱田间种群:2019年7月-10月,分别从我国7省(市)13个地区采集褐飞虱若虫或成虫(表1),在室内用籼稻(‘TN-1’) 植株在不接触任何药剂的状态下饲养,取室内F1或F2代的3龄中期若虫供试;氟啶虫胺腈敏感品系(SUL-S):2013年8月采自浙江省金华市,之后在不接触任何药剂的条件下在本实验室籼稻上饲养至今;氟啶虫胺腈抗性筛选品系(SUL-R):从2014年4月开始,在室内采用稻苗浸渍法对浙江金华褐飞虱种群进行连续63代的抗性筛选后获得;抗氟啶虫胺腈褐飞虱田间种群(Longyou-19):于2019年10月采自浙江省龙游县。
所有褐飞虱均在培养箱中饲养,饲养条件为:温度(27±1)℃,湿度(70±10)%,光周期L∥D=16 h∥8 h。
1.2 供试药剂
供试杀虫剂信息如表2所示。试验前22%氟啶虫胺腈悬浮剂(SC)和10%三氟苯嘧啶悬浮剂(SC)直接用水稀释,其余药剂先以丙酮为溶剂配制成1%或2%的高浓度母液,其中吡蚜酮以二甲基亚砜为溶剂配制,以上配制好的母液置于4℃冰箱保存。99.5%二甲基亚砜购自广东光华科技股份有限公司。多功能氧化酶抑制剂(piperonyl butoxide, PBO) 由江苏龙灯化学有限公司提供;谷胱甘肽S-转移酶抑制剂(diethyl maleate, DEM) 由上海晶纯试剂有限公司提供;羧酸酯酶抑制剂(triphenyl phosphate, TPP) 由上海凌峰化学试剂有限公司提供;表面活性剂:99.7%Triton X-100,由北京索莱宝生物技术有限公司提供。
1.3 试验方法
1.3.1 生物活性测定
参考褐飞虱抗药性监测技术规程(NY/T1708-2009) 建立的稻茎浸渍法,对褐飞虱进行室内毒力测定。具体过程为:带根拔起健壮的分蘖期稻株,洗净,剪成约10 cm长的带根稻茎,3株1组,于荫凉处晾干;将供试药剂的母液用含0.1%的Triton X-100的水溶液等比稀释为5个系列浓度(制剂直接用水稀释),将稻茎分别在相应浓度的药液中浸泡30 s,以不含药剂的处理作为空白对照,每浓度3个重复,取出置于荫凉处晾干,以浸湿的脱脂棉包住根部放入塑料杯中,接入生长发育一致且活力较强的3龄中期若虫,每杯15头;静置1~2 h后,把试验装置放入温度为(27±1)℃,光周期为L∥D=16 h∥8 h,湿度为(70±10)%的人工气候培养箱中饲养。根据氟啶虫胺腈的作用特性,观察时间为4 d,记录死亡虫数。
1.3.2 抗药性筛选
以2013年采自浙江金华的褐飞虱品系作为抗性筛选的初始品系,一部分试虫进行抗性筛选,另一部分试虫在不接触任何药剂的正常环境中进行饲養,作为氟啶虫胺腈敏感品系(SUL-S)。褐飞虱的抗性筛选采用稻苗浸渍法。以上一代抗性选育的LC50为筛选浓度,配制好药液后,将在培养箱内生长6 d,高度为5~10 cm的稻苗约400株连根一起在上述浓度药液中浸30 s,取出放置在室内阴凉处 30 min,至无药液滴下后置于垫有脱脂棉的1 000 mL烧杯中。每个烧杯接入试虫(3龄若虫) 300头左右,将烧杯放入恒温培养箱中。96 h后将活虫转移至未经药剂处理的新鲜稻苗中。每代筛选试虫量以及装有浸过药的稻苗烧杯的数量根据当代种群大小而异,每代筛选虫数为2 000~3 000头,每代在用药筛选前需采用稻茎浸渍法测定LC50,方法见1.3.1。
1.3.3 交互抗性评估
分别测定氟啶虫胺腈敏感种群(SUL-S) 和抗性种群(SUL-R) 对其他不同药剂的敏感性,采用稻茎浸渍法进行生物测定,方法见1.3.1。
1.3.4 增效剂测定
在增效剂试验中,由于3龄若虫在点滴时不易控制对照的存活率,故采用健康活力强,大小一致的褐飞虱5龄若虫(SUL-S、SUL-R、龙游19),每15头1组,使用CO2麻醉處理10 s后立即使用手动微量点滴器(使用体积为0.044 μL)将增效剂(PBO、DEM、TPP)分别点滴至褐飞虱的前胸背板上,点滴等量的丙酮作为对照。根据预试验结果确定PBO、DEM和TPP的最大无作用剂量分别为0.44、2.2 μg/头和2.2 μg/头,3种增效剂均以丙酮作为溶剂。试虫经增效剂处理1 h后,采用稻茎浸渍法进行毒力测定,方法见1.3.1。
1.4 数据分析
采用POLO-Plus数据统计软件计算毒力回归曲线、斜率b值及标准误、LC50及95%置信限、卡方值(χ2) 及自由度(df)。抗性倍数的计算为:抗性倍数(resistance ratio, RR)=所测种群的LC50/敏感种群LC50,其中氟啶虫胺腈敏感基线为:LC50=0.49 mg/L [6]。抗性水平分级标准:抗性倍数(RR)≤5为敏感;5 < RR≤10为低水平抗性;10 < RR≤100为中等水平抗性;RR >100为高水平抗性。增效倍数的计算为:增效倍数(SR)=氟啶虫胺腈的LC50/(氟啶虫胺腈+增效剂) 的LC50。
2 结果与分析
2.1 褐飞虱田间种群对氟啶虫胺腈的抗性水平
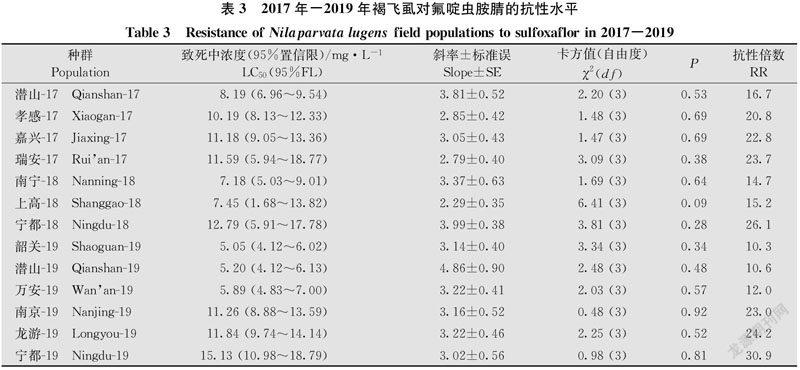
2017年-2019年共监测我国7省13个褐飞虱田间种群对氟啶虫胺腈的抗性水平,结果显示:2017年,所监测的潜山、孝感等共4个褐飞虱田间种群对氟啶虫胺腈已达到中等水平抗性(RR=16.7~23.7倍);2018年,所监测的南宁、上高、宁都褐飞虱种群对氟啶虫胺腈的抗性同样均为中等水平抗性(RR=14.7~26.1倍);2019年,所监测的韶关、潜山等6个褐飞虱种群均为中等水平抗性(RR=10.3~30.9倍)(表3)。从3年的监测结果来看,我国褐飞虱田间种群对氟啶虫胺腈的抗性均处于中等抗性水平,田间褐飞虱种群对氟啶虫胺腈的抗性整体略有上升。
2.2 氟啶虫胺腈抗性品系筛选
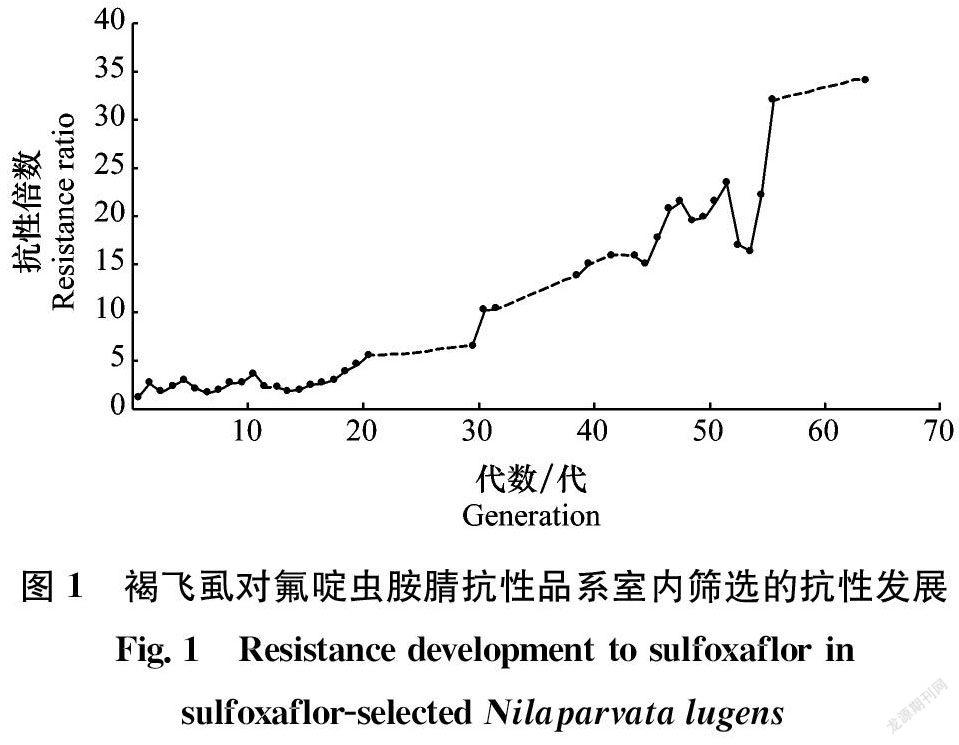
在室内,用氟啶虫胺腈对褐飞虱进行了63代不间断的药剂筛选,筛选压力控制在每代试虫死亡率为15%~40%,获得了氟啶虫胺腈室内抗性品系(SUL-R),其抗性倍数为34.1倍。如图1所示,在前30代筛选过程中LC50从0.54 mg/L上升为3.20 mg/L,抗性上升速度发展相对缓慢,仅为低水平抗性(RR=6.5倍);当筛选至30代时,褐飞虱对氟啶虫胺腈的抗性由低水平发展至中等水平(RR=10.2倍);随后的25代筛选,抗性上升速度发展较快,LC50从5.07 mg/L (G25)上升为15.67 mg/L (G55);第55代后抗性发展出现了上下波动,但整体抗性发展较为缓慢,稳定在中等水平抗性。图中虚线部分为只进行了药剂筛选未进行相应的生物测定。结果表明褐飞虱在药剂持续筛选的压力下,会对氟啶虫胺腈产生抗性,具有抗性风险。
2.3 交互抗性
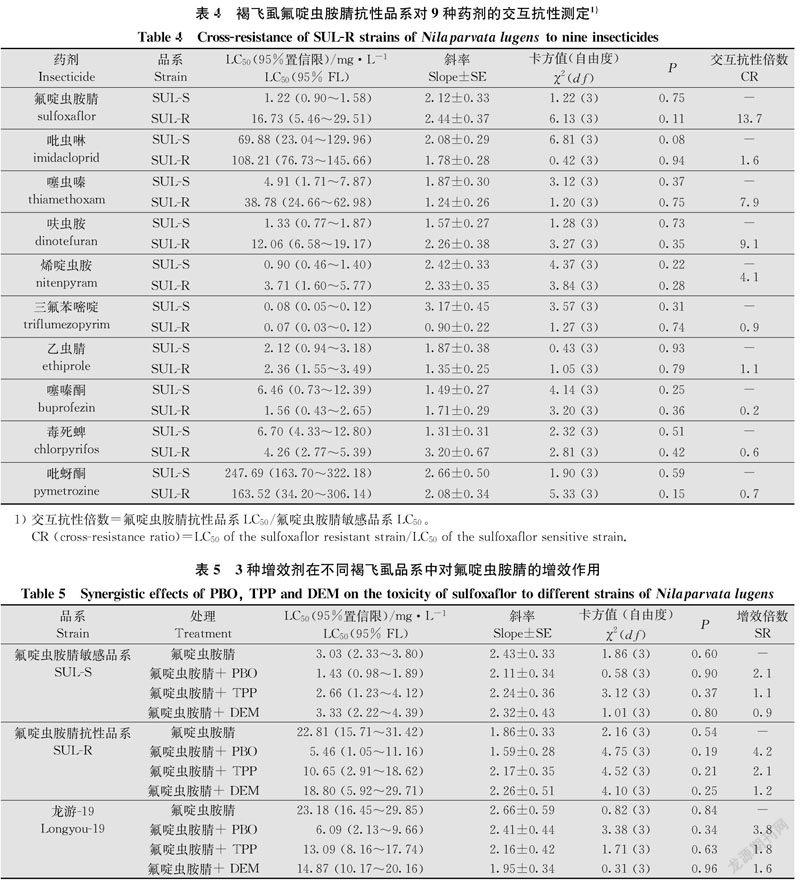
采用稻茎浸渍法分别测定了氟啶虫胺腈敏感品系(SUL-S)和氟啶虫胺腈抗性品系(SUL-R)对氟啶虫胺腈、吡虫啉、噻虫嗪、呋虫胺、烯啶虫胺、三氟苯嘧啶、乙虫腈、噻嗪酮、毒死蜱及吡蚜酮的敏感性。结果显示:与氟啶虫胺腈敏感品系相比,抗性品系对呋虫胺、噻虫嗪和烯啶虫胺产生了低水平的交互抗性,交互抗性倍数分别为9.1倍、7.9倍和4.1倍;与噻嗪酮、毒死蜱、吡蚜酮、乙虫腈、三氟苯嘧啶以及吡虫啉等药剂不存在交互抗性(表4)。
2.4 增效剂对氟啶虫胺腈的增效作用
多功能氧化酶抑制剂PBO对氟啶虫胺腈敏感品系(SR=2.1倍)、抗性品系(SR=4.2)和褐飞虱田间抗性种群(SR=3.8倍)均有明显增效作用,但在抗性品系(SUL-R)和田间抗性种群(龙游-19)中增效作用更大;羧酸酯酶抑制剂TPP在氟啶虫胺腈敏感品系(SR=1.1倍)、抗性品系(SR=2.1倍)和田间抗性种群(SR=1.8倍)中增效作用不明显;谷胱甘肽S-转移酶抑制剂DEM在氟啶虫胺腈敏感品系(SR=0.9倍)、抗性品系(SR=1.2倍)和田间抗性种群(SR=1.6倍)中同样未表现出明显的增效作用(表5)。增效剂试验表明多功能氧化酶参与了褐飞虱对氟啶虫胺腈的代谢抗性。
3 讨论
对田间害虫进行抗药性监测是指导田间用药的重要基础。本研究结果显示,2017年-2019年,所监测的褐飞虱田间种群对氟啶虫胺腈的抗性均处于中等水平抗性。通过不间断的室内抗性选育,获得了抗氟啶虫胺腈的褐飞虱种群。交互抗性研究显示,抗氟啶虫胺腈褐飞虱对呋虫胺、噻虫嗪和烯啶虫胺产生了低水平的交互抗性,与噻嗪酮、毒死蜱、吡虫啉、乙虫腈和三氟苯嘧啶不存在明显交互抗性。同时增效剂试验证明,多功能氧化酶参与了褐飞虱对氟啶虫胺腈的抗性。
目前,化学防治依然是害虫控制的重要手段。吡虫啉自20世纪90年代被引入我国后直到2003年,褐飞虱对该药剂一直处于敏感至低水平抗性阶段 (最高为1997年桂林种群的 6.3倍),2005年褐飞虱对吡虫啉的抗性急剧升高至中等到高水平,次年监测的所有种群均达到高水平抗性[4]。相较来看,氟啶虫胺腈自2013年获得临时登记以来,短短2年时间,多数田间褐飞虱种群就对其产生了中等水平抗性[6]。从本次的监测结果来看,90%的种群已达到中等水平抗性,且抗性水平呈现出上升的趋势。田间种群对氟啶虫胺腈的抗性已经超过了室内筛选种群。我们认为存在以下几点原因:已有研究证明多种药剂在褐飞虱体内和氟啶虫胺腈存在交互抗性[29],这些药剂对褐飞虱间种群共同施加了选择压力,使得田间种群对氟啶虫胺腈抗性发展速度加快;另外,田间种群遗传背景复杂、个体间差异大,这也给抗性基因频率的增加提供了有利条件。因此,密切关注田间褐飞虱种群的抗药性变化,对氟啶虫胺腈的抗性治理至关重要。
害虫的交互抗性是指一种害虫对某一种杀虫剂产生抗性之后,对从未使用过的结构相似或者具有相同作用机理的化学农药也表现出抗性的现象[30]。Liao等[29]的研究发现当褐飞虱对氟啶虫胺腈产生高水平抗性时,对噻虫嗪、呋虫胺、烯啶虫胺、噻虫胺也产生了高水平的交互抗性,对吡虫啉和环氧虫啶表现出中等水平的交互抗性,而对毒死蜱、醚菊酯、异丙威交互抗性较低,没有发现对噻嗪酮和三氟苯嘧啶存在交互抗性。我们在Liao等的研究之外又增加了两种不同类型的杀虫剂 (吡蚜酮和乙虫腈),发现当褐飞虱对氟啶虫胺腈产生中等水平抗性时,对吡蚜酮、乙虫腈无明显的交互抗性。与Liao等[29]的结果不同的是本研究并未发现氟啶虫胺腈与吡虫啉等药剂有明显的交互抗性,这可能与我们筛选的原始种群为田间种群,其已对吡虫啉产生了高水平抗性有关。另外,氟啶虫胺腈与其他新烟碱类杀虫剂相比,其作用位点独特,也可能造成抗氟啶虫胺腈品系对吡虫啉不产生交互抗性。有研究显示田间对吡虫啉高抗的烟粉虱Bemisia tabaci和温室白粉虱Trialeurodes vaporariorum与氟啶虫胺腈无显著交互抗性[31]。但本研究结果表明氟啶虫胺腈与其他新烟碱类杀虫剂会产生交互抗性但交互抗性水平不高,其原因可能是褐飞虱体内解毒酶活性增强所致。结合本文研究,建议在田间使用氟啶虫胺腈防治褐飞虱时,应避免与除三氟苯嘧啶外的其他新烟碱类杀虫剂混合使用,可与毒死蜱、乙虫腈、吡蚜酮或三氟苯嘧啶混用或交替輪换使用。
代谢酶或解毒酶活性增高是害虫常见的抗性机制。Liao等的研究发现当褐飞虱对氟啶虫胺腈产生高水平抗性时,PBO表现出显著的增效作用[29]。解毒酶活性试验中除多功能氧化酶外,羧酸酯酶活性也在抗性品系中显著增强,即褐飞虱对氟啶虫胺腈的抗性可能与其体内多功能氧化酶和羧酸酯酶的活性增强相关[29];同样在我们的增效剂试验中,PBO在抗性种群中表现出的增效作用最为明显(4.2倍),同时还发现PBO在氟啶虫胺腈敏感品系中也存在明显的增效作用(2.1倍),此外,PBO对田间抗氟啶虫胺腈种群(龙游-19)也具有明显的增效作用(3.8倍),进一步证明了多功能氧化酶参与褐飞虱对氟啶虫胺腈的抗性产生。未来可进一步明确是哪些P450酶基因参与了褐飞虱对氟啶虫胺腈的代谢抗性。
参考文献
[1] 程遐年, 吴进才, 马飞. 褐飞虱研究与防治[M]. 北京: 中国农业出版社, 2003: 26-32.
[2] NAULT L R, AMMAR E D. Leafhopper and planthopper transmission of plant viruses [J]. Annual Review of Entomology, 2003, 34(1): 503-529.
[3] ZHANG Yanchao, FENG Zerui, ZHANG Shuai, et al. Baseline determination, susceptibility monitoring and risk assessment to triflumezopyrim in Nilaparvata lugens (Stl) [J/OL]. Pesticide Biochemistry and Physiology, 2020, 167: 104608. DOI: 10.1016/j.pestbp.2020.104608.
[4] WANG Yanhua, GAO Congfen, ZHU Yucheng, et al. Imidacloprid susceptibility survey and selection risk assessment in field populations of Nilaparvata lugens (Homoptera: Delphacidae) [J]. Journal of Economic Entomology, 2008, 101(2): 515-522.
[5] 全国农业技术推广服务中心农药药械处.农技植保函(2005)270号:关于中晚稻褐飞虱对吡虫啉抗药性情况的通报[EB/OL]. (2005-09-28) [2022-03-01]. http:∥www.zjagri.gov.cn/html/zwbh/plantProtectView/2006012551343.html2005.
[6] WU Shunfan, ZENG Bin, ZHENG Chen, et al. The evolution of insecticide resistance in the brown planthopper (Nilaparvata lugens Stl) of China in the period 2012-2016 [J/OL]. Scientific Reports, 2018, 8(1): 4586. DOI: 10.1038/s41598-018-22906-5.
[7] NUGENT B M, BUYSSE A M, LOSO M R, et al. Expanding the structure-activity relationship of sulfoxaflor: the synthesis and biological activity of N-heterocyclic sulfoximines [J]. Pest Management Science, 2015, 71(7): 928-936.
[8] SPARKS T C, WATSON G B, LOSO M R, et al. Sulfoxaflor and the sulfoximine insecticides: Chemistry, mode of action and basis for efficacy on resistant insects[J]. Pesticide Biochemistry and Physiology, 2013, 107(1): 1-7.
[9] BABCOCK J M, GERWICK C B, HUANG J X, et al. Biological characterization of sulfoxaflor, a novel insecticide [J]. Pest Management Science, 2011, 67(3): 328-334.
[10]何佳春, 李波, 謝茂成, 等. 新烟碱类及其他稻田杀虫剂对褐飞虱的室内药效评价[J].中国水稻科学, 2019, 33(5): 467-478.
[11]LIAO Xun, MAO Kaiai, ALI E, et al. Temporal variability and resistance correlation of sulfoxaflor susceptibility among Chinese populations of the brown planthopper Nilaparvata lugens (Stl) [J]. Crop Protection, 2017, 102: 141-146.
[12]LIAO Xun, XU Pengfei, GONG Peipan, et al. Current susceptibilities of brown planthopper Nilaparvata lugens to triflumezopyrim and other frequently used insecticides in China [J]. Insect Science, 2021, 28(1):115-126.
[13]张帅. 2015年全国农业有害生物抗药性监测结果及科学用药建议[J]. 中国植保导刊, 2016, 36(3): 61-65.
[14]张帅. 2019年全国农业有害生物抗药性监测结果及科学用药建议[J]. 中国植保导刊, 2020, 40(3): 64-69.
[15]MA Kangsheng, TANG Qiuling, XIA Jin, et al. Fitness costs of sulfoxaflor resistance in the cotton aphid, Aphis gossypii Glover [J]. Pesticide Biochemistry and Physiology, 2019, 158: 40-46.
[16]FANG Fujin, WANG Weijie, ZHANG Donghui, et al. The cuticle proteins: a putative role for deltamethrin resistance in Culex pipiens Pallens [J]. Parasitology Research, 2015, 114(12): 4421-4429.
[17]LI Xianchun, SCHULER M A, BERENBAUM M R. Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics [J]. Annual Review of Entomology, 2007, 52: 231-253.
[18]HUANG Jingmei, RAO Cong, WANG Shuai, et al. Multiple target-site mutations occurring in lepidopterans confer resistance to diamide insecticides [J/OL]. Insect Biochemistry and Molecular Biology, 2020, 121:103367. DOI: 10.1016/j.ibmb.2020.103367.
[19]INGHAM V A, ANTHOUSI A, DOURIS V, et al. A sensory appendage protein protects malaria vectors from pyrethroids [J]. Nature, 2020, 577(7790): 376-380.
[20]VONTAS J G, SMALL G J, HEMINGWAY J. Comparison of esterase gene amplification, gene expression and esterase activity in insecticide susceptible and resistant strains of the brown planthopper, Nilaparvata lugens (Stl) [J]. Insect Molecular Biology, 2000, 9(6): 655-660.
[21]ZHANG Yueliang, WANG Lihua, GUO Huifang, et al. A transcriptome-based screen of carboxylesterase-like genes that are involved in chlorpyrifos resistance in Laodelphax striatellus (Fallén) [J]. Pesticide Biochemistry and Physiology, 2012, 4(3): 224-228.
[22]VONTAS J G, SMALL G J, HEMINGWAY J. Glutathione S-transferases as antioxidant defence agents confer pyrethroid resistance in Nilaparvata lugens [J]. Biochemical Journal, 2001, 357(1): 65-72.
[23]ZIMMER C T, GARROOD W T, SINGH K S, et al. Neofunctionalization of duplicated P450 genes drives the evolution of insecticide resistance in the brown planthopper [J]. Current Biology, 2018, 28(2): 268-274.
[24]LIU Zewen, HAN Zhaojun, WANG Yinchang, et al. Selection for imidacloprid resistance in Nilaparvata lugens: cross-resistance patterns and possible mechanisms [J]. Pest Management Science, 2003, 59(12):1355-1359.
[25]BASS C, CARVALHO R A, OLIPHANT L, et al. Overexpression of a cytochrome P450 monooxygenase, CYP6ER1, is associated with resistance to imidacloprid in the brown planthopper, Nilaparvata lugens [J]. Insect Biochemistry and Molecular Biology, 2011, 20: 763-773.
[26]BAO Haibo, GAO Hongli, ZHANG Yixi, et al. The roles of CYP6AY1 and CYP6ER1 in imidacloprid resistance in the brown planthopper: Expression levels and detoxification efficiency [J]. Pesticide Biochemistry and Physiology, 2016, 129: 70-74.
[27]MAO Kaiai, ZHANG Xiaolei, ALI E, et al. Characterization of nitenpyram resistance in Nilaparvata lugens (Stl) [J]. Pesticide Biochemistry and Physiology, 2019, 157: 26-32.
[28]JIN Ruoheng, MAO Kaiai, LIAO Xun, et al. Overexpression of CYP6ER1 associated with clothianidin resistance in Nilaparvata lugens (Stl) [J]. Pesticide Biochemistry Physiology, 2019, 154: 39-45.
[29]LIAO Xun, JIN Ruoheng, ZHANG Xiaolei, et al. Characterization of sulfoxaflor resistance in the brown planthopper, Nilaparvata lugens (Stl) [J]. Pest Management Science, 2019, 75(6): 1646-1654.
[30]沈晉良,吴益东. 棉铃虫抗药性及其治理[M]. 北京: 中国农业出版社, 1995: 25-280.
[31]LONGHURST C, BABCOCK J M, DENHOLM I, et al. Cross-resistance relationships of the sulfoximine insecticide sulfoxaflor with neonicotinoids and other insecticides in the whiteflies Bemisia tabaci and Trialeurodes vaporariorum [J]. Pest Management Science, 2013, 69(7): 809-813.
(责任编辑:杨明丽)
