基于有害结局路径的化学物质计算毒理学研究
2022-06-06苟潇于洋林军闫路彭颖张效伟
苟潇,于洋,林军,闫路,彭颖,3,张效伟,*
1. 污染控制与资源化研究国家重点实验室,南京大学环境学院,南京 210023 2. 生态环境部固体废物与化学品管理技术中心,北京 100029 3. 流域环境生态工程研发中心,北京师范大学自然科学高等研究院,珠海 519087
毒性数据缺乏是化学物质风险管理面临的一大挑战[1]。化学物质的毒性测试方法正逐步由传统的资源(时间、金钱、动物)消耗型的体内试验(invivo)[2-3],发展为资源低消耗的体外试验(invitro)[4]。高通量筛选技术(high-throughput screening, HTS)以invitro为基础,联合计算机分析技术,可高效地一次性提供多个生物水平的机制数据[5-6],为化学物质的毒性测试提供了一种新策略,也促进了预测毒理学发展。比如,由美国环境保护局(United States Environmental Protection Agency, US EPA)组织的ToxCast项目已使用约1 000种体外生物测试方法对10 000余种化学物质的超过700种生物终点进行了测试[7-10],这些数据量庞大的分子机制数据为高通量化学物质毒性预测提供了可能。
目前,数据驱动(data-driven)与机制驱动(mechanism-driven)是实现体外生物测试数据高通量毒性预测的主要策略[11]。数据驱动方法以定量构效关系(quantitative structure-activity relationship, QSAR)和交叉参照(read-across)等为代表。传统的QSAR与交叉参照都认为结构相似的化学物质具有相似的生物效应[12],因此可基于已有的化学物质结构-效应关系预测结构明确但未经生物测试化学物质的生物活性[13-14]。Braga等[15]基于600余种化学物质已有的结构及皮肤致敏数据,开发通过QSAR的方法,预测化学物质诱导皮肤致敏的情况。Russo等[16]基于PubChem(https://pubchem.ncbi.nlm.nih.gov/)内7 385个化学物质的分子结构、体外生物测试信息及大鼠经口急性毒性数据,采用交叉参照的方法建立了化学物质的大鼠经口急性毒性的预测方法。数据驱动为未经测试的化学物质毒性预测提供了解决方案,但主要局限于机制相对简单的急性毒性终点,然而目前环境化学物质的致毒模式多为在低浓度下、通过多机制引发多类型的慢性毒性。
机制驱动的有害结局路径(adverse outcome pathway, AOP)可为化学物质毒性预测提供生物学通路机制证据[17-19]。AOP通过关键事件(key event, KE)将分子启动事件(molecular initiating event, MIE)与个体水平的有害结局(adverse outcome, AO)联系起来[20-21]。目前AOP知识库(AOP knowledge base, AOP-KB; https://aopkb.oecd.org/index.html)已经整合了251条AOPs,包括185个MIEs,745个KEs,147个AOs(截至2019年8月2日)。《全球化学品统一分类和标签制度》(Globally Harmonized System of Classification and Labeling of Chemicals, GHS; https://www.ghs.org)归纳了国际管理要求的10类化学物质健康危害。根据AO毒性终点及作用的靶器官,按照“系统器官分类”(system organ class, SOC)标准[22],可将147个AOs分为11种毒性类型,分别是致癌/遗传毒性、生殖毒性、消化系统毒性、内分泌干扰、神经毒性、呼吸毒性、血液循环系统毒性、泌尿毒性、免疫毒性、急性致死及发育毒性,共覆盖GHS的9类健康危害类型(90%,除“严重眼损伤/刺激”)。AOP知识库不断丰富和完善,为满足环境管理需求的化学物质毒性预测提供了基础和机遇。
AOP的发展主要是以定性AOP(qualitative AOP)及定量AOP(quantitative AOP, qAOP)2种形式进行。qAOP是基于已有的生物学知识,借助计算机模型,描述化学物质胁迫下可能发生的MIE、KE及AO之间的时间/剂量-效应关系[23]。相较于定性AOP,qAOP的发展目标是满足真实暴露场景下化学物质毒性预测的需求[24]。其概念从提出至今已被广泛应用于化学物质的风险管控中。Jaworska等[25]联合ToxCast体外测试数据,预测124个化学物质与皮肤致敏生物事件(KE ID:824)的剂量-效应关系,并将这些化学物质的皮肤致敏危害度进行排序。Mellor等[26]联合ChEMBL(https://www.ebi.ac.uk/chembl/)数据库,计算出以有潜力激活/抑制芳香烃受体(aryl-hydrocarbon receptor, AhR)等核受体为MIEs,最终诱导肝脏脂肪变性(KE ID:459)的化学物质的结构警示子。Phillips等[27]以ToxCast中具有抑制乙酰胆碱酯酶(acetylcholinesterase, AChE)(KE ID:12)体外生物测试活性的32个化学物质剂量-效应关系为基础,结合QSAR,预测了1 029个化学物质通过抑制AChE(KE ID:12)诱导相关AOs的风险。由于qAOP的建立需要建立复杂的时间/剂量-效应模型,目前涵盖的AOP及化学物质数量少。但是随着高通量组学测试、器官芯片和人工智能等新技术的发展,未来qAOP有潜力应用于化学物质的高通量毒性预测。
基于定性AOP的化学物质毒性预测更为简洁高效。定性AOP构建了化学物质胁迫下的关键事件级联知识,描述了从MIE到AO的过程,可用于化学物质的危害识别[23]。如果化学物质诱导了一条AOP的MIE或KE,则相应AO有被引发的可能。定性AOP尽管未能考虑真实暴露场景下的时间及剂量因素,但目前已覆盖了多种生物水平,为预测化学物质潜在的多种毒性终点提供了条件。Aguayo-Orozco等[28]结合ToxCast化学物质体外生物测试与AOP-KB,使用“细胞毒性爆发”(cytotoxicity burst, CTB)方法对4 960种化学物质的207条AOPs诱导情况进行了预测,并建立了首个化学物质的AOP诱导预测网站(http://saop.cpr.ku.dk/)。但是由于ToxCast体外生物测试数据生成背景及质量存在差异[29],AOP-KB内AOP的发展成熟度不同(分为“正在发展中”和“列入经济合作与发展组织(OECD)计划中”两阶段),有必要对其毒性预测准确性进行进一步评价。
本研究基于AOP,联合ToxCast体外生物测试数据建立对化学物质毒性预测的方法,首先评估了具有体外生物测试数据的MIE/AOP情况,其次,选取101种典型环境化学物质,分析了其体外生物测试结果,最后进行毒性预测,并通过与PubChem(https://pubchem.ncbi.nlm.nih.gov/)已报道的化学物质毒性比较,评价此次毒性预测的结果。
1 材料与方法(Materials and methods)
1.1 “化学物质-体外生物测试-MIE-AO”关联建立
可通过检测MIE来识别化学物质的AOP诱导情况[30]。首先,将AOP-KB内185个MIEs与ToxCast内10 000余种体外生物测试的生物效应进行比对,建立“MIE-体外生物测试”表。比对方法为根据ToxCast内对所有体外生物测试与AOP-KB内对MIE的生物靶点及效应的描述,当体外生物测试与MIE的生物靶点与效应均一致时,则认为二者比对成功。“MIE-体外生物测试”表中有48个MIEs能成功比对到共112种体外生物测试方法,这48个MIEs共可对应58种AOs,共覆盖11种毒性类型。
将“MIE-体外生物测试”与ToxCast内化学物质体外生物测试比对,若化学物质与MIE的同一体外生物测试结果均为阳性,则认为该化学物质可引发该MIE,并诱导相关AO。若化学物质与MIE的同一体外生物测试结果都为阴性,则认为该化学物质不可引发该MIE,且无法诱导相应AO。
以全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)(CAS RN:1763-23-1)为例,PFOS具有“ATG_PPARα_TRANS_up”、ATG_PPARg_TRANS_up”和“ATG_ERα_TRANS_up”等179个体外生物测试阳性结果,其中有22个体外生物测试能比对到共37个MIEs,表明PFOS可潜在引发以激活过氧化物酶体增殖物激活受体α/g(peroxisome proliferators-activated receptorsα/g, PPARα/g)及雌激素受体(estrogen receptorα, ERα)等为生物效应的MIEs及其相应的AOs(图1),包括“肝细胞癌变作用增强”(KE ID:1171)、“血管肉瘤增多”(KE ID:1037)、“肥胖”(KE ID:1447)和“乳腺癌”(KE ID:1193)等40个AOs。
1.2 典型环境化学物质的选取
选取《中国现有化学物质名录》[31]与AOP-KB(484个化学物质,截至2019年8月2日)均有收录,且在“MIE-体外生物测试”表中具有阳性体外生物测试结果的化学物质,用于后续基于AOP的毒性预测。共选取了101个化学物质,其中包括32种工业用品,40种农药,29种药品及个人护理品(pharmaceutical and personal care products, PPCPs)。

图1 建立“化学物质-体外生物测试-MIE-AO”关联:以全氟辛烷磺酸(PFOS)为例注:AOP表示有害结局路径;MIE表示分子启动事件;KE表示关键事件;AO表示有害结局;AC50表示50%最大生物活性浓度。Fig. 1 Establish connection of “chemical-in vitro bioassay-MIE-AO”: Taking perfluorooctane sulfonate (PFOS) as an exampleNote: AOP stands for adverse outcome pathway; MIE stands for molecular initiating event; KE stands for key event; AO stands for adverse outcome; AC50 stands for concentration at 50% of the maximum activity.
1.3 化学物质毒性预测结果的评价方法
将PubChem内已报道的毒性作为化学物质真实可引发的毒性(毒性PubChem),将基于AOP预测的化学物质毒性作为“毒性AOP”。“毒性PubChem”与“毒性AOP”的内涵均是不同的毒性类型(包含在11种毒性类型中)。通过“化学物质-体外生物测试-MIE-AO”预测化学物质潜在毒性,可能出现真阳性(毒性PubChem与毒性AOP均为“真”)、真阴性(毒性PubChem与毒性AOP均为“否”)、假阳性(毒性PubChem为“否”,毒性AOP为“真”)、假阴性(毒性PubChem为“真”,毒性AOP为“否”),共4种情况(表1)。
本研究采用2种方式评价此次毒性预测结果的准确性。(1)基于Jaccard相似系数原理(Jaccard similarity, Js),通过计算“毒性PubChem”与“毒性AOP”二者相似度(公式1),综合“真阳性”与“真阴性”结果评价整体毒性预测率。Js数值在0%~100%,数值越高,此次基于AOP的化学物质整体毒性预测结果越准确。(2)但是,由于部分化学物质现有的毒性及体外生物测试数据不全以及AOP-KB中部分AOPs发展不完善,会造成毒性预测的“真阴性”结果。为更准确评价AOP对化学物质真实可引发的毒性的预测效果,有必要对“真阳性”结果进行单独分析。本研究用“真阳性率”(true positive rate, TPR)(公式2)评价AOP对化学物质真实毒性的预测效果,TPR数值范围为0%~100%,数值越高表明AOP对化学物质已明确的可真实引发的毒性预测越准确。
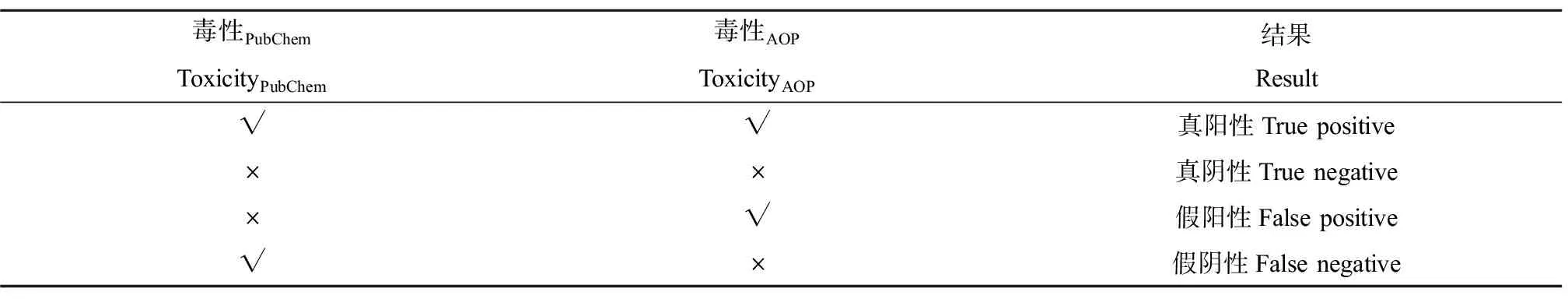
表1 毒性预测的4种结果Table 1 Four results of predication toxicity
(1)
(2)
式中:毒性PubChem表示PubChem数据库内化学物质的毒性结果,毒性AOP表示基于有害结局路径AOP预测的化学物质毒性结果,阳性毒性AOP表示基于AOP预测结果为阳性的毒性类型,阳性毒性PubChem表示在PubChem数据库内报道的化学物质毒性为阳性的毒性类型,Js表示Jaccard相似系数,TPR表示真阳性预测率。
3)现代职业教育制度的扩大实验。2010年,江苏省印发《职业教育创新发展实验区建设方案》,提出“推动建立现代职业教育制度,增强职业教育吸引力和发展能力。”2012年,贵州省出台九大举措,大力发展职业教育,其中一项是“探索建立完善现代职业教育制度”,在体系建设上,要求从学历层次上完善职业教育体系建设,职业教育不再局限在中高职层次,而要打通从中等职业教育、高等职业教育、本科职业教育的立交桥政策;同时深化考试和招生改革,在专业、学校、层次等几个方面扩大对口升学、对口招生的规模,从而从根本上增强职业教育的吸引力。
以PFOS为例,PubChem的数据表明PFOS可诱导多种毒性[32-38]。基于AOP框架预测PFOS可潜在引发包括“肝细胞癌变”(KE ID:1171)等40个AOs(图2),共包含11种毒性类型。因此,基于AOP方法预测了PFOS可潜在引发11种毒性类型,共覆盖了90%的GHS健康危害(除“严重眼损伤/刺激”),Js值及TPR值均为100%。
2 结果(Results)
联合体外生物测试,建立基于AOP的高通量化学物质毒性预测方法,并对预测结果进行评价。我们将该部分研究成果呈现在“应用AOP”(application AOP, aAOP)网站(http://112.124.17.107:8000/#/)。

图2 基于AOP框架的毒性预测结果评价:以PFOS为例注:STOT为特异性靶器官毒性,包括一次接触/重复接触。Fig. 2 Assessment of toxicity prediction based on AOP framework: Taking PFOS as an exampleNote: STOT is specific target organ toxicity, including single exposure and repeated exposure.
2.1 具有体外生物测试数据的MIE/AOP的分析
AOP-KB内有48个MIEs具有体外生物测试数据(共112种),共对应66条AOPs及58个AOs,覆盖了11种毒性类型(图3(a))及90%的GHS健康危害(图3(b))。其中属于致癌/遗传毒性、生殖毒性、消化系统毒性及内分泌干扰的AOPs、MIEs及体外生物测试数据数量最多。其相关AOPs数量分别为25、16、16和10,MIEs数量分别为23、14、15和8,体外生物测试数据数量分别为68、72、33和37。而属于免疫毒性及血液循环系统毒性的AOPs、MIEs及体外生物测试数据数量最少,其数量均未超过4。58个AOs覆盖的9种GHS健康危害中,特异性靶器官毒性、致癌、生殖毒性的AOPs、MIEs及体外生物测试数据数量最多,其相关AOPs数量分别为49、25和16,相关MIEs数量分别为58、63和14,相关体外生物测试数据数量分别为97、68和72。而与皮肤腐蚀/刺激、呼吸/皮肤过敏的健康危害相关的AOPs、MIEs及体外生物测试数据数量最少,其相关数量均未超过3。
AOP-KB所包含的毒性种类丰富(11种毒性类型)、GHS健康危害覆盖度高(90%),不同的毒性类型相关的AOP、MIE及体外生物测试数据的数量不同,后期基于AOP-KB的化学物质毒性预测结果可能产生毒性类型分布不均衡。

图3 具有体外生物测试数据的MIEs/AOPs的毒性分析注:(a)毒性类型,(b) GHS健康危害;特异性靶器官毒性包括“一次接触”与“重复接触”。Fig. 3 Toxicity analysis of MIEs/AOPs with in vitro bioassays dataNote: (a) Type of toxicity, (b) Health hazard of GHS; specific target organ toxicity includes “single exposure” and “repeated exposure”.
2.2 化学物质体外生物测试结果分析
101个化学物质共有1 092种体外生物测试结果(图4(a)),超过80%的测试结果为阴性,仅有不到20%的测试结果为阳性。化学物质的1 092种体外生物测试共包含25种生物靶点类型(图4(b)),覆盖了多个生物过程。其中生物靶点为核受体、与DNA结合、激酶、细胞因子的体外生物测试方法总数量及有活性的数量最多,平均每个化学物质有146个关于核受体的体外生物测试,其中有14个阳性测试结果。生物靶点为裂合酶、杂蛋白类、酯酶及水解酶的阳性测试结果不足30个,而甲基转移酶的体外生物测试结果均为阴性,表明化学物质通过甲基转移酶、裂合酶、杂蛋白类、酯酶及水解酶诱导有害结局的可能性较小。这25个生物靶点类型覆盖了从细胞水平的生长、分化到生物个体的生长发育和性别分化等多个生物过程,为基于AOP对这101个化学物质进行毒性预测提供了丰富的体外生物靶点测试数据。
2.3 化学物质的毒性分析
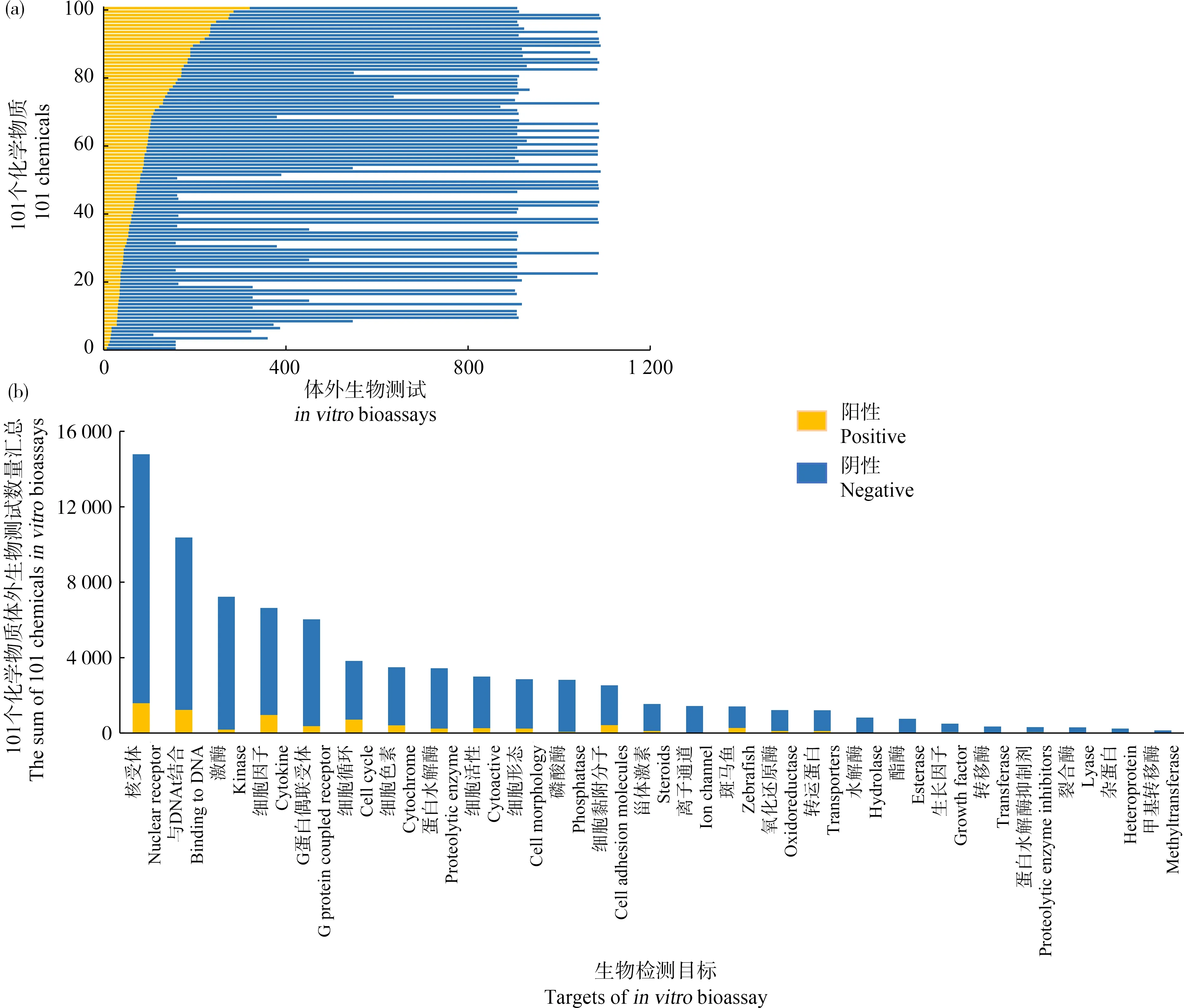
图4 101个化学物质生物测试结果注:(a) 101个化学物质体外生物测试活性阳性结果与阴性结果;(b) 101个化学物质体外生物测试的靶点信息。Fig. 4 Results of in vitro bioassays of 101 chemicalsNote: (a) Positive and negative in vitro bioassays of 101 chemicals; (b) Biotargets of in vitro bioassays for 101 chemicals.
化学物质的11种毒性类型预测结果中,共有374个“真阳性”结果,291个“真阴性”结果,312个“假阳性”结果,134个“假阴性”结果。整体毒性预测率(Js值)与真阳性毒性预测率(TPR值)分别达到59.9%与73.6%。在11种毒性类型中,生殖毒性与发育毒性的Js值最高,均超过了70%(图5(b)),而急性毒性的Js值最低,为35.6%(图5(b))。致癌/遗传毒性、生殖毒性及消化系统毒性的TPR值最高,均超过了70%(图5(b)),神经毒性的TPR值最低,仅为1%(图5(b))。134个“假阴性”结果与312个“假阳性”结果均覆盖了11种毒性类型,内分泌干扰(23个)与泌尿毒性(22个)的“假阴性”结果最多,急性毒性(63个)与神经毒性(46个)的“假阳性”结果最多。
基于AOP,可对101种化学物质的11种毒性类型进行预测,不同的化学物质及毒性类型的整体毒性预测率(Js值)与真阳性预测率(TPR值)不同。造成这一差异的主要原因是:(1)化学物质之间的体外生物测试(阳性)数据数量存在差异;Js值与化学物质生物测试(阳性)数据数量呈正相关但不显著(P>0.30,r=0.100,图5(c)),TPR值与化学物质生物测试(阳性)数据数量呈显著正相关(P<0.01,r=0.293,图5(c));(2)AOP-KB内描述不同毒性类型的AOPs、MIEs及相应体外生物测试数据数量不同;不同毒性类型的Js值与该类型毒性的AOPs数量(P>0.10,r=0.432,图5(d))、MIEs数量(P>0.10,r=0.481,图5(d))、体外生物测试数据数量(P>0.10,r=0.436,图5(d))成正相关但不显著;不同毒性类型的TPR值与该类型毒性的AOPs数量(P<0.02,r=0.685,图5(d))、MIEs数量(P<0.01,r=0.734,图5(d))、体外生物测试数据数量(P<0.01,r=0.752,图5(d))呈显著正相关。
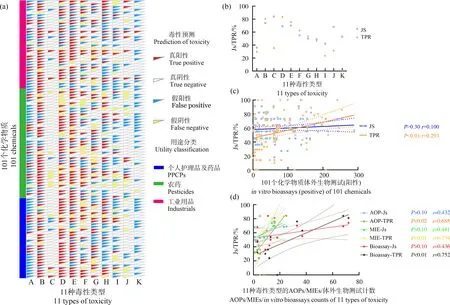
图5 101个化学物质的毒性预测结果与分析注:(a) 101种化学物质毒性预测结果;(b) 11种毒性类型的Js值及TPR值;(c) 化学物质的Js值、TPR值与其体外生物测试结果(阳性)相关性;(d) 11毒性类型的Js值、TPR值与其在AOP-KB中相关的MIEs、AOPs及体外生物测试结果(阳性)数量的相关性;A,急性毒性;B,生殖毒性;C,发育毒性;D,致癌/遗传毒性;E,消化系统毒性;F,内分泌干扰;G,泌尿毒性;H,血液循环毒性;I,呼吸毒性;J,免疫毒性;K,神经毒性;Js是Jaccard相似系数,TPR是真阳性预测率。Fig. 5 Results and analysis of prediction of toxicity for 101 chemicalsNote: (a) Toxicity prediction results of 101 chemicals; (b) Js and TPR value of 11 toxicity types; (c) The correlation between Js/TPR value and counts of in vitro bioassays (positive) of 101 chemicals; (d) The correlation between Js/TPR and counts of MIEs, AOPs and in vitro bioassays (positive) in AOP knowledge base; A, Acute toxicity; B, Reproductive toxicity; C, Developmental toxicity; D, Carcinogenic/genotoxicity; E, Digestive system toxicity; F, Endocrine disruption; G, Urinary toxicity; H, Blood circulation toxicity; I, Respiratory toxicity; J, Immunotoxicity; K, Neurotoxicity; Js is Jaccard similarity, and TPR is true positive rate.
3 讨论(Discussion)
本研究建立了基于AOP、联合ToxCast体外生物测试数据的化学物质毒性预测方法,并对预测结果进行了评价。我们发现101个化学物质可潜在引发58种AOs,包含11种毒性类型,共覆盖90%的GHS健康危害,此次整体毒性预测率(Js值)和真阳性毒性预测率(TPR值)分别达到59.9%和73.6%。
定性AOP实现了对所选化学物质的多种毒性终点的预测,而传统数据驱动(如QSAR、交叉参照等)的方法往往局限于少数特定的毒性终点。本研究基于AOP的毒性预测方法的Js值最高可达84.2%,发育毒性、生殖毒性及消化系统毒性的Js值均超过70%。而此次预测结果的致癌/遗传毒性的TPR值最高,为84.4%,生殖毒性及消化系统毒性的TPR值也超过了70%(图5(b))。现有的基于数据驱动的对化学物质的毒性预测应用中,虽然实现了高通量预测,但单组模型往往只能针对特定毒性或毒作用模式进行预测。Mansouri等[39]使用QSAR的方法,建立化学物质的雄激素受体结合模型,预测化学物质的内分泌干扰效应,其预测准确率超过80%。Russo等[40]通过交叉参照,对600余种化学物质的大鼠经口急性毒性进行预测,真阳性预测率为76%。本研究结果表明相较于慢性毒性,急性毒性的TPR值较低,仅为30%。这是由于急性毒性可能是多个毒性效应累加共同作用的结果,而一般的慢性毒性都有可检测的KEs。如Angrish等[41-43]通过多年研究发现β肾上腺素受体、PPARα/g等受体激活是引发非酒精性脂肪肝炎的KEs。这表明相较于短期高剂量暴露下引发的急性致死,机制驱动的AOP可更好地反映长期低剂量暴露引发的慢性毒性的致毒机制。针对不同的毒性类型,AOP预测的TPR值与化学物质的体外生物测试数据数量、AOP-KB内不同毒性类型的体外生物测试/MIE/AOP数量均呈显著正相关(P<0.02,r>0.290)(图5(d))。这是因为TPR反映的是AOP对化学物质真实可引发毒性的预测准确性,针对AOP-KB内体外生物测试/MIE/AOP越多的化合物毒性,预测结果越准确。这一结果也表明在AOP的化学物质毒性预测应用中,可通过丰富化学物质的体外生物测试靶点,增加化学物质体外生物测试数据数量,开发不同毒性类型的AOP及不同生物靶点的MIE来提高毒性预测的真阳性率。如,PubChem显示101种化学物质中共有47种化学物质具有神经毒性,但AOP仅对其中的2种进行了识别(图5(a))。在比较毒理基因组数据库(Comparative Toxicogenomics Database, CTD; https://ctdbase.org/)中,与神经毒性相关性最强的排名前五的生物分子靶点为FOS原癌基因(Fosproto-oncogene,FOS)、B细胞淋巴瘤(B-cell lymphoma 2, BCL2)、白细胞介素(Interleukin 1β, IL1β)、AChE和淀粉样前蛋白(amyloid precursor protein, APP)。在AOP-KB中,共有31条AOPs与神经毒性相关,主要通过与AChE和5-羟色胺(serotonin)作用来诱导神经毒性。但在ToxCast内,仅有化学物质的AChE及5-羟色胺的生物测试数据。为提高基于AOP的神经毒性真阳性预测率,可增测化学物质的FOS、BCL2和IL1β等生物靶点,并开发以这些生物靶点为KEs的测试方法。完善AOP-KB(开发不同毒性的MIE/KE/AO,增加MIE的体外生物测试),扩充化学物质的体外生物测试靶点种类及数量,提高基于AOP的毒性预测率。
联合体外生物测试、定性AOP可预测化学物质未被报道但有潜力引发的毒性,并提供可能的机制信息。101种化学物质被预测可能引发共134种未被报道的毒性效应,覆盖了11种毒性类型(图5(a)),其中消化系统毒性和泌尿系统毒性是2种目前未被报道但可被AOP预测的数量最多的毒性类型,均超过了20种。虽然,该结果可能是因为化学物质激活MIE后,其时间/剂量-效应不足以引发AO而产生“假阳性”现象,但是也反映了基于AOP可在早期低剂量暴露下预测化学物质的潜在毒性效应。例如,氟氯氰菊酯(CAS RN:68359-37-5)是全球使用最广泛的农药之一,具有消化系统毒性、内分泌干扰和神经毒性等[44-45]。尚无研究报道氟氯氰菊酯是否可对生物的血液循环系统产生致癌作用。基于AOP的化学物质毒性预测结果表明,氟氯氰菊酯的“NVS_NR_hPPARg”与“ATG_PPARg_TRANS_up”生物测试结果为阳性,氟氯氰菊酯可活化PPARg。这表明氟氯氰菊酯有通过引发“激活特异性核受体”(KE ID:1028),诱导“PPARg活化引发血管肉瘤”(AOP ID:163),最终引发有害结局“血管肉瘤的生成”(KE ID:1037)的可能。以上证据表明,氟氯氰菊酯具有诱导生物血管肉瘤生成的风险,其可能的致毒机制为通过激活PPARg、促进生长因子分泌及间充质细胞增殖。另一方面,考虑到真实暴露场景下,MIE被激活后,需要一定剂量胁迫及持续时间才可能引发AO。可结合qAOP,可进一步探讨MIE与AO之间的时间/剂量-效应关系,解决基于AOP的化学物质毒性预测结果中的“假阳性”问题,提高毒性预测准确率。
基于AOP的化学物质计算毒理学方法可在未来提高我国化学物质环境风险评估的效率和水平。我国生态环境部在2019年发布的《化学物质环境风险评估技术方法框架性指南(试行)》提出在重点识别化学物质的致癌性、致突变性、生殖发育毒性、重复剂量毒性等慢性毒性以及致敏性等健康危害时可以使用计算毒理学数据[46]。本研究在预测致癌/遗传毒性、生殖毒性方面的真阳性预测率均超过了70%。以生殖毒性为例,目前已有11个生殖毒性相关的MIEs具有高通量invitro测试方法。在未来,如果同时考虑MIE和对应的KE,并由此开展多靶点的invitro项目测试有助于提高基于AOP的化学物质毒性预测的准确率。
新型测试方法如组学方法的建立可大幅提高识别化学物质的分子靶标的能力。与单一生物靶点的invitro体外生物测试相比,高通量组学测试可反映化学物质胁迫下的所有生物响应[47],目前以基因组、转录组、蛋白组和代谢组为代表的组学方法已经在化学物质毒性研究中得到广泛应用[48]。尽管ToxCast体外测试已经涵盖了700余种测试靶点,但与生物体潜在作用靶点相比还比较有限。而且这些测试靶点大部分集中于生殖、内分泌和致癌性方面,这导致基于现有的体外生物测试数据的毒性预测结果具有一定的局限性。这也是本研究中针对神经毒性、呼吸毒性和血液循环系统毒性等的TPR值比较低的原因。后续可通过组学测试增加化学物质体外生物测试靶点,以提高联合体外生物测试数据、基于AOP的化学物质的毒性预测准确性。
此外,基于AOP的计算毒理学策略可用于对化学物质的分层测试(tiered test)和风险评估。环境管理部门很早意识到动物毒性试验在化学物质毒性评估上的局限性,动物试验不仅成本高、耗时长,且高剂量暴露的动物测试与人体暴露相关性差。而单一的替代性方法,invitro或计算模型(insilico)往往仅强调特定的危害信息,不够全面。因此综合应用高通量测试、组学测试和计算模型等信息的策略对化学物质进行分层测试,即根据第一步测试的结果,决定下一步必须进行的测试。这极大地减少了动物的使用量,缩短了化学物质危害识别的时间,提高了化学物质风险评估的效率[49]。在未来,可将基于AOP的计算毒理学方法应用于设计化学物质的分层测试与风险评估策略。
综上,本研究建立了基于AOP、联合ToxCast体外测试数据的化学物质毒性预测方法,通过与PubChem内已报道的化学物质毒性比较,对毒性预测结果进行评价。结果表明,联合体外生物测试,AOP框架有潜力实现化学物质的多类型毒性预测。我们建议可通过(1)联合高通量组学测试等方法,增加化学物质体外测试的生物靶点种类及数量;(2)完善AOP-KB,开发不同毒性类型的AOP及不同生物靶点的MIE;(3)结合并开发qAOP,模拟真实暴露场景的时间/剂量-效应关系,减少预测的“假阴性”结果;(4)结合数据驱动(如QSAR、交叉参照、人工神经网络等),对未经生物测试的化学物质进行毒性预测,提高基于AOP的化学物质高通量毒性预测的适用范围及预测结果准确性。
通讯作者简介:张效伟(1978—),男,博士,教授,博士生导师,主要研究方向为生态毒理学和健康风险评估。
