磺胺类抗生素对斜生栅藻的协同和拮抗作用研究
2022-06-06梁延鹏王婧钱丽覃礼堂曾鸿鹄莫凌云宋晓红
梁延鹏,王婧,钱丽,覃礼堂,3,*,曾鸿鹄,#,莫凌云,3,宋晓红
1. 桂林理工大学环境科学与工程学院,广西环境污染控制理论与技术重点实验室,桂林 541004 2. 桂林理工大学岩溶地区水污染控制与用水安全保障协同创新中心,桂林 541004 3. 广西环境污染控制理论与技术重点实验室科教结合科技创新基地,桂林 541004
抗生素是一类能在低浓度下抑制或影响生物机能的化学物质,在医疗及动、植物病虫害防治方面发挥了巨大的作用[1]。磺胺类抗生素(sulfonamide antibiotics, SAs)是一类人工合成的抗菌剂,自20世纪40年代被成功合成以来,超过150种SAs及其衍生物被应用于人体疾病的治疗或动物饲养[2]。SAs在国内外的生产和使用量均较高,且用量逐年上升,而抗生素的滥用易引起更严重的环境残留问题[3]。由于代谢不完全,这些化合物中的大部分以粪便和尿液的形式的排出。其也被应用于人体疾病的治疗,且在各国的医疗废水中被高浓度检出[4]。SAs药物已进入大气、水体以及土壤等环境中[5]。SAs有其特定的代谢途径,它们通过抑制氨基苯甲酸的合成来抑制叶酸的生物合成,故而当其母体或其代谢产物在土壤、表层水体等环境中的残留量达到一定浓度后,既可影响特定微生物,也可影响非特定生物体,例如一些单细胞藻类、无脊椎动物、鱼类和植物等[6],甚至促进耐药菌株的进化[7],并可通过食物链威胁人体健康。
研究表明,世界各地的地表水、地下水和沉积物甚至饮用水中都经常检测到各种抗生素,其中一些化合物浓度水平甚至高达数百μg·L-1[8]。环境中的抗生素常以各种形式和浓度共存,形成复杂的混合污染物,对环境生物产生了联合毒性效应[9-10]。磺胺类抗生素在水中具有良好的溶解性和化学稳定性,在中国的大型水系中被检测到。磺胺甲恶唑在中国地表水中的浓度最高可达4 870 ng·L-1,远远高于世界上许多国家河流的检出浓度。在中国桂林会仙湿地中,检测到6种SAs,包括磺胺吡啶(sulfapyridine, SPY)、磺胺甲基嘧啶(sulfamerazine, SMR)、磺胺二甲嘧啶(sulfamethazine, SM2)、磺胺甲氧哒嗪(sulfamethoxypyridazine, SMP)、磺胺喹噁啉(sulfaquinoxaline, SQ)和磺胺甲恶唑(sulfamethoxazole, SMZ),其复合污染对水生态环境产生中高风险[4]。SAs混合物对青海弧菌Q67的拮抗作用存在浓度依赖性[11]。
陈琼[12]考察磺胺甲恶唑等5种SAs对蛋白核小球藻的联合效应,发现混合与单个物质的毒性效应没有明显差别。磺胺喹噁啉等6种SAs组成的混合物对大型溞表现出协同效应[13]。磺胺吡啶等5种SAs组成的混合物对青海弧菌Q67呈现加和效应和拮抗作用[11]。宋雪薇等[14]研究发现,在单一暴露下,SAs会促进大肠杆菌的突变效应;联合暴露下,SAs对大肠杆菌突变效应的影响为相加效应。不同类型抗生素的二元混合物对明亮发光杆菌的等比急性联合毒性表现为加和效应[15]。虽然SAs混合物毒性已开展一些研究,但SAs对绿藻的联合毒性缺乏系统研究,对绿藻的毒性相互作用也未知。
绿藻是水生态系统的初级生产者,其生存状况与水质有密切关系,可以利用绿藻的生长状况反映水体的毒性。藻类构成了食物链的基础,其种群数量的减少将直接影响整个水生生态系统的平衡。研究表明,几乎所有磺胺类药物均能对藻类产生毒性作用[16],对SAs毒性作用反应较为敏感的斜生栅藻是淡水中常见的浮游藻类,极喜在营养丰富的静水中繁殖,且繁殖迅速、适应性强[17-18],适合作为SAs受试生物。
本文以日常生活和生产中使用量较大的6种SAs:磺胺吡啶(sulfapyridine, SPY)、磺胺甲基嘧啶(sulfamerazine, SMR)、磺胺二甲嘧啶(sulfamethazine, SM2)、磺胺甲氧哒嗪(sulfamethoxypyridazine, SMP)、磺胺甲恶唑(sulfamethoxazole, SMZ)、磺胺喹噁啉(sulfaquinoxaline, SQ),以及其二元混合物体系(共75条混合物射线)为研究对象,以斜生栅藻(Scenedesmusobliquus, So)为受试生物,利用96孔微板测定单一SAs和其二元混合物对So的毒性效应,基于浓度加和(concentration addition, CA)和独立作用(independent action, IA)模型分析混合物的联合毒性及毒性相互作用,研究结果将为科学、客观地评价SAs的环境风险提供数据参考。
1 材料与方法(Materials and methods)
1.1 实验材料
实验藻种斜生栅藻购自中国科学院淡水藻种库。该藻采用BG11培养基,放入恒温光照培养箱中,于22 ℃、照度3 000 lx和光暗比12 h∶12 h条件下培养。经过藻种复苏和藻液的传代后用于实验,实验时采用处于对数生长期的藻。
6种SAs包括SPY、SMR、SM2、SMP、SMZ和SQ均购自美国Cato Research Chemicals Inc,纯度均>98%,其基本信息如表1所示。
1.2 毒性测试、曲线拟合及混合物设计
So的毒性测定参照文献方法[19]。生长抑制毒性表达为毒物对So的生长抑制率(I):
I=1-(ODt,i-ODt,0)/(OD0,i-OD0,0)
(1)
式中:ODt,0和ODt,i分别是实验组暴露0 h和96 h后藻液的光密度(OD)值;OD0,0和OD0,i分别是空白对照组暴露0 h和96 h后藻液的OD值。
对于浓度-效应关系采用Weibull函数(式2)或Logit函数(式3)进行非线性拟合,公式分别为:
y=1-exp(-exp(α+β*log10(c)))
(2)
y=1/(1+exp(-α-β*log10(c)))
(3)
式中:α和β是函数的位置参数和斜率参数;y为效应,即毒物对指示生物的抑制率;c为毒物的浓度。

以6种SAs为混合物组分,构建15个二元混合物体系。每个混合物体系采用直接均分射线法[21]设计5条二元混合物射线(R1、R2、R3、R4和R5),在每条射线上设计12个浓度梯度。

表1 6种磺胺类抗生素(SAs)理化性质及浓度-效应拟合曲线参数Table 1 Physicochemical properties of six sulfonamide antibiotics (SAs) and their concentration-effect fitting curve parameters
1.3 毒性相互作用评估
采用CA和IA模型预测混合物毒性[22-25],CA模型数学表达式为:
(4)
式中:ECx,i表示混合物中第i个化合物单独存在时产生的效应与混合物总效应x%相同时的浓度,ci是混合物中第i个化合物浓度,m是混合物组分数。
IA模型数学表达式为:
(5)
式中:ci是混合物中第i个组分的浓度,cmix是混合物的总浓度,E(ci)是第i个组分独立存在时产生的效应,E(cmix)是混合物的效应。
如果由CA和IA模型预测的混合物浓度-响应曲线(CRCs)位于混合物实际观测毒性的95% OCI 内、95% OCI上限的上方或95% OCI下限的下方,则称该混合物组分间分别是加和作用(即没有毒性相互作用)、拮抗作用或协同作用[26]。
为提高混合物相互作用评估的准确性,采用基于效应的模型偏移率(effect-based model deviation ratio, MDRE)[27]定量评估混合物的相互作用,其表达式为:
(6)
式中:EPred为某指定效应下参考模型CA或IA预测的效应,可通过CA或IA模型计算;EObs为混合物的实验效应。
在指定效应下,MDRE判断混合物毒性相互作用为:当MDRE<1、MDRE>1时分别表示协同作用、拮抗作用。
2 结果与讨论(Results and discussion)
2.1 6种SAs对So的单一毒性
6种SAs对So的浓度-效应数据均可通过Weibull函数或者Logit函数拟合,其拟合模型参数(回归参数α和β值,统计参数R2和RMSE)如表1所示,6种SAs的浓度-效应拟合曲线(CRCs)如图1所示。由表1可知,6种SAs的R2值均>0.94,且所有RMSE值均<0.03,表明拟合结果准确、可靠。以半数效应浓度的负对数值(pEC50)作为毒性指标,pEC50的数值越大,毒性越大[28],6种受试SAs对So的毒性顺序为:SQ(pEC50=5.311)>SPY(pEC50=3.757)≈SMZ(pEC50=3.749)>SMP(pEC50=3.680)>SM2(pEC50=3.090)>SMR(pEC50=2.595),可见,毒性最大的是SQ,最小的是SMR。对比6种受试SAs的化学结构特征,发现SQ相较于其他5种SAs在结构上多出一个环状结构,这可能是其毒性最大的原因。因此,不同种SAs的单一毒性不同,可能与其自身结构有关。
丁婷婷等[11]研究了SPY等多种SAs对青海弧菌Q67的16 h毒性效应,毒性大小顺序为SPY(pEC50=3.41)>SM2(pEC50=3.21)。可见,对于斜生栅藻和青海弧菌Q67,SPY的毒性均大于SM2。此外,陈琼[12]以蛋白核小球藻为受试生物,考察SPY等多种SAs的毒性效应,发现SAs对蛋白核小球藻的毒性作用不是很明显,其毒性强度没有达到50%,故不能比较毒性物质之间的毒性大小。因此,从毒性效果来看,斜生栅藻对SAs的毒性敏感度明显优于蛋白核小球藻,可作为一种快速有效的毒性测试生物。

图1 6种SAs对斜生栅藻的浓度-效应曲线(CRCs)注:图中散点表示实测数据,实线表示拟合线。Fig. 1 The concentration-response curves (CRCs) of six SAs to Scenedesmus obliquusNote: Dispersed point and black solid lines in the diagram refer to the observed data and fitted lines, respectively.
2.2 SAs二元混合物对So的联合毒性
15个SAs二元混合体系共75条射线的浓度-效应数据可用Weibull函数或者Logit函数有效拟合,其拟合模型参数R2均>0.90,RMSE均<0.06,拟合效果显著,拟合CRCs绘于图2。6种受试SAs组成的15个二元混合体系的pEC50介于2.336~4.566间,其中,SPY-SMP、SPY-SMZ、SMR-SM2和SMR-SMZ等4个混合体系所有射线的pEC50均大于相应SAs单独存在时的pEC50,而其余11个混合体系的pEC50有大于、介于或小于相应SAs单独存在时的pEC50等多种情况,表明在二元混合体系中发生了毒性相互作用,使其毒性增大或降低。各个混合体系5条射线的pEC50的标准偏差介于0.09~0.66间,其中SPY-SMZ混合体系pEC50的标准偏差最小,而SMR-SMP混合体系pEC50的标准偏差最大,因此SMR-SMP混合物的毒性差异最大,SPY-SMZ混合物的毒性差异最小。
由图2可知,在6种受试SAs的15个二元混合物体系中,大部分混合体系的5条射线的抑制率随组分的浓度比均有较明显的变化,呈现为低浓度区毒性差异不明显、中高浓度区毒性差异明显;但SPY-SMZ混合体系的5条射线、SMR-SMZ混合体系的射线R1和R2、SMR-SM2混合体系的射线R1和R4以及SM2-SQ混合体系的射线R2和R3没有完全分开甚至重叠,这可能与这些混合物组分的毒性大小或浓度比差异大小有关,如SPY、SMZ的毒性无差异,SMR-SMZ体系R1和R2射线的浓度比变化不大。这表明大部分SAs混合物对So的联合毒性存在组分浓度依赖性,而小部分SAs混合物毒性则不存在组分浓度依赖性,因此混合物毒性不仅受组分浓度比影响,还与混合物的浓度、组分毒性大小和组分的相互作用等有关。大量污染物联合毒性研究表明,混合物毒性具有混合组分浓度比依赖性是常见现象[29]。赵锋[30]研究发现氯吡嘧磺隆、丁草胺、硝磺草酮和莠去津4种除草剂二元和三元(等毒比)混合对月牙藻的毒性随着毒物浓度的升高而增大。有研究认为SPY、SM2等5种SAs的二元混合物体系的毒性没有明显差异,可能与这5种SAs对青海弧菌Q67的毒性差异并非十分明显有关[11]。由于混合物毒性的复杂性,具体混合物中何种SAs存在可能使混合物毒性具有组分浓度依赖性需要进一步研究。
2.3 SAs二元混合物毒性作用
基于CA和IA模型对SAs的15个二元混合物体系进行评估,结果显示15个混合物体系以拮抗作用(CA预测线位于95% OCI上限的上方)和协同作用(CA预测线位于95% OCI下限的下方)为主。以含有SPY和SMR组分的混合体系为例进行分析,因实际环境中污染物以低浓度暴露为主,故用其EC10效应下的等效线图进行评估。等效线图[24-25]是混合物毒理学中考察二元混合物毒性相互作用最常用的图形方法之一。基于CA和IA模型来分析评价混合物的毒性相互作用,当混合物射线(R1~R5)位于CA和IA之间表示加和作用,位于CA或IA的下方区域表示协同作用,而位于CA或IA的上方区域表示拮抗作用。
SAs的15个二元混合物体系在10%效应下基于CA和IA模型的等效线图如图3所示。环境中多种化学物的联合暴露将会产生独立、相加、协同或拮抗等的联合毒性作用,这种联合毒性会发生在毒性作用过程中的不同靶点及不同途径,包括发生在暴露相中,从而导致毒性改变[31]。在本研究中,含有组分SPY的混合体系大多呈现协同作用,且随组分SPY浓度比的增大(R5~R1),毒性相互作用增强。在SPY-SMR混合体系中,均呈现拮抗作用,且随组分SPY浓度比的增大(R5~R1),拮抗作用的强度增加;在SPY-SM2和SPY-SQ混合体系中,随组分SPY浓度比的增大(R5~R1),毒性相互作用增强,由拮抗作用→加和作用→协同作用;在SPY-SMP和SPY-SMZ混合体系中,均呈现协同作用,且随组分SPY浓度比的增大(R5~R1),协同作用增强。含有组分SMR的混合体系均呈现拮抗作用,且随着组分SMR浓度比的增大(R5~R1),拮抗作用增强。这说明混合体系的组分浓度比可能是影响混合物体系相互作用发生变化的重要因素。相关研究发现,环丙沙星、土霉素与铜的络合作用会形成不同比例的络合物,其联合毒性随抗生素与重金属混合比例的改变而呈现不同的作用类型[32]。莫凌云等[33]研究发现混合物的毒性相互作用大小随着组分浓度比变化而发生变化。综上所述,混合体系组分的浓度比不同会产生不同的相互作用类型。
此外,混合物的毒性相互作用还与混合物组分构成关系密切。在本研究中,含有组分SPY的混合体系,即SPY-SMR、SPY-SM2、SPY-SMP、SPY-SMZ和SPY-SQ这5个混合体系,大多呈现协同作用,且随着SPY浓度比的增大,毒性相互作用增强。而含有组分SMR的混合体系均呈现拮抗作用,且随着组分SMR浓度比的增大,拮抗作用增强。蔡梦婷等[34]采用相加指数法求得土霉素-铜、诺氟沙星-铜复合暴露对小球藻的联合作用类型分别为拮抗和协同作用。另有研究发现毒死蜱、氯氰菊酯和多菌灵的二元及三元混合体系对小球藻的联合作用类型均为协同作用[35]。因此,混合体系组分的构成不同会产生不同的相互作用类型。

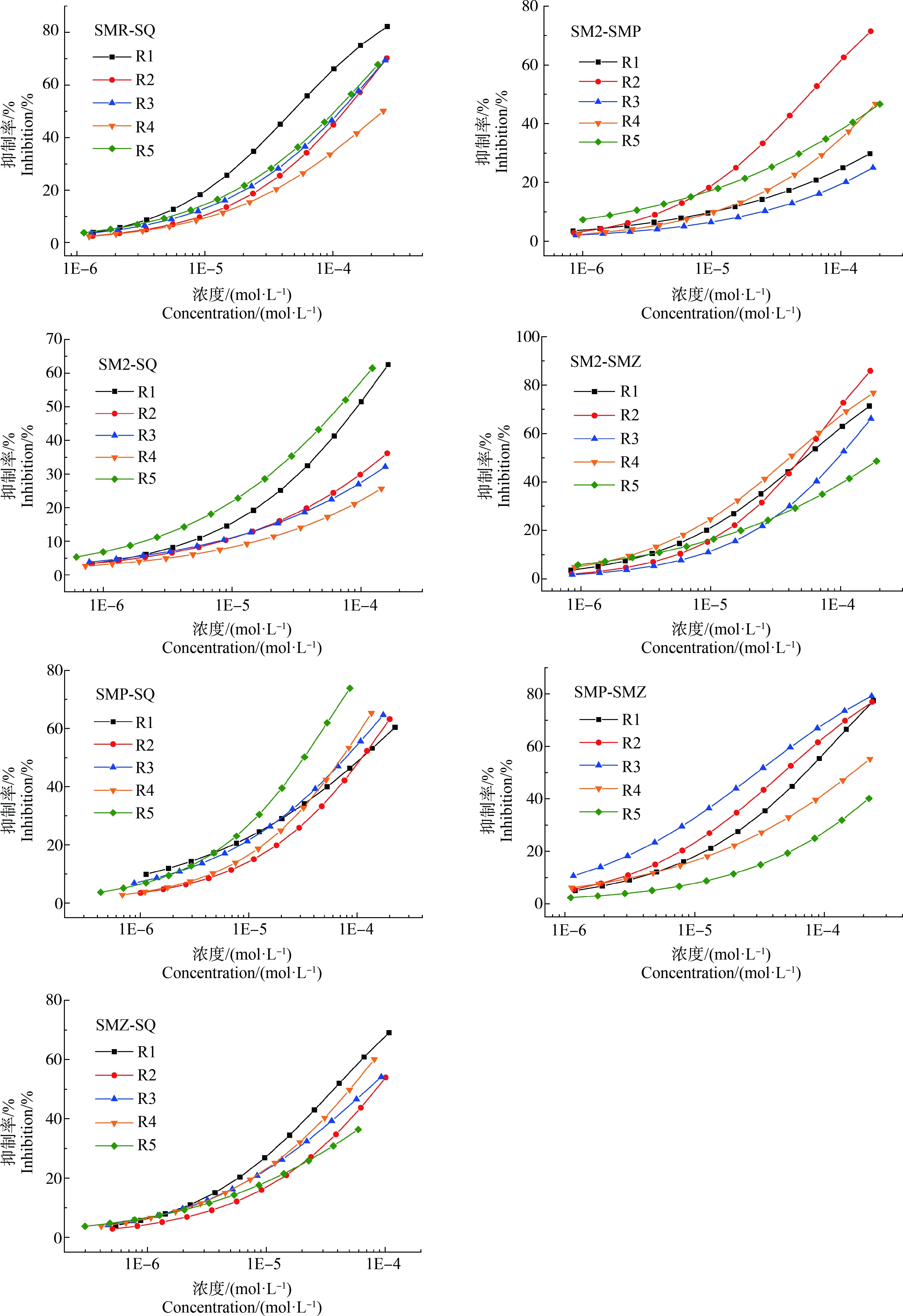
图2 SAs的15个二元混合物体系各混合物射线对斜生栅藻的拟合浓度-效应曲线Fig. 2 The fitted concentration-effect curves of various rays in 15 groups of SAs binary mixtures to Scenedesmus obliquus
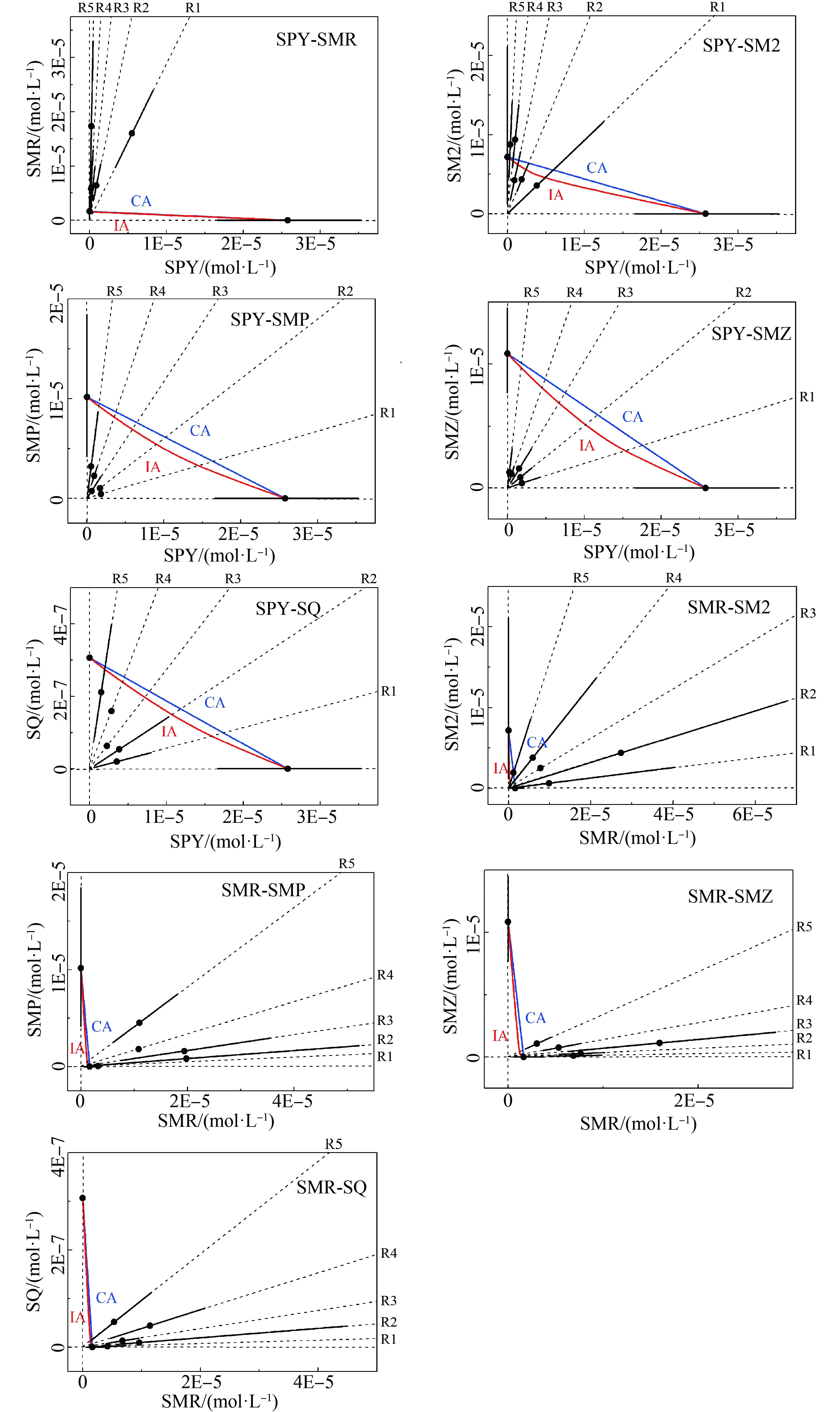
图3 基于浓度加和(CA)和独立作用(IA)模型的SAs二元混合体系等效线图注:“●”表示EC10值,“——”表示置信区间,“——”表示CA预测,“——”表示IA预测。Fig. 3 Equivalent line diagram of binary SAs mixed system based on concentration addition (CA) and independent action (IA) modelsNote: “●” indicates the EC10 value, “——” indicates the confidence interval, “——” indicates the CA prediction, and “——” indicates the IA prediction.
基于效应的MDR方法定量表征SAs的15个二元混合物体系在0.8%~90%实验效应范围内的相互作用,结果如图4所示。在实验效应范围内,混合物MDRCA和MDRIA值分别介于0.14~10.59和0.16~13.02,MDRCA和MDRIA值<1的比例分别为63.89%和54.44%,即在混合物所有实验浓度下,6种受试SAs组成的二元混合物发生协同作用的概率超过50%。实验效应在20%以内时,随着效应和混合物浓度降低,拮抗作用发生概率明显增大;当实验效应≥20%后,随着效应和混合物浓度增大,协同作用发生概率显著增大。SPY-SMP、SPY-SMZ和SPY-SQ这3个二元混合体系所有射线的MDRCA和MDRIA值均<1且随着效应和混合物浓度的降低而逐渐降低,说明这3个混合体系在所有实验效应范围均发生了协同作用,且在低效应和低浓度区域的协同作用最强。SMR-SM2混合体系所有射线的MDRCA和MDRIA值均>1,反映出该混合物在所有实验效应范围均发生了拮抗作用。SMP-SMZ混合体系R1、R2、R3射线的MDRCA和MDRIA值均<1而R4、R5射线的值均>1,说明该混合体系R1、R2、R3射线发生协同作用而R4、R5射线却发生拮抗作用。SPY-SMR混合体系R1、R2、R3射线的MDRCA和MDRIA值均>1,R4、R5射线在实验效应<25%时MDRCA和MDRIA值>1,而当实验效应>25%时则<1,反映出该混合体系R1、R2、R3射线发生拮抗作用而R4、R5射线在低效应区发生拮抗作用,但高效应区则发生协同作用。综上所述,基于效应的MDR方法可以准确判断混合物间及浓度区间发生的相互作用,识别混合物产生拮抗、加和或协同作用与混合物组分、浓度比和混合物浓度等的关系,可为实际环境混合物风险的精准管控提供科学依据。
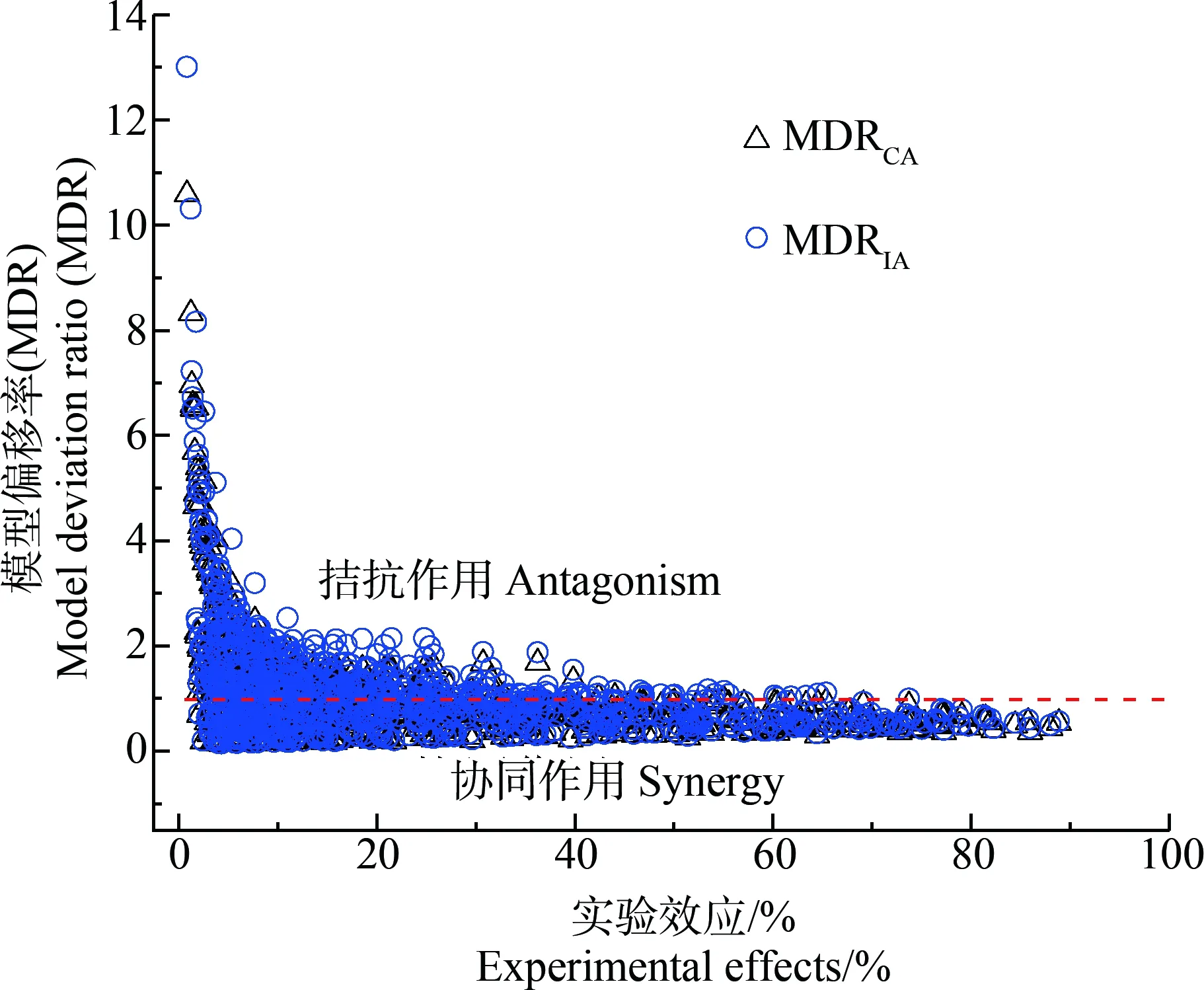
图4 基于CA和IA模型的SAs二元混合物模型偏移率(MDR)Fig. 4 The model deviation ratio (MDR) value of SAs binary mixture based on CA and IA models
通讯作者简介:覃礼堂(1982—),男,博士,教授,主要研究方向为环境毒理学。
共同通讯作者简介:曾鸿鹄(1970—),女,博士,教授,主要研究方向为环境生态风险评估。
