血小板功能检测或基因检测指导的双联抗血小板药物降阶治疗对行经皮冠状动脉介入治疗的急性冠脉综合征患者预后影响的Meta分析
2022-06-06赵志刚雷梦杰王胜楠李雅超杨彦立安蕾王敬尧周海立孙雪李彩榕薛增明
赵志刚,雷梦杰,王胜楠,李雅超,杨彦立,安蕾,王敬尧,周海立,孙雪,李彩榕,薛增明
目前,阿司匹林和P2Y12抑制剂组成的双联抗血小板治疗(dual antiplatelet therapy,DAPT)是行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的急性冠脉综合征(acute coronary syndrome,ACS)患者预防血栓形成的标准治疗方案[1-2],但抗血小板治疗存在个体差异,部分患者治疗过程中持续出现高血小板反应性(high platelet reactivity,HPR),血小板黏附、聚集功能增强,进而增加血栓形成风险[3-4]。普拉格雷和替格瑞洛作为新型P2Y12抑制剂,具有更高效和可预测的药效作用,且不受CYP2C19基因影响,故患者应用普拉格雷和替格瑞洛过程中HPR不多见[5-7],但患者血栓形成风险降低的同时,也可能增加出血发生风险。因此,临床上为了平衡患者的缺血与出血风险,需进行抗血小板药物的降阶治疗。目前,抗血小板药物降阶治疗包括强效P2Y12抑制剂降至效力较低的氯吡格雷、减少强效P2Y12
抑制剂剂量、缩短DAPT时程、停用阿司匹林后单用P2Y12抑制剂[8]。氯吡格雷是最常用的P2Y12抑制剂[9],使用氯吡格雷过程中患者呈现的HPR是多种机制相互作用导致的,其中CYP2C19酶遗传多态性具有重要作用。研究表明,携带CYP2C19功能丧失等位基因的患者,体内活性代谢物生成减少,HPR发生率和血栓形成风险增加[10-13]。近年来采用血小板功能检测或基因检测指导的个体化抗血小板方案的研究报道不断增加,但各研究间的结论不一致。基于此,本研究旨在通过Meta分析探讨血小板功能检测或基因检测指导的双联抗血小板药物降阶治疗对行PCI的ACS患者预后的影响,现报道如下。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 纳入标准 (1)研究类型:随机对照试验(randomized controlled trail,RCT)和队列研究;(2)研究对象:PCI后接受双联抗血小板药物治疗的ACS患者;(3)干预措施:降阶治疗组患者采用血小板功能检测或基因检测指导的双联抗血小板药物降阶治疗,标准治疗组患者接受标准双联抗血小板药物治疗,两组其他治疗措施一致;(4)结局指标:主要终点事件是PCI后12个月主要不良心脑血管事件;主要安全终点事件是PCI后12个月出血及显著临床出血事件〔指出血学术研究联合会(Bleeding Academic Research Consortium,BARC)出血分型[14]为3~5型的出血或GUSTO出血分级[15]为中、重度的出血〕;次要终点事件是PCI后12个月全因死亡、心源性死亡、心肌梗死、卒中、支架内血栓形成、再次血运重建。
1.1.2 排除标准 (1)重复文献;(2)研究对象合并严重影响血小板及凝血功能的其他疾病,如严重血液系统疾病、免疫系统疾病等;(3)研究对象随访时间≤6个月的文献;(4)无法提取结局指标的文献。
1.2 文献检索策略
1.2.1 检索数据库及检索时间 检索数据库包括Cochrane Library、PubMed、Embase、Web of Science,检索时间为建库到2021年12月。此外,为了减少发表偏倚,本研究还检索了欧洲心脏病学会(European Society of Cardiology)、欧洲经皮心血管介入学会(European Association of Percutaneous Cardiovascular Interventions)、美国心脏协会(American Heart Association)、美国心脏病学会(American College of Cardiology)、美国经导管心血管治疗学大会(Transcatheter Cardiovascular Therapeutics)和心血管血管造影及介入学会(Society of Cardiovascular Angiography and Interventions)的摘要和报告。
1.2.2 检索词及检索策略 本研究严格按照Cochrane系统评价和荟萃分析报告指南进行检索,检索词是经过多次预检索确定的,采用主题词与自由词相结合的方式,并根据具体数据库进行细微调整。基本检索策略为:(“PCI” OR“percutaneous coronary intervention” OR “drug eluting stent”OR “Biolimus Eluting Stent” OR “Everolimus Eluting Stent”OR “Paclitaxel Eluting Stent” OR “Sirolimus-Eluting Stent”OR “Zotarolimus Eluting Stent”) AND (“platelet function”OR “platelet reactivity” OR “PFT” OR “light-transmittance aggregometry” OR “LTA” OR “vasodilator-stimulated phosphoprotein” OR “VASP” OR “Verify Now” OR“thrombelastograghy” OR “thrombelastogram” OR “TEG”OR “platelet function analyzer-200” OR “P-selectin” OR“the multiplate electrode aggregometry” OR “MEA” OR“pharmacogenomic” OR “personalized”OR“genotyping”OR“CYP2C19”) AND (“de-escalation”OR“switch”)。
1.3 文献筛选及资料提取 文献去重后由两名研究员独立筛选文献、提取资料,研究者依次阅读标题、摘要及全文后筛选文献,如遇分歧则与第3名研究员商议后达成一致观点;由该两名研究员独立进行数据提取,内容包括第一作者、发表时间、研究类型、样本量、干预措施及结局指标,如数据不一致则由第3名研究员进行核对。
1.4 文献方法学质量评价 采用Cochrane协作网RCT偏倚风险评价工具(Cochrane collaboration's tool for assessing risk of bias in randomized trial,RoB1)[16]对纳入的RCT进行方法学质量评价,采用非随机干预研究偏倚风险评价工具(risk of bias in non-randomised studies-of interventions,ROBINS-1)[17]对纳入的队列研究进行方法学质量评价。
1.5 统计学方法 应用Stata 15.0软件进行Meta分析。分类变量采用RR及其95%CI进行描述。采用Cochran'sQ检验进行异质性分析,其中I2<25%表示低异质性、25%~50%表示中等异质性、>50%表示高异质性[16];若各研究间存在低/中等异质性(I2≤50%且P≥0.1),则采用固定效应模型进行Meta分析;若各研究间存在高异质性(I2>50%和/或P<0.1),首先分析异质性来源,并对导致异质性的可能原因进行亚组分析,若各研究间仅有统计学异质性则采用随机效应模型进行Meta分析,若异质性过大且无法判断来源则采用描述性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 共检索相关文献438篇,其中Web of Science 164篇、PubMed 102篇、Cochrane Library 90篇、Embase 82篇;导入EndNote剔除重复文献后获得文献218篇,阅读文献的标题、摘要及全文后,最终获得文献6篇[18-23],包括6 711例患者,其中RCT 3篇[18-20],均有一定偏倚风险;队列研究3篇[21-23],均有中等偏倚风险。文献筛选流程见图1,纳入文献的基本特征见表1,纳入文献的方法学质量评价结果见表2~3。
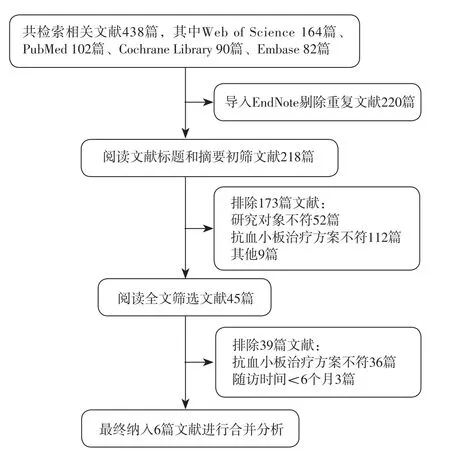
图1 文献筛选流程Figure 1 Literature screening flow
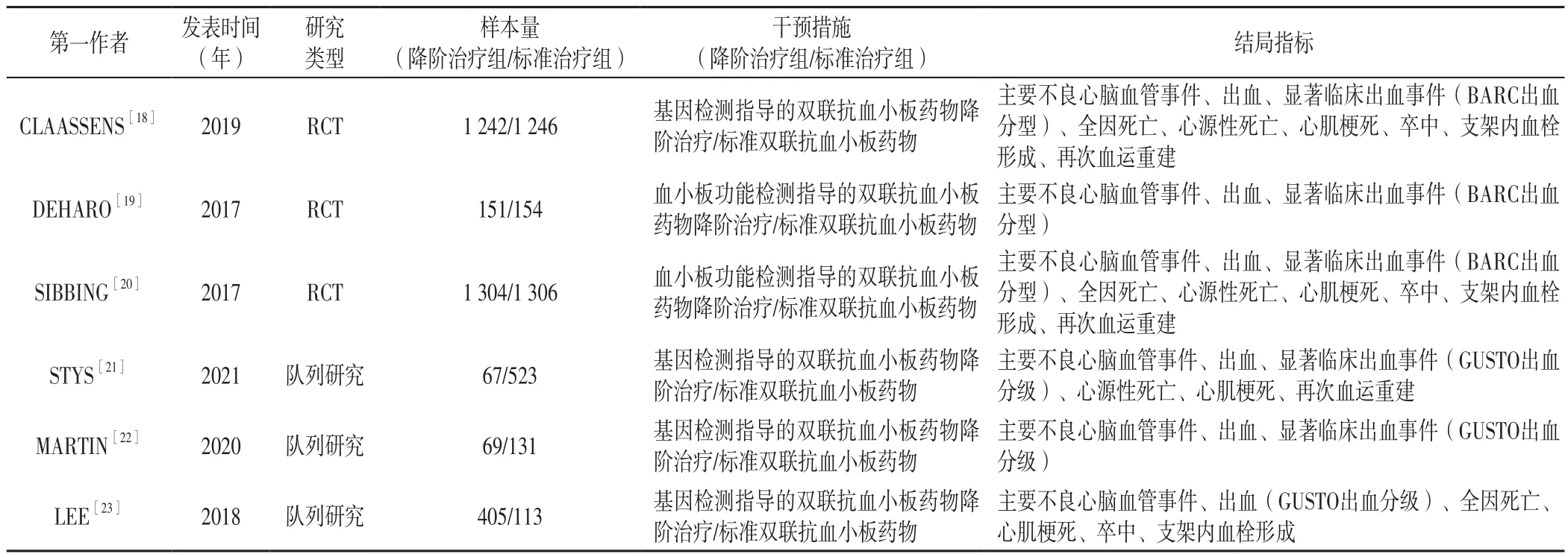
表1 纳入文献的基本特征Table 1 Basic characteristics of included literature
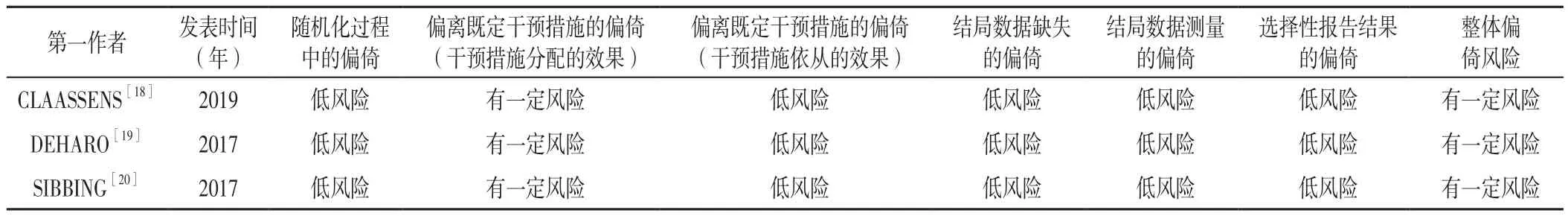
表2 纳入RCT的方法学质量评价结果Table 2 Methodological quality evaluation results of included RCT
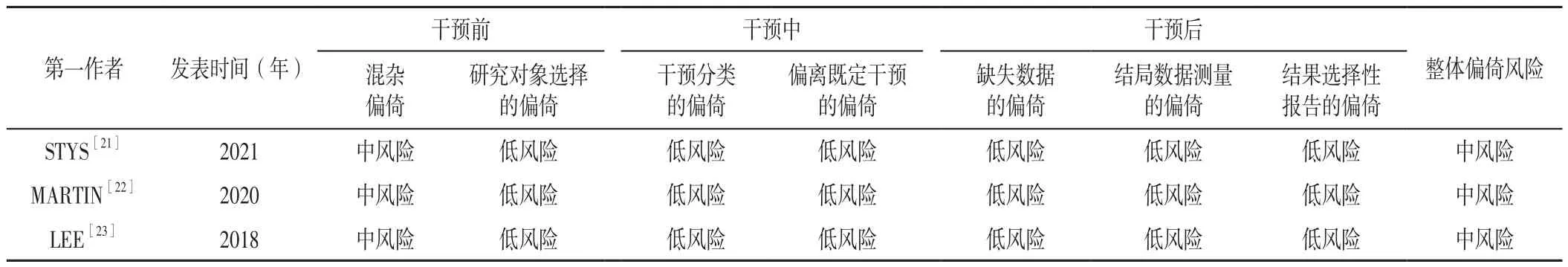
表3 纳入队列研究的方法学质量评价结果Table 3 Methodological quality evaluation results of included cohort study
2.2 Meta分析结果
2.2.1 主要不良心脑血管事件 6项研究[18-23]报道了主要不良心脑血管事件发生率,各研究间存在高异质性(I2=67.7%,P=0.008),采用随机效应模型进行Meta分析,结果显示,两组患者PCI后12个月主要不良心脑血管事件发生率比较,差异无统计学意义〔RR=0.72,95%CI(0.51,1.02),P=0.066〕。根据研究类型进行亚组分析,随机效应模型结果显示,两组患者PCI后12个月主要不良心脑血管事件发生率比较,差异无统计学意〔RCT:RR=0.66,95%CI(0.42,1.02),P=0.064;队列研究:RR=0.84,95%CI(0.42,1.67),P=0.616)〕,见图2。

图2 两组患者PCI后12个月主要不良心脑血管事件发生率比较的森林图Figure 2 Forest map of comparison of the incidence of major adverse cardiovascular and cerebrovascular events at 12 months after PCI between the two groups
2.2.2 主要安全终点事件
2.2.2.1 出血 3项研究[18-20]报道了出血发生率,各研究间存在高异质性(I2=59.3%,P=0.086),采用随机效应模型进行Meta分析,结果显示,两组患者PCI后12个月出血发生率比较,差异无统计学意义〔RR=0.74,95%CI(0.51,1.07),P=0.110〕,见图3。
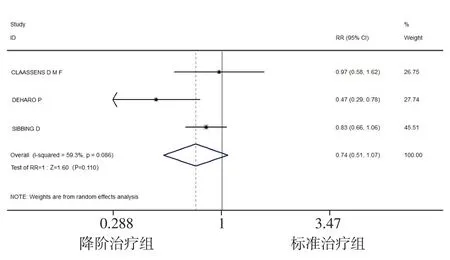
图3 两组患者PCI后12个月出血发生率比较的森林图Figure 3 Forest map of comparison of the incidence of hemorrhage at 12 months after PCI between the two groups
2.2.2.2 显著临床出血事件 6项研究[18-23]报道了显著临床出血事件发生率,各研究间存在中等异质性(I2=45.2%,P=0.104),采用固定效应模型进行Meta分析,结果显示,降阶治疗组患者PCI后12个月显著临床出血事件发生率低于标准治疗组,差异有统计学意义〔RR=0.75,95%CI(0.64,0.89),P=0.001〕,见图4。根据研究类型进行亚组分析,随机效应模型结果显示,RCT中降阶治疗组患者PCI后12个月显著临床出血事件发生率低于标准治疗组,差异有统计学意义〔RR=0.67,95%CI(0.46,0.98),P=0.037〕;队列研究中两组患者PCI后12个月显著临床出血事件发生率比较,差异无统计学意义〔RR=1.04,95%CI(0.54,2.00),P=0.916〕,见图5。

图4 两组患者PCI后12个月显著临床出血事件发生率比较的森林图Figure 4 Forest map of comparison of the incidence of significant clinical bleeding events at 12 months after PCI between the two groups
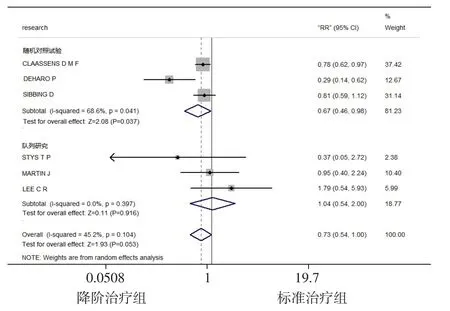
图5 两组患者PCI后12个月显著临床出血事件发生率比较亚组分析的森林图Figure 5 Forest map of subgroup analysis of comparison of the incidence of significant clinical bleeding events at 12 months after PCI between the two groups
2.2.3 次要终点事件
2.2.3.1 全因死亡 3项研究[18,20,23]报道了全因死亡率,各研究间存在低异质性(I2=0,P=0.495),采用固定效应模型进行Meta分析,结果显示,两组患者PCI后12个月全因死亡率比较,差异无统计学意义〔RR=1.08,95%CI(0.67,1.75),P=0.741〕,见图6a。

图6 两组患者PCI后12个月次要终点事件发生率比较的森林图Figure 6 Forest map of comparison of the incidence of secondary endpoint events at 12 months after PCI between the two groups
2.2.3.2 心源性死亡 3项研究[18,20-21]报道了心源性死亡率,各研究间存在低异质性(I2=0,P=0.580),采用固定效应模型进行Meta分析,结果显示,两组患者PCI后12个月心源性死亡率比较,差异无统计学意义〔RR=0.72,95%CI(0.38,1.37),P=0.319〕,见图6b。
2.2.3.3 心肌梗死 4项研究[18,20-21,23]报道了心肌梗死发生率,各研究间存在低异质性(I2=0,P=0.719),采用固定效应模型进行Meta分析,结果显示,两组患者PCI后12个月心肌梗死发生率比较,差异无统计学意义〔RR=0.82,95%CI(0.57,1.16),P=0.263〕,见图6c。
2.2.3.4 卒中 3项研究[18,20,23]报道了卒中发生率,各研究间存在低异质性(I2=0,P=0.812),采用固定效应模型进行Meta分析,结果显示,两组患者PCI后12个月卒中发生率比较,差异无统计学意义〔RR=0.61,95%CI(0.30,1.24),P=0.173〕,见图6d。
2.2.3.5 支架内血栓形成 3项研究[18,20,23]报道了支架内血栓形成发生率,各研究间存在低异质性(I2=0,P=0.991),采用固定效应模型进行Meta分析,结果显示,两组患者PCI后12个月支架内血栓形成发生率比较,差异无统计学意义〔RR=0.69,95%CI(0.21,2.23),P=0.533〕,见图6e。
2.2.3.6 再次血运重建 3项研究[18,20-21]报道了再次血运重建发生率,各研究间存在低异质性(I2=11.8%,P=0.322),采用固定效应模型进行Meta分析,结果显示,两组患者PCI后12个月血运重建发生率比较,差异无统计学意义〔RR=1.14,95%CI(0.78,1.66),P=0.497〕,见图6f。
3 讨论
3.1 本Meta分析结果及局限性 本Meta分析结果表明,与标准双联抗血小板药物治疗相比,血小板功能检测或基因检测指导的双联抗血小板药物降阶治疗可有效降低ACS患者PCI后显著临床出血事件发生率,但不增加缺血事件发生率。以研究类型(RCT、队列研究)进行亚组分析,结果显示,RCT中降阶治疗组患者PCI后12个月显著临床出血事件发生率低于标准治疗组,但队列研究中两组患者PCI后12个月显著临床出血事件发生率比较无统计学差异,究其结果不一致的原因可能为:队列研究自身具有局限性,其存在一定回忆偏倚;队列研究未实施随机分配,可能存在混杂因素;此外,判定标准不一致,队列研究中显著临床出血事件的判定依据为GUSTO出血分级,而RCT的判定依据为BARC出血分型。
本Meta分析尚存在一定局限性:首先,纳入的研究数量少,可能导致结果存在一定偏倚。其次,有研究表明,与白种人相比,东亚人在抗血小板治疗效果方面存在明显差异[24],但本Meta分析并未纳入东亚人群的研究,故其结论推广存在一定局限。再者,部分结局指标存在高异质性。
3.2 血小板功能检测或基因检测指导的抗血小板药物治疗的研究现状 早期RCT(如GRAVITAS研究[25]和TRIGGER-PCI研究[26])提示,血小板功能检测或基因检测指导的抗血小板药物调整并未使患者获益,但该研究对象为低风险人群,且强效P2Y12抑制剂应用较少,可能导致阴性结果[27]。之后,POPular Genetics研究结果显示,基因检测指导的P2Y12抑制剂治疗可降低患者PCI后小出血事件发生率,且不增加缺血事件[18]。由于各研究间结论不一致,GALLI等[28]对相关研究进行Meta分析,结果显示,基于血小板功能检测或基因检测优化抗血小板治疗可有效改善冠心病患者PCI后复合疗效,且具有良好的安全性,主要为轻微出血减少;但该研究既包括降阶治疗也包括升阶治疗,而本研究的侧重点为降阶治疗。
3.3 ACS患者进行双联抗血小板药物降阶治疗的必要性 目前,阿司匹林联合P2Y12抑制剂的DAPT是接受PCI的ACS患者预防缺血事件的基石,被国内外指南所推荐[2,29]。研究表明,强效P2Y12抑制剂(普拉格雷和替格瑞洛)不受CYP2C19基因多态性的影响,且呈现出的个体差异和血小板抑制发生率较低[30];但其降低ACS患者缺血事件的同时,常以增加出血事件为代价。WALLENTIN等[7]研究发现,与服用氯吡格雷患者相比,服用替格瑞洛的ACS患者致命性颅内出血发生风险增高10倍(0.1%比0.01%,P=0.02)。因此,替格瑞洛用药期间如何降低出血风险及如何合理选择抗血小板药物是临床关注的问题,因而降阶治疗应运而生。研究表明,在行PCI的患者中,P2Y12抑制剂依从性差与主要不良心血管事件发生风险升高相关,而校正潜在混杂因素后该相关性仍存在[31-32]。此外,ACS发病后1个月患者出血风险大于缺血风险[33]。因此,于适当时机进行降阶治疗可能在不增加缺血事件的前提下降低出血事件。目前,从强效P2Y12抑制剂转换为氯吡格雷降阶方案的有效性及安全性已得到多项研究支持,如TROPICAL-ACS试验[20]、TOPIC试验[34]及HOSTREDUCE-POLYTECH-ACS研究[35]。
3.4 血小板功能检测和基因检测在抗血小板治疗中的应用在双联抗血小板药物降阶治疗过程中血小板功能检测和基因检测能够直观地反映血小板功能状态,其中血小板功能检测可显示血小板反应性,其常用的检测方法包括四种:光学透射比浊(light transmittance aggregometry,LTA)法、血管扩张刺激磷酸蛋白(vasodilator stimulated phosphoprotein,VASP)法、Verify Now检测法、血栓弹力图(thromboelastography,TEG),其中低于低界值说明患者出血风险较高,降阶治疗获益更大;高于高界值说明患者缺血风险较高,升阶治疗获益更大。CYP2C19基因检测结果则是从氯吡格雷在体内代谢过程受阻的角度解释了HPR的原因。CYP2C19功能丧失基因型包括CYP2C19*2、CYP2C19*3、CYP2C19*4和CYP2C19*8,其中前两种基因型携带者最常见,后两种基因型携带者缺血事件发生风险更高[11]。与上述四种基因型相反,CYP2C19*17是CYP2C19活性增强的基因型。根据CYP2C19基因型可将氯吡格雷代谢情况分为超快速代谢(ultrarapid metabolizer,UM)、快速代谢(rapid metabolizer,RM)、正常代谢(normal metabolizer,NM)、中间代谢(intermediate metabolizer,IM)、慢代谢(poor metabolizer,PM)型[36]。既往研究表明,基于氯吡格雷代谢情况选择P2Y12抑制剂可降低患者缺血事件发生率,并保证患者安全[21]。目前,以基因检测指导的双联抗血小板药物降阶治疗方案以强效P2Y12抑制剂降阶为氯吡格雷最常见。有研究者根据CYP2C19基因型将ACS患者分为功能缺失组和非功能缺失组,其中功能缺失组持续给予强效P2Y12抑制剂,非功能缺失组起始予以强效P2Y12抑制剂后改为氯吡格雷或持续服用氯吡格雷,结果显示,两组患者心源性死亡率和出血事件导致的死亡率比较,差异无统计学意义[21]。TRITON-TIMI研究[37]发现,与氯吡格雷相比,普拉格雷仅可有效降低CYP2C19功能缺失患者主要不良心脑血管事件发生率。对于CYP2C19非功能缺失患者,以强效P2Y12抑制剂为起始,然后降阶为氯吡格雷维持治疗是安全的,且降阶后不会降低患者的临床净获益[22,38]。但相关研究指出,CYP2C19基因多态性对中国人群PCI后临床结局无明显影响,即对于CYP2C19功能缺失患者,强效P2Y12抑制剂并非临床最佳选择,其可以选择增加氯吡格雷剂量[39],故CYP2C19基因检测指导的抗血小板治疗效果有待进一步研究证实。
血小板功能检测及基因检测指导的抗血小板治疗可能导致P2Y12抑制剂升阶或降阶治疗,对于ACS患者更多的是导致降阶治疗,其目的是在不影响疗效的情况下减少出血,且在没有禁忌证的情况下使用强效P2Y12抑制剂(普拉格雷或替格瑞洛)[3];而对于慢性冠状动脉综合征患者,更多的是导致升阶治疗,其目的是减少血栓并发症。
综上所述,在接受PCI的ACS患者中,通过血小板功能检测或基因检测指导双联抗血小板药物降阶治疗可降低患者显著临床出血事件发生风险,同时不增加缺血事件。但有研究指出,ACS发病后1个月内患者缺血风险大于出血风险,发病1个月后患者出血风险大于缺血风险[8],且缺血与出血风险的很多影响因素存在重合[40]。因此,临床上调整抗血小板药物时不应单纯以血小板功能检测或基因检测结果为依据,还应考虑“治疗时间窗”及其他影响因素。
作者贡献:赵志刚、薛增明进行文章的构思与设计,负责文章的质量控制及审校,并对文章整体负责、监督管理;赵志刚、李雅超、薛增明进行研究的实施与可行性分析;雷梦杰、王胜楠、杨彦立、安蕾、孙雪进行数据收集、整理、分析;雷梦杰、王敬尧、周海立、李彩榕进行结果分析与解释;赵志刚负责撰写、修订论文。
本文无利益冲突。
DOI:10.1001/jama.2009.1232.
