44例西藏地区泡状棘球蚴病临床表现与病理特征
2022-06-06罗含欢边巴扎西
罗含欢,霍 真,王 倩,尼 玛,边巴扎西
西藏自治区人民医院 1病理科 3放射科 4普外科,拉萨 8500002中国医学科学院北京协和医院病理科, 北京 100730
棘球蚴病亦称包虫病,是由于感染棘球属绦虫幼虫(棘球蚴)引起的人畜共患寄生虫病,主要流行于农牧区。目前常见的棘球属绦虫有4种,分别为泡状棘球绦虫、细粒棘球绦虫、少节棘球绦虫和福氏棘球绦虫[1],其中前2种是人类感染的主要病原体。细粒棘球蚴病是由细粒棘球绦虫感染所致,全球范围内病例分布较广泛。泡状棘球蚴病(alveolar echinococcosis, AE)的病原体为泡状棘球绦虫,该病虽为良性疾病,但具有弥漫性浸润生长的特性,致残率和致死率均较高[2]。AE主要流行于日本北部、中国西藏、中亚、欧洲中部和北美部分地区[3- 4]。目前,我国关于AE病理特征的研究较少,对其缺乏系统认知,易误诊、漏诊。本研究对西藏自治区人民医院诊治的AE患者临床资料进行总结,旨在为临床诊治提供参考。
1 资料与方法
1.1 研究对象
回顾性收集2013年9月至2021年4月西藏自治区人民医院行手术治疗的全部AE患者临床资料。排除标准:病理资料不完整的患者。
本研究已通过西藏自治区人民医院伦理委员会审批(审批号:ME-TBHP- 21-KJ- 041)。
1.2 方法
通过电子病历系统收集AE患者的临床资料,包括一般资料(性别、年龄、民族、职业、病程等)、临床表现、影像学表现、病理结果、治疗方式以及预后等信息。其中病理检查方法:手术切除标本经4%中性甲醛液固定、石蜡包埋,常规制片、HE染色,光镜下观察。全部病例的病理切片均由2位病理科副主任医师重新阅片,明确AE诊断[5]。
1.3 统计学处理
采用SPSS 25.0软件进行数据整理和分析。计量资料(年龄、病变直径)符合正态分布,以均数±标准差表示;性别、临床表现等计数资料以频数(百分数)表示。
2 结果
2.1 临床资料
共纳入44例AE患者,均为藏族居民;男性17例,女性27例;平均年龄(36.2±12.3)岁;病程1~72个月。44例均有犬、牛、羊等动物接触史或生肉食用史,其中职业为农牧民者32例。临床表现与累及的脏器有关,主要表现为消化系统症状(上腹不适、恶心、呕吐和黄疸),13例无明显症状,为体检发现。
CT检查示23例单发病灶,21例多发病灶。多发病灶中15例为肝内多发病灶,未累及其他脏器;6例累及多脏器(均存在肝内病灶,图1),包括肺(3例)、腹腔(3例)、盆腔(1例)、子宫壁(1例)、胆囊(1例)和脑(1例,图2)等。39例累及肝脏的病例中,29例累及肝右叶、8例累及肝左叶、2例累及肝尾叶。CT诊断结果:占位性质待定2例、棘球蚴病42例;33例考虑为AE,4例考虑为细粒棘球蚴病,5例考虑为棘球蚴病伴脓肿形成(进一步分类困难)。
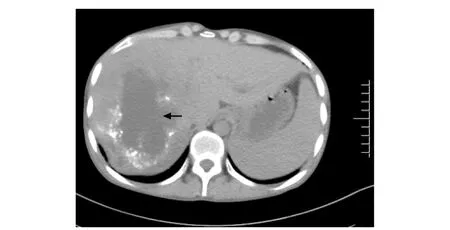
图1 男性患者,24岁,腹部CT示肝脏右叶巨大团块状低密度影,边缘可见地图钙化灶掺杂(箭头)

图2 与图1为同一患者,颅脑CT示右侧颞叶团片状稍高密度占位(箭头),周围大片低密度水肿影环绕
44例患者均行手术治疗。随访2~82个月,死亡3例(其中1例死于疾病复发伴多脏器受累)、存活41例(复发2例)。44例患者的临床资料见表1。

表1 44例泡状棘球蚴病患者的临床资料
2.2 病理特征
2.2.1 大体观察
送检部位包括肝脏(36例)、肺(6例)、脑(1例)和子宫壁(1例);36例为巨块型,6例为结节型,2例为混合型。平均病变直径(10.1±5.6)cm,周围均可见少量正常脏器组织,病灶边缘不整,与周围组织分界不清,外周无纤维包膜,呈浸润性生长;切面呈灰褐、灰黄色,质硬,呈囊实性,可见多个疏密不等的小囊泡,呈蜂窝状(图3),部分囊泡内可见豆渣样碎屑。32例可见片状坏死区,26例可见灰黄色砂砾样钙化,5例可见脓腔。

图3 肝脏切面均可见疏密不等的多个小囊泡,呈蜂窝状
2.2.2 镜下观察
HE染色可见泡状棘球蚴虫体呈球形囊泡状结构,囊泡大小、形状不一,外周无完整纤维包膜,囊泡直径0.1~5 mm,聚集成群,形成蜂窝状结构;囊泡外层囊壁为不规则弯曲、突起或褶叠的粉染角质层,偶见内层囊壁生发层及原头蚴(仅1例患者的病理标本中发现原头蚴,图4A);囊泡周围与囊泡间可见凝固性坏死。囊泡以外生性方式增殖为主,包括分隔性增殖(图4B)与隔膜性增殖(图4C)。早期病变可见坏死的囊泡周围大量嗜酸性粒细胞浸润,伴肉芽肿逐渐形成(图4D),部分囊泡不断增生、扩大并与邻近肉芽肿融合;晚期陈旧性病变见粉尘状钙化和大片状坏死(图4E)。44例病例均可见早期肉芽肿性病变和晚期陈旧性病变不同程度混合存在,5例伴脓肿形成。全部病例均可见周围组织萎缩、变性伴大量炎症细胞浸润,其中20例可见明显小血管炎,血管壁增厚、管腔狭窄,部分管腔闭塞发生坏死。

图4 泡状棘球蚴病标本显微镜下病理表现(箭头)
3 讨论
本研究对西藏自治区人民医院44例AE患者的临床表现与病理特征进行了总结,发现患者以青壮年农牧民为主,肝脏为主要受累部位。病变组织显微镜下可见泡状棘球蚴虫体呈球形囊泡状结构,病变周围组织萎缩、变性伴大量炎症细胞浸润,不同时期的病变混合存在。经根治性手术切除后,多数患者预后良好。
我国是棘球蚴病高发地区之一,棘球蚴病在我国多见于西藏、四川、青海等区域[6- 8],且以西藏地区人群中棘球蚴病检出率(1.71%)和患病率(1.66%)最高[8]。AE较细粒棘球蚴病少见,其发病率约为1/100万,在棘球蚴病中占比约为3%[9]。2013年9月至2021年4月,西藏自治区人民医院病理科有病理存档记录的棘球蚴病患者1246例,其中1202例(96.5%)为细粒棘球蚴病,AE仅占3.5%,与既往文献报道结果基本一致[9]。
本研究发现,AE病例以青壮年为主,20~40岁人群占比72.8%,男女比例1∶1.59,与既往文献报道结果相符[10- 11]。患者均有明确的犬、牛、羊等动物接触史或生肉食用史,72.7%为农牧民,与西藏地区饲养犬/牦牛等家畜、挤牛奶、捡拾牛粪等工作主要为青壮年女性,其接触棘球蚴虫卵的概率明显高于男性有关。70.5%的AE患者具有明显的临床表现,其中以消化系统、呼吸系统症状较常见,与该病易累及肝脏和肺有关。本研究88.6%的病例病变部位为肝脏。肝脏最易受累的原因:虫卵经口进入消化道,在胃或十二指肠孵化为六钩蚴,进而穿过胃肠壁进入门静脉,停留在肝脏并发育成囊而致病[12]。六钩蚴也可进入肠壁淋巴管,经胸导管入血至全身各处,引起多脏器受累。本研究13.6%的患者为多器官受累。此外,微小的虫卵可随风飘散进入呼吸道,导致肺组织受累[13]。
影像学检查是AE诊断的重要手段。CT具有分辨率高、成像清晰的优势,可为AE的诊断提供重要参考信息。典型AE病灶的CT表现为类圆形/不规则形混合密度影,边界模糊,其内见低密度点状钙化,病灶中心可见低密度坏死区;增强扫描后可见病灶边缘不规则强化,坏死液化区域较大者,病灶呈厚壁脓肿样改变[14- 15]。本研究44例AE患者,术前均行CT检查,42例诊断为棘球蚴病,其中33例(78.6%)考虑为AE,提示CT检查对典型AE病例的诊断有一定参考价值。本研究2例AE患者经CT检查占位性质难以明确,4例误诊为细粒棘球蚴病,5例由于伴脓肿形成无法明确诊断,提示对于不典型病例,尤其出现继发感染或处于疾病晚期的病例,影像学诊断的难度增加,需行病理检查进一步明确诊断。
由于AE病例相对少见,目前对其病理特征尚缺乏系统认知[16]。组织形态学表现方面,典型病灶组织内可见广泛分布,大小、形状不一的囊泡,具有灶状集中的倾向,呈海绵状或蜂窝状,囊泡数目从数个至数十个不等。囊泡为泡状棘球蚴虫体,其囊壁内层为生发层,表现为薄的疏松状粉染物,大多脱落,外层为厚度不均的角质层,囊泡之间为坏死组织。病变边缘可见囊泡以外生性方式增殖并向周围组织浸润生长。本研究病例中可观察到分隔性增殖(囊泡壁全层从一处或多处向中心突入并收缩断离,将一个囊泡分隔成两个或多个囊泡)及隔膜性增殖(生发层增生形成隔膜,将一个囊泡分隔成两个或多个囊泡),其中分隔性增殖多见,隔膜性增殖较少见。早期病变可见泡状棘球蚴周围嗜酸性粒细胞浸润,部分泡状棘球蚴坏死,坏死灶周围出现异物巨细胞和上皮样细胞,其外周见大量炎症细胞浸润,形成典型具有3层结构的肉芽肿病变;部分囊泡继续增生致使肉芽肿病变不断扩大并与邻近肉芽肿融合。晚期陈旧性病变中,紧贴囊泡周围坏死区可见粉尘状钙化和大片坏死。同一病例中,早期病变和陈旧性病变可混合存在,外周为早期肉芽肿改变,中间为陈旧性病变。本研究44例AE病例均同时存在早期病变和陈旧性病变,均经病理学检查明确诊断。显微镜下很难发现发育良好的泡状棘球蚴生发层和原头蚴(本研究仅1例标本可见原头蚴),可能由于人类并非泡状棘球蚴最适宜的中间宿主。
对于AE高发区,依据影像学检查和典型病理学表现,明确诊断并不困难。对于低发病区域或病例表现不典型时,需注意与原发性肝癌、细粒棘球蚴病、脓肿、真菌感染、结核等进行鉴别诊断,避免漏诊和误诊。原发性肝癌伴大片坏死和继发改变时与AE的病理表现相似,若发现恶性肿瘤细胞有助于二者的鉴别。细粒棘球蚴病的病理学可见完整纤维囊壁,棘球蚴大小从数毫米至数十厘米不等,母囊内见子囊、孙囊,与AE鉴别诊断难度不大。在与其他形成肉芽肿、坏死区域的感染性病变如脓肿、真菌感染或结核鉴别诊断时,应注意区分有无AE典型的多灶囊泡状结构。若坏死严重,难以发现囊泡结构,需结合患者的居住史、职业、临床表现、血清学表现与影像学特征综合判断,必要时进行特殊染色以排除真菌和结核杆菌感染。
AE一经发现应早诊早治,如未及时治疗,随棘球蚴囊泡不断增长,受累器官功能障碍愈发严重,确诊后10年内病死率高达90%[17]。常用的治疗措施包括药物治疗、姑息性手术和根治性手术,其中根治性手术为首选治疗方法。对于病变仅累及肝脏、肺等单器官单病灶的病例,行根治性手术可达到较好的疗效;对于病变累及单器官多病灶的病例,如条件许可亦推荐行根治性切除术。多脏器累及的晚期AE患者,可行姑息性手术并辅以阿苯达唑类药物治疗[2],一定程度上可消除并发症、改善临床症状,提高生活质量。对于拒绝手术或手术效果不佳者,可给予足够疗程的阿苯达唑或奥本达唑药物治疗。文献报道,单纯药物治疗与单纯病灶细胞减灭术在患者存活率和寄生虫相关并发症发生率方面无显著差异[18]。本研究31例行根治性手术,13例行姑息性手术后辅以药物治疗(均为晚期多脏器受累或多次复发病例),其中3例死亡患者均为姑息性手术治疗者,再次验证了根治性手术的疗效。
本研究局限性:为回顾性研究且病例数较少,可能存在偏倚,待积累更多病例后进一步深入研究。
综上,西藏地区AE较细粒棘球蚴病少见,患者以青壮年农牧民为主,女性更多见。肝脏为主要受累部位,少数病例可累及肺或多脏器。影像学检查对典型病例的辅助诊断具有较好的参考价值,对非典型病例或合并脓肿时需通过病理检查确诊。病理检查可见泡状棘球蚴虫体呈球形囊泡状结构,病变周围组织萎缩、变性伴大量炎症细胞浸润,且不同时期的病变常混合存在。推荐行根治性手术治疗,以避免复发。
作者贡献:罗含欢负责病理阅片、资料收集、数据分析及论文撰写;霍真负责研究设计,指导研究实施与论文修订;王倩负责收集病理资料;尼玛负责收集影像学资料;边巴扎西负责收集临床资料。
利益冲突:所有作者均声明不存在利益冲突
