羊源沙门氏菌的分离鉴定及致病性和耐药性分析
2022-06-06王思敏杨江峰赵晓锟郭晶晶兰金苹于小杰
王思敏,杨江峰,赵晓锟,张 雷,郭晶晶,兰金苹,于小杰,王 净
(1.张家口市宣化区农业农村局,张家口 075100;2.河北北方学院动物科技学院,河北省肉羊产业技术创新战略联盟,张家口 075000)
沙门氏菌(Salmonella)是一种可引起人和动物感染的致病菌,其耐寒、耐干燥、不耐热,在日常环境中到处存在,在不同的环境中可存活数周甚至数月。沙门氏菌被美国细菌学家丹尼尔·埃尔默·萨尔蒙(Daniel Elmer Salmon)发现,于1885年首次从猪中分离出肠炎沙门氏菌血清型猪霍乱弧菌[1]。到目前为止,沙门氏菌属分为邦格沙门氏菌和肠炎沙门氏菌2种,超过2 600种不同的血清型已被分离鉴定[2]。羊沙门氏菌病是由多种血清型沙门氏菌引起羊的一种传染病,而引起羊患病的有肠炎沙门氏菌亚种羊流产沙门氏菌[3]、双亚利桑那肠沙门氏菌[4-6]和鼠伤寒沙门氏菌[7]可引起羊发烧、食欲不振、腹泻及排黏稠的粪便,母羊流产、消瘦、出现败血病及急性或慢性肠炎,甚至死亡[8]。羊源沙门氏菌影响了羔羊的生长发育和成活率,降低了羊的生产性能,给养羊业带来很大经济损失。同时羊源沙门氏菌具有多元化的基因,根据地区差异和气候特征会演化出多种耐药机制,加上人为的不合理用药,导致菌株产生耐药性而难以防治。因此,监测菌株的耐药性和致病性可提供合理的防治措施。
本试验旨在研究张家口某地区羊源沙门氏菌的耐药性和致病性,检测分离株的耐药基因和毒力基因,分析其耐药性、致病性与相关基因的关系,以期为羊源沙门氏菌的耐药性和分子流行病学监测提供可靠依据,为临床检测和实际用药提供指导。
1 材料与方法
1.1 材料
1.1.1 标准菌株及试验动物 试验所用标准菌株鼠伤寒沙门氏菌ATCC 14028和大肠杆菌ATCC 44102均购自河南信阳莱耀生物科技有限公司。4周龄体重约20 g SPF级健康昆明雌性小鼠购自河北北方学院实验动物中心。
1.1.2 样品来源 2020年11月从张家口市宣化区随机选择了15个羊场采集150份羔羊肛拭子样品。
1.1.3 主要试剂 缓冲蛋白胨水培养基、SS琼脂培养基、伊红美蓝琼脂培养基、LB肉汤培养基、MH肉汤培养基均购自杭州百思生物技术有限公司;PBS、沙门氏菌成套生化鉴定管(SMGB)均购自青岛高科技工业园海博生物技术有限公司;革兰氏染色液购自深圳康泰生物制品股份有限公司;沙门氏菌属诊断血清购自宁波天润生物药业有限公司;青霉素(PEN)、阿莫西林(AMO)、复方新诺明(T/S)等药敏片均购自常德比克曼生物科技有限公司;AxyPrep细菌基因组DNA小量试剂盒购自康宁生命科学有限公司;DNA Marker购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 细菌分离鉴定
1.2.1.1 细菌分离培养 将肛拭子放入缓冲蛋白胨水培养基(BPW)中,于37 ℃培育12~15 h。用接种环接种到伊红美蓝培养基和SS培养基中,于37 ℃培育24~36 h,检测是否存在沙门氏菌菌落,分别观察到琥珀色菌落和无色透明菌落即可[9]。挑选疑似菌落接种于LB培养基中,于37 ℃培育20~24 h后,4 ℃保存。
1.2.1.2 革兰氏染色及生化鉴定 挑选纯化培养的单菌落进行革兰氏染色,显微镜下观察菌体形态[10]。使用沙门氏菌成套生化鉴定管试剂盒进行生化鉴定。选择可疑菌落,接种到色氨酸肉汤(靛基质)、赖氨酸脱羧酶培养基等[11]。于37 ℃培养24~28 h,参照GB 4749.4-2010标准判断结果[12]。
1.2.1.3 细菌血清型鉴定 采用玻板凝集试验法用沙门氏菌属诊断血清试剂盒对分离菌进行血清型鉴定[13]。
1.2.1.4 PCR扩增鉴定 使用AxyPrep细菌基因组DNA小量试剂盒提取分离菌DNA,-20 ℃保存备用。根据沙门氏菌属基因invA的核苷酸序列(GenBank登录号:MK017942.1)合成1对引物,PCR检测鉴定分离菌株。 引物序列为:上游引物F:5′-GTGAAATTATCGCCACGTTCGGGC-3′;下游引物R:5′-TCATCGCACCGTCAAAGGAACC-3′。预期扩增片段大小为284 bp[14]。PCR反应体系20 μL:PCR 2×TaqPlus MasterMix 10.5 μL,上、下游引物各0.75 μL,DNA模板 1.5 μL,灭菌蒸馏水6.5 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,59 ℃退火45 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min;4 ℃保存。取 PCR 反应产物进行1.0%琼脂糖凝胶电泳检测。
1.2.2 分离株致病性与毒力基因相关分析
1.2.2.1 致病性试验 将65只SPF级健康昆明小鼠分为5组,4个感染组(A、B、C、D组)和1个对照组,每株分离株为1个感染组,每组15只,对照组5只,每个感染组分为有3小组,每小组5只,分别腹腔注射不同梯度浓度的菌液0.5 mL,对照组注射等体积灭菌生理盐水。感染后分笼喂养连续观察7 d,每天隔6 h观察1次[15]。观察小鼠精神状态和饮食状态,记录小鼠的发病和死亡数量。根据统计情况,按改良寇氏法公式计算小鼠半数致死量(LD50)。
LD50=lg-1[Xm-i(∑P-0.5)]
其中,Xm,最大剂量组剂量对数值;i,相邻两组剂量高剂量与低剂量之比的对数;∑P,各组动物死亡率之总和[16],剖检死亡小鼠,观察病理变化,取感染组织进行细菌分离镜检。试验结束后扑杀所有小鼠,随机选择试验组和对照组小鼠剖检和镜检。
1.2.2.2 毒力基因PCR扩增和测序 参考GenBank登录的毒力基因序列和相关文献[17-20],设计9对引物分别扩增毒力岛基因hilA、avrA、sseL、ssaQ、mgtC、siiD、sopB,肠毒素基因stn,质粒毒力基因spvR。引物信息见表1。引物均由深圳华大基因股份有限公司合成。PCR反应体系25 μL:PCR 2×TaqPlus Master Mix 12.5 μL,上、下游引物各0.75 μL,DNA模板 2 μL,ddH2O 9 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,退火(退火温度见表1)45 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min;4 ℃保存。根据琼脂糖凝胶电泳结果,将毒力基因阳性的PCR产物送深圳华大基因股份有限公司进行测序,并与NCBI中相应的参照基因进行BLAST比对分析。
1.2.3 分离株耐药性与耐药基因的相关分析
1.2.3.1 药敏试验 采用Kirby-Bauer纸片扩散法进行药敏试验。用无菌棉签将菌液均匀涂抹在MH固体培养基上,药敏片粘贴到培养基表面,37 ℃培养20~24 h,测量抑菌圈直径[21]。按照CLSI指定的标准进行判定。
1.2.3.2 耐药基因PCR扩增和测序 参考GenBank登录的耐药基因序列和相关文献[22-24],设计11对引物并送深圳华大基因股份有限公司合成。引物信息见2。用AxyPrep细菌基因组DNA小量试剂盒提取DNA模板,分别扩增β-内酰胺类耐药基因blaTEM、blaCMY、blaOXA,氟喹诺酮类耐药基因qnrS、oqxA、oqxB,磺胺类耐药基因sul1、sul2、sul3,四环素类耐药基因tetB和氨基糖苷类耐药基因aadA1。PCR反应体系25 μL:PCR 2×TaqPlus MasterMix 12.5 μL,DNA模板 2 μL,ddH2O 9 μL,上、下游引物各0.75 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,退火(温度见表1)45 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min;4 ℃保存。根据琼脂糖凝胶电泳结果,将耐药基因阳性的PCR产物送深圳华大基因股份有限公司进行测序,并与NCBI中相应的参照基因进行BLAST比对分析。

表1 毒力基因PCR引物信息
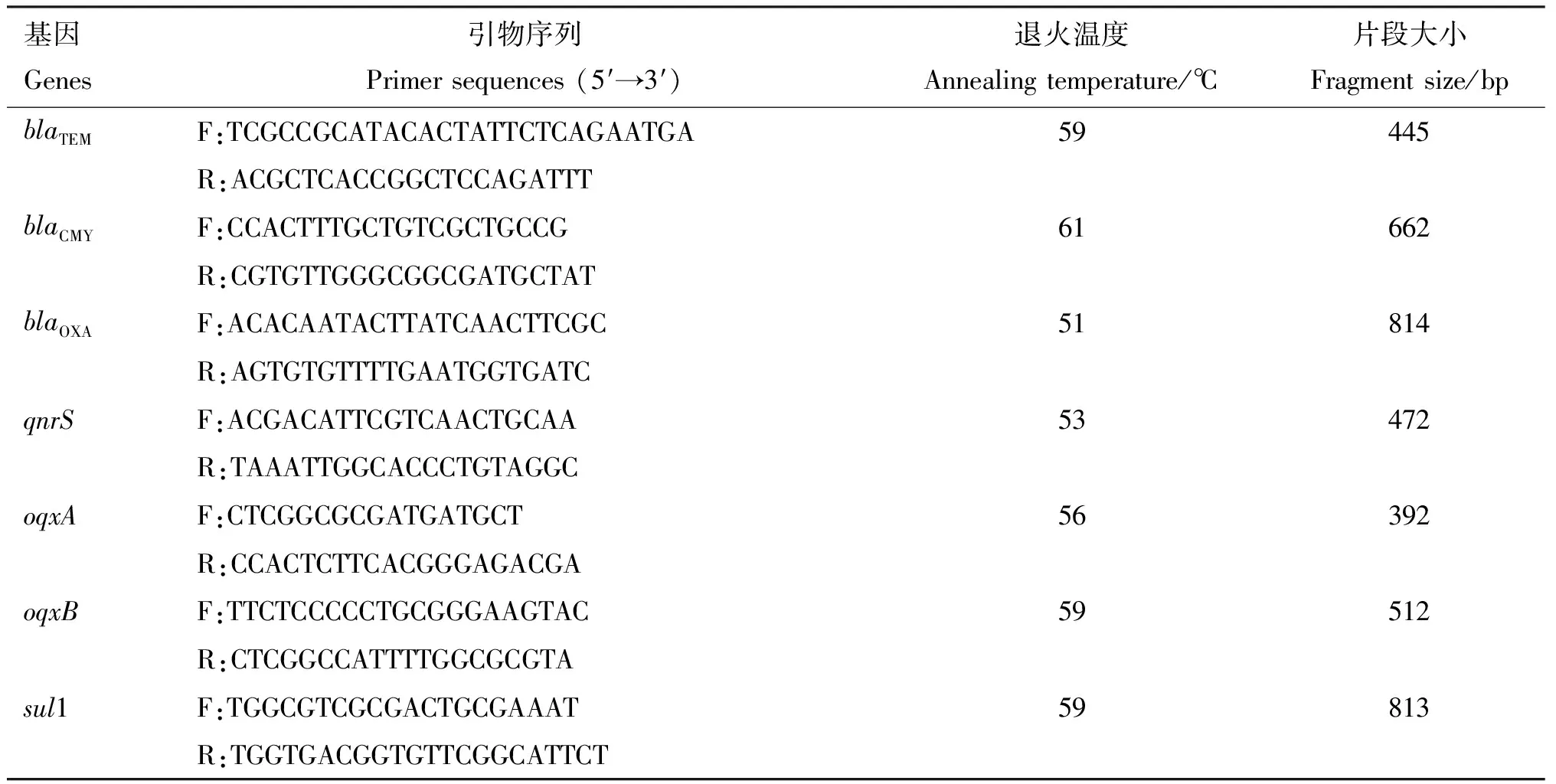
表2 耐药基因PCR引物信息
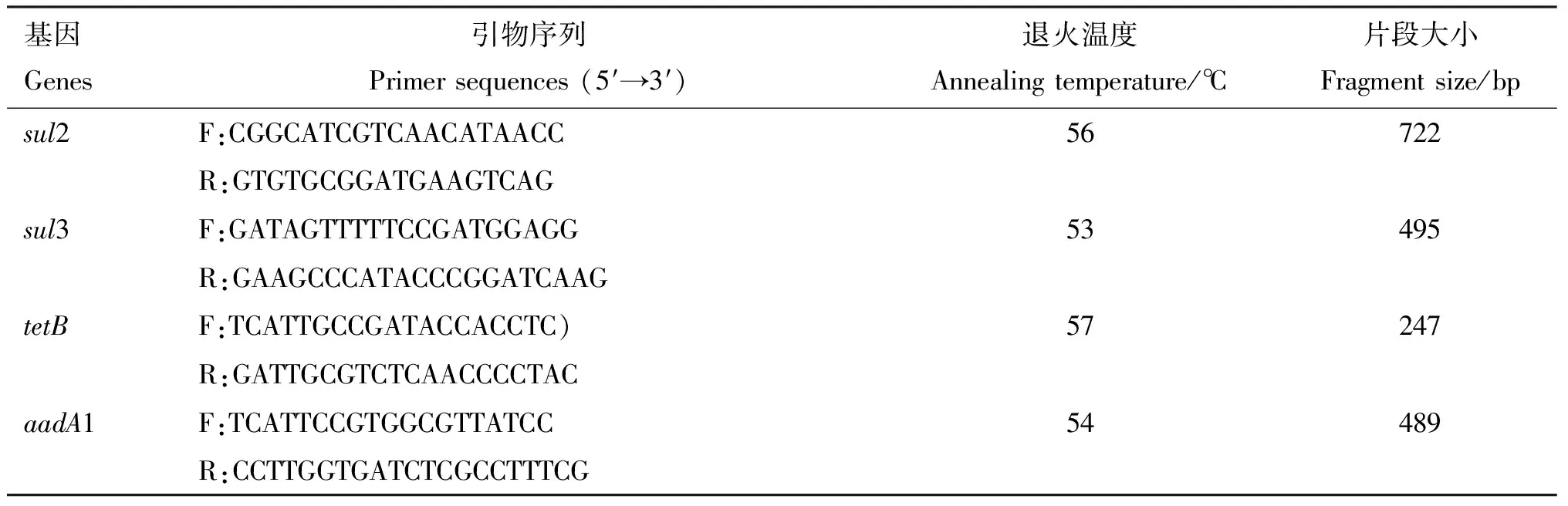
续表
2 结 果
2.1 沙门氏菌分离鉴定
2.1.1 沙门氏菌分离培养 对150份羔羊肛拭子样品进行沙门氏菌分离,培养24 h后在SS培养基上呈圆形,凸起,无色半透明状,表面圆润光滑(图1),初步分离得到4株沙门氏菌N1、N2、N3、N4,分离率为4/150(2.7%)。
图1 SS培养基上疑似沙门氏菌菌落形态Fig.1 Morphology of suspected Salmonella colonies on the SS medium
2.1.2 沙门氏菌镜检和生化鉴定 分离菌株经革兰氏染色后显微镜镜检,可见革兰氏阴性短杆菌,单独存在,偶见2个一起(图2)。生化鉴定结果显示,甘露醇、山梨醇、卫矛醇、赖氨酸脱羧酶阳性,色氨酸、尿素酶、氰化钾、水杨苷、丙二酸盐、ONPG阴性(表3),4株分离株都符合沙门氏菌的生化特性。
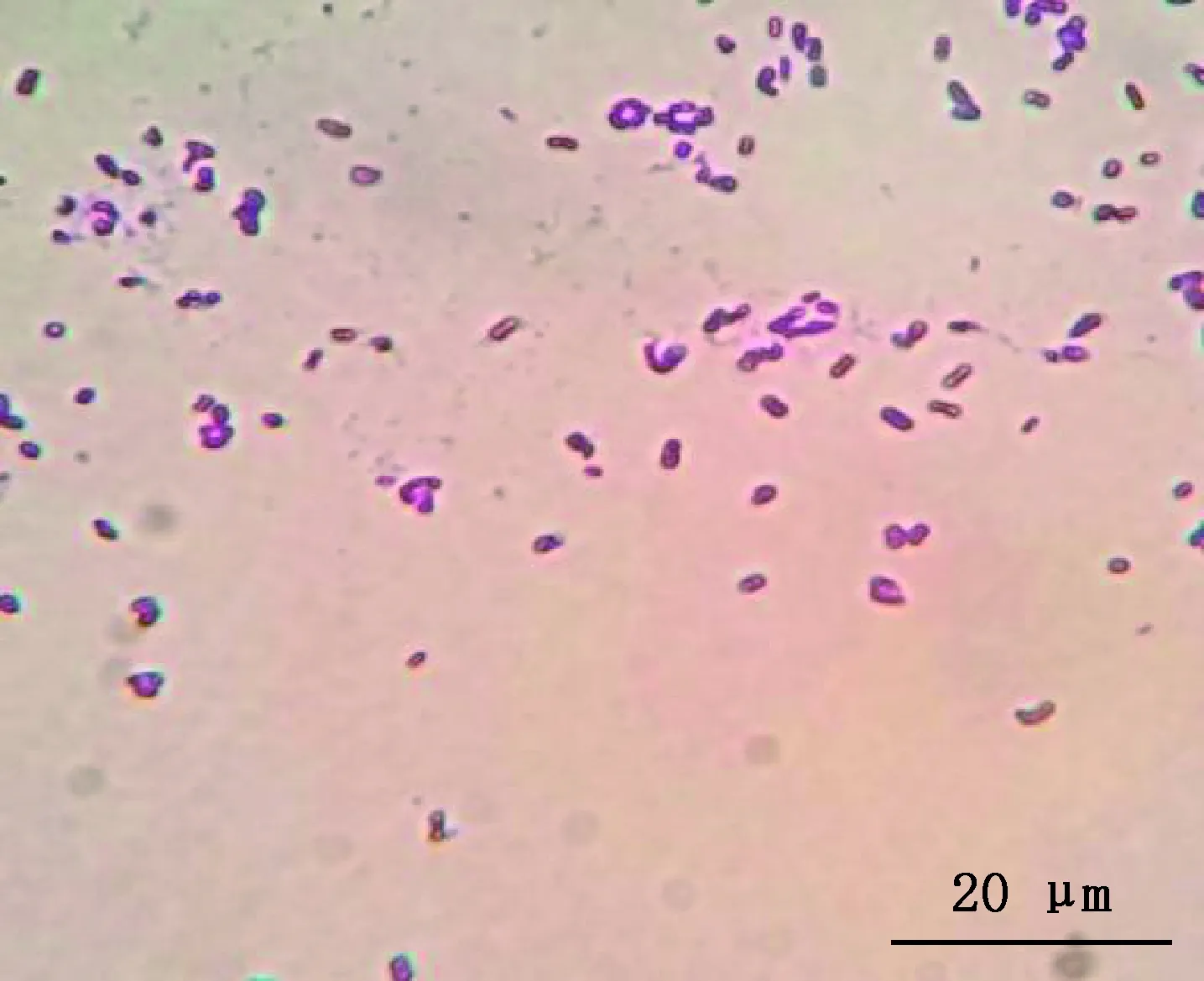
图2 分离株革兰氏染色镜检图(1 000×)Fig.2 Gram staining microscopic examination of the isolated strains (1 000×)
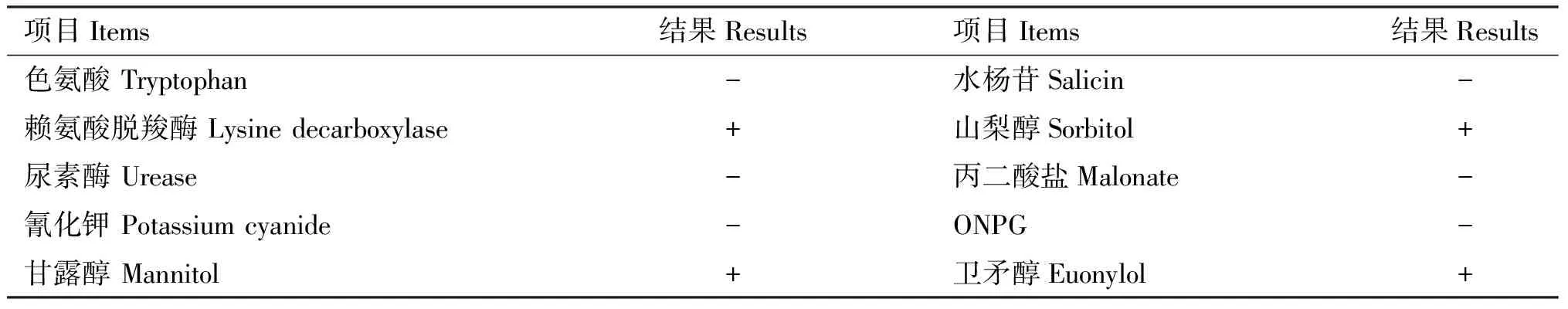
表3 生化试验结果
2.1.3 沙门氏菌PCR鉴定和血清型鉴定 根据沙门氏菌属基因invA核苷酸序列,PCR扩增4株分离株,结果表明,所有分离株均扩增出大小为284 bp的明亮条带(图3),确定分离到4株沙门氏菌。对分离株进行血清型鉴定,结果显示,4株沙门氏菌均为B群血清型,均为鼠伤寒沙门氏菌。
2.2 沙门氏菌分离株致病性与毒力基因检测及相关分析
2.2.1 沙门氏菌分离株致病性试验结果 试验组小鼠感染后出现精神萎靡、腹泻、食欲下降、被毛凌乱等症状,部分小鼠24~72 h后死亡,而对照组小鼠体征正常。试验组小鼠剖解后表现肠系膜充血出血,肠壁充血变薄,肠内肿胀和充满稀样黑褐色粪便,说明分离株对小鼠具有致病性。测定其LD50介于5.67×107~6.45×107CFU之间,具体信息见表4。
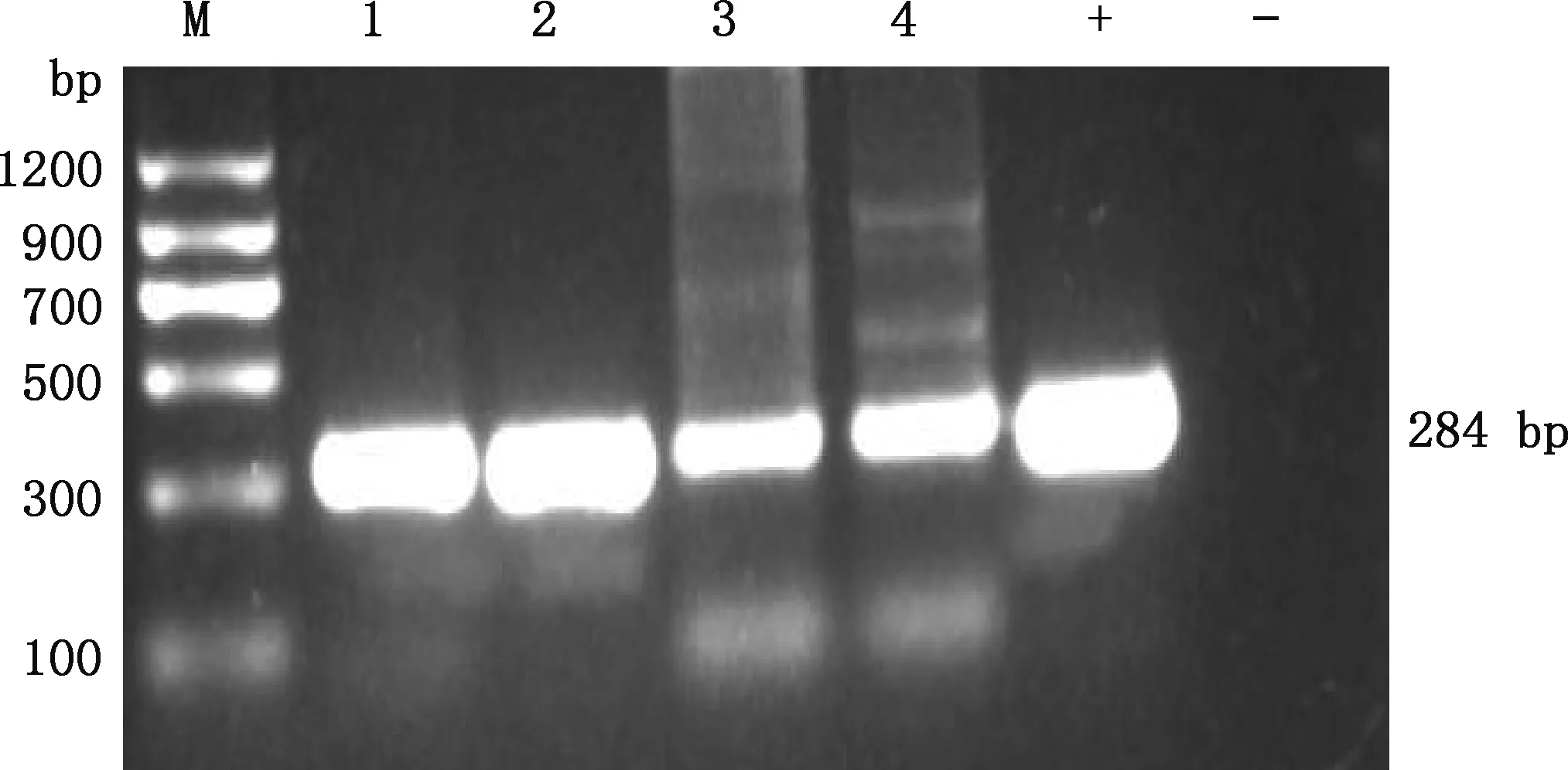
M,DNA Marker Ⅱ;1~4,分离株N1、N2、N3和N4;+,阳性对照;-,阴性对照。下同M,DNA Marker Ⅱ;1-4,Isolates N1,N2,N3 and N4,respectively;+,Positive control;-,Negative control.The same as below图3 沙门氏菌分离株invA基因PCR扩增结果Fig.3 PCR amplification results of invA gene of Salmonella isolates
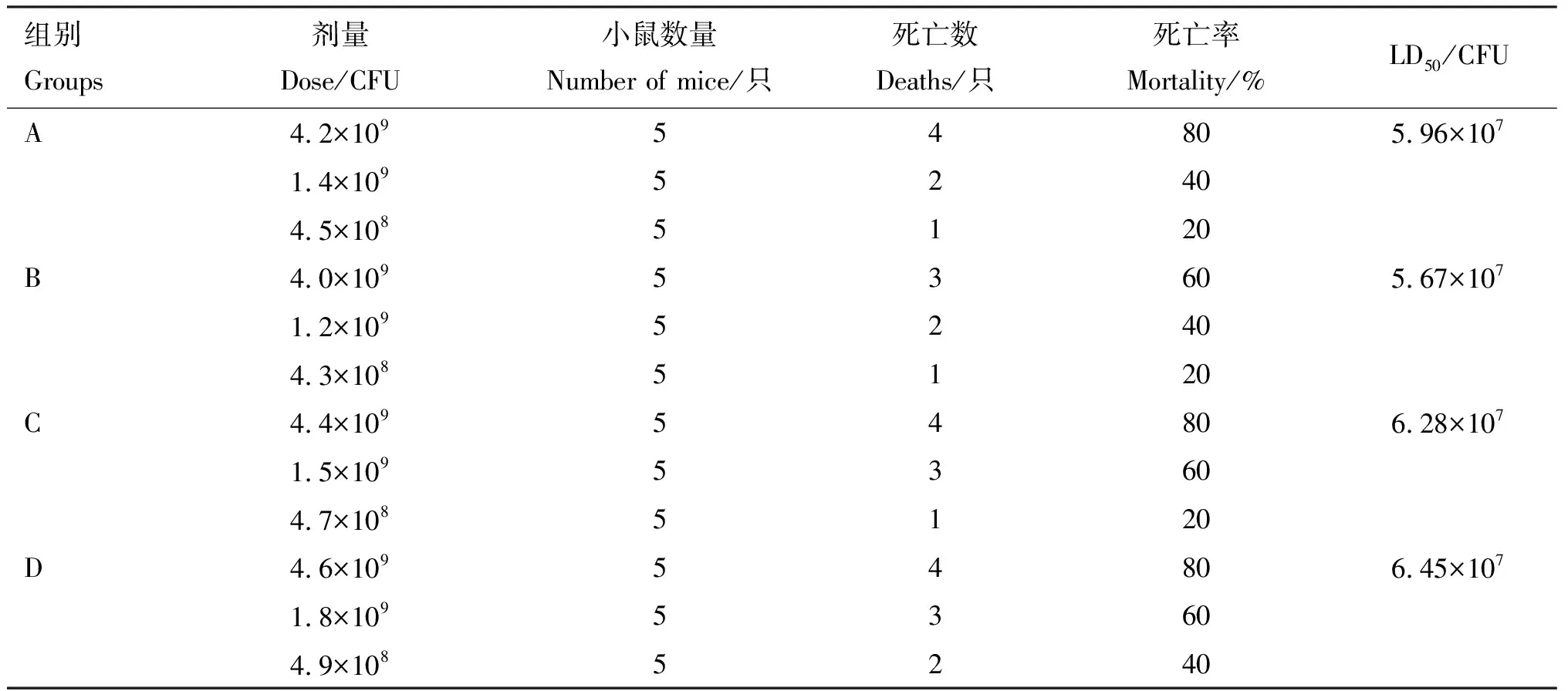
表4 沙门氏菌分离株对小鼠的毒力
2.2.2 沙门氏菌分离株毒力基因PCR扩增及测序分析 毒力基因PCR检测结果表明,在检测的9种毒力基因中有6种毒力基因(avrA、sseL、mgtC、sopB、stn和spvR基因)的检出率均为100%。检测的另外3种毒力基因中hilA和siiD基因阳性检出率为75%,ssaQ基因阳性检出率为50%,毒力基因的检出率均>50%(图4)。9种毒力基因的测序结果经NCBI数据库比对,相似性达96.3%以上。
2.2.3 沙门氏菌分离株毒力表型与毒力基因相关性分析 由表5可知,分离株毒力表型和毒力基因呈正相关关系,4株分离株均携带8种以上毒力基因,其中N4携带9种毒力基因,毒力最强,其余3株中,N1缺少毒力岛基因ssaQ,N2缺少毒力岛基因siiD,N3缺少毒力岛基因hilA,毒力N3>N1>N2。

表5 沙门氏菌分离株毒力表型与毒力基因对比
2.3 羊源沙门氏菌分离株耐药性与耐药基因检测结果
2.3.1 药敏试验结果 采用Kirby-Bauer纸片扩散琼脂法测定分离株对10种抗菌药物的敏感性。结果显示,沙门氏菌分离株对复方新诺明、利福平、林可霉素、青霉素、氨苄西林耐药率为100%;对阿莫西林的耐药率为50%;对头孢拉定、四环素的耐药率为25%;对庆大霉素、环丙沙星的耐药率为0(表6)。表明羊源沙门氏菌分离株对复方新诺明、利福平、林可霉素、青霉素和氨苄西林产生了很强的耐药性,对环丙沙星和庆大霉素较为敏感。
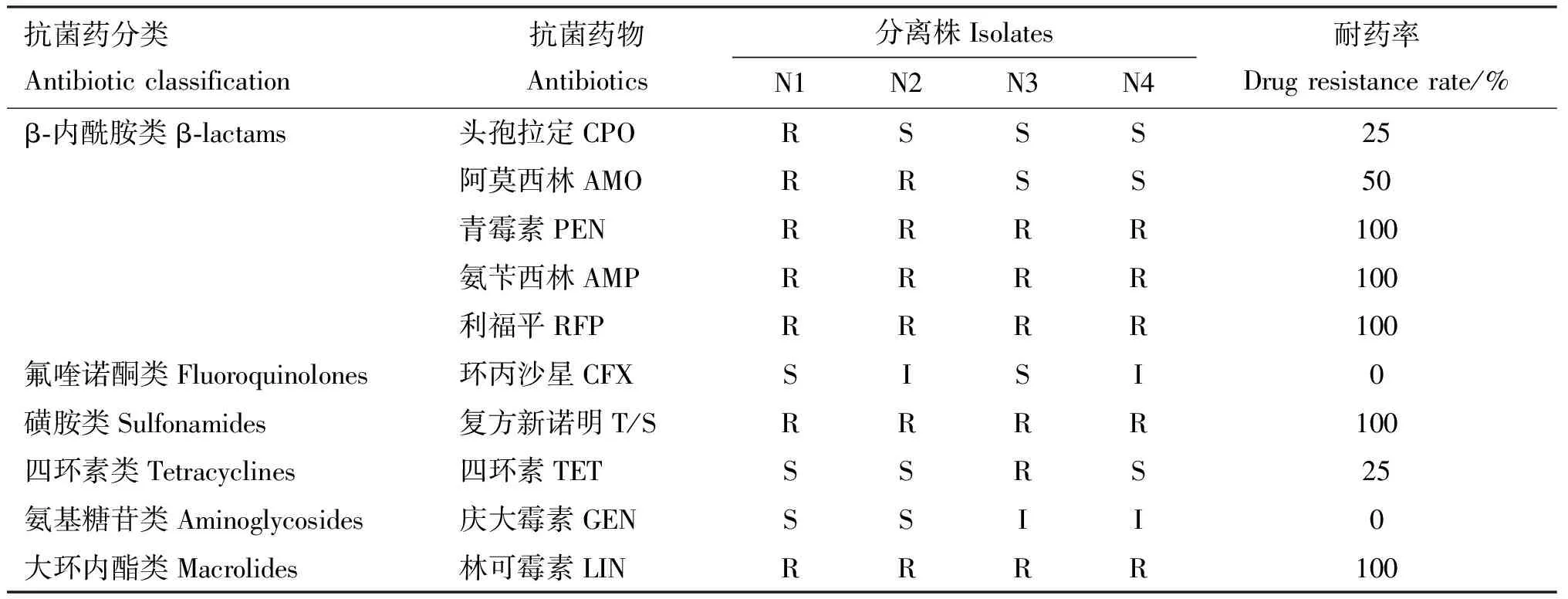
表6 沙门氏菌分离株药敏试验结果
R,耐药;I,中介;S,敏感
R,Resistant;I,Intermediate;S,Sensitivity
2.3.2 沙门氏菌分离株耐药基因PCR扩增及测序分析 耐药基因检测结果显示,blaTEM、qnrS、sul1、sul2基因检出率为100%,aadA1基因检出率为75%,blaCMY、oqxA和sul3基因检出率均为50%,blaOXA基因检出率为25%,而oqxB和tetB基因则未被检出(图5)。9种耐药基因的测序结果经NCBI数据库比对,相似性均达94.7%以上。
2.3.3 沙门氏菌分离株耐药表型与耐药基因相关性分析 由表7可知,分离株耐药表型和耐药基因整体呈正相关,分离株携带β-内酰胺类耐药基因blaTEM、blaCMY、blaOXA越多,耐药表型对β-内酰胺类药物耐药的越多;分离株携带2种以上磺胺类耐药基因sul1、sul2、sul3,耐药表型对磺胺类药物均耐药;4株分离株均未携带四环素类耐药基因tetB,3株的耐药表型对四环素类药物敏感;分离株N1不携带氟喹诺酮类耐药基因和氨基糖苷类耐药基因,耐药表型对这2类药物都敏感;但另外3株N2、N3、N4均携带氟喹诺酮类耐药基因qnrS、oqxA和氨基糖苷类耐药基因aadA1,耐药表型显示对这2类药物表现中介或敏感。
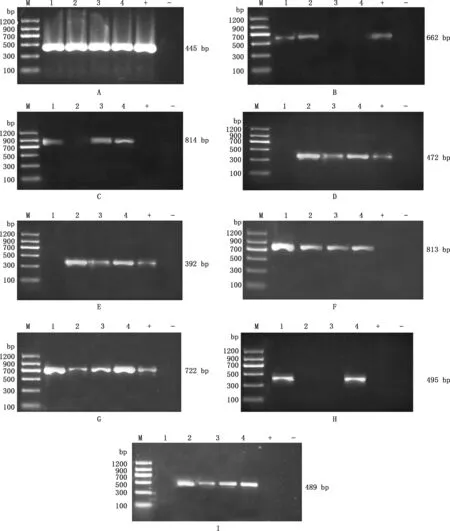
A~I,分别为blaTEM、blaCMY、blaOXA、qnrS、oqxA、sul1、sul2、sul3和aadA1基因A-I,blaTEM,blaCMY,blaOXA,qnrS,oqxA,sul1,sul2,sul3 and aadA1 genes,respectively图5 沙门氏菌分离株耐药基因PCR扩增结果Fig.5 PCR amplification of drug resistance gene of Salmonella isolates
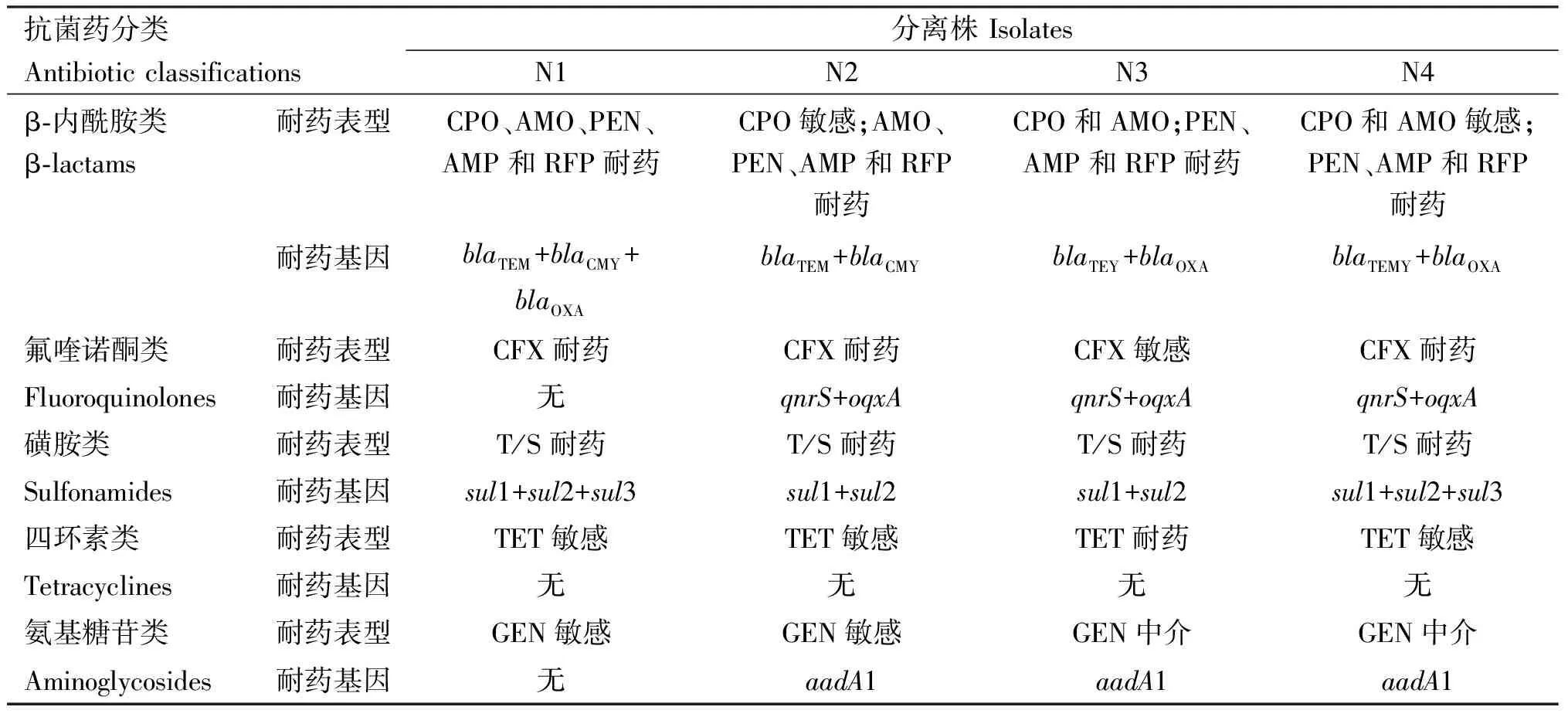
表7 沙门氏菌分离株耐药表型与耐药基因对比
3 讨 论
羊源沙门氏菌是一种重要的人兽共患病病原,英国动植物卫生机构(APHA)在2017年在对羊群进行死后检查时发现了一种潜在的新鼠伤寒沙门氏菌菌株,该羊群512只羊中有207只在1个月内死亡[25]。这种新的鼠伤寒沙门氏菌菌株与英国以前暴发的菌株不同,可能相差5个核苷酸多态性突变,其对所有抗生素均耐药。这种分离株引起的疾病一旦暴发,会危及所有人类和动物。而本研究分离得到的4株羊源沙门氏菌血清型均为鼠伤寒沙门氏菌,鉴于羊源沙门氏菌潜在的危险性和羊源沙门氏菌可用数据的稀缺性,加强对羊源沙门氏菌的研究尤为重要。
沙门氏菌共有约90%的毒力基因存在于DNA中,其余10%毒力基因存在于毒力因子中,这部分主要决定该血清型致病性的结构、产物和方式[26]。其大多数编码此类因子的基因位于沙门氏菌致病岛(SPI)中,也可能在毒力质粒(pSLT)中,更确切地说在毒力质粒的spv操纵子上。但尚未明确在spv操纵子中产生的某些蛋白质的机制及其在毒力中的作用,需进行更全面的研究[27]。本试验中4株分离株均携带毒力岛基因avrA、mgtC、sopB、sseL和肠毒素基因stn及质粒毒力基因spvR,hilA、siiD、ssaQ基因阳性检出率也均在50%以上。分离株毒力表型和毒力基因呈正相关,4株分离株均携带8种以上毒力基因,其中N4携带9种毒力基因,毒力表型毒力最强。宋晟等[28]分离出1株鸡源沙门氏菌,该菌株共有致病基因27个,携带包括系统性红斑狼疮致病基因、侵袭上皮细胞致病基因和介导菌株对宿主细胞的黏附致病基因等多种致病因子。张捷等[29]通过研究北京地区禽类中分离的36株沙门氏菌基因型及毒力基因,获得11个ST型。菌株均携带毒力岛SPI1~SPI5代表性基因,66.7%含毒性质粒spvB。沙门氏菌毒力岛基因相对稳定,但携带毒力基因对毒力表型的差别有一定影响。目前不同毒力基因对羊源沙门氏菌致病性影响的研究较少,需进一步研究。
药敏试验结果显示,4株羊源沙门氏菌分离株对10种抗菌药呈不同程度耐药,且均为多重耐药菌。分离株均对β-内酰胺类的青霉素、氨苄西林、利福平耐药,对磺胺类的复方新诺明和大环内酯类的林可霉素也表现耐药,且都携带2种以上的β-内酰胺酶类耐药基因blaTEM、blaCMY、blaOXA和磺胺类耐药基因sul1、sul2、sul3,耐药表型和耐药基因整体呈正相关,但有些基因可能不表现,与冯林等[30]和江萍等[31]研究结果相同之处是对β-内酰胺类抗生素耐药严重,不同的是其分离的羊源沙门氏菌均对氟喹诺酮类耐药严重,而本研究得到的羊源沙门氏菌对磺胺类抗生素存在耐药表型和耐药基因,检出率较高。由此可知,由于地域不同及用药差异,羊源沙门氏菌耐药情况有所不同,需加强监测,为避免羊源沙门氏菌耐药范围扩大,应合理规范使用抗生素。
4 结 论
本试验分离得到4株羊源沙门氏菌,血清型均为鼠伤寒沙门氏菌,有一定致病性,毒力基因检出率较高,均在50%以上。分离株对β-内酰胺类和磺胺类抗菌药耐药严重,耐药表型和耐药基因均存在,临床用药可考虑庆大霉素和环丙沙星作为治疗药物。
