催乳素对内蒙古绒山羊毛囊体外培养影响的研究
2022-06-06包跃先赵飞飞宫文典卢泽宇刘俊阳特日格乐赵艳红
包跃先,赵飞飞,2,宫文典,2,卢泽宇,2,穆 卿,2,刘俊阳,2,特日格乐,2,赵艳红,2
(1.内蒙古农业大学动物科学学院,呼和浩特 010018;2.内蒙古自治区动物遗传育种与繁殖重点实验室,呼和浩特 010018)
内蒙古绒山羊是历经长期的自然选择和人工选育而形成的地方良种,由于其绒毛细度好、产绒量高、纺织性能好等优良特性而享有“软黄金”的美称。如何提高羊绒的产量和质量一直是绒山羊育种工作的重点。贴着表皮生长的绒毛平均直径约15 μm,由次级毛囊生成[1],是优质的纺织原料,价值较高。绒山羊具有异质的双重毛被,其毛被由有髓质的粗毛和无髓质的绒毛两类纤维组成。绒毛的品质很大程度上决定于绒山羊的皮肤及毛囊,毛囊位于真皮和皮下组织中,是毛发获取养分的通道,且具有自我更新能力。因此,研究绒山羊毛囊的生长发育对羊绒的生产具有重要意义。
近年来,关于催乳素(PRL)的研究越来越多,作为一种具有调控作用的激素,催乳素不仅在机体某些器官的生长发育和泌乳等方面起作用,还调控着哺乳动物毛囊的生长发育,催乳素的分泌受到光照的影响,长光照会使催乳素的分泌增加,且褪黑激素的分泌也会影响到催乳素的分泌[2]。谢景艳[3]通过检测绒山羊皮肤毛囊中催乳素受体的表达情况来探索绒毛生长与催乳素之间的关系,发现催乳素对体外培养的毛囊生长具有促进作用。Ibraheem等[4]研究表明,催乳素对体外培养的次级毛囊的生长具有促进作用。因此,本研究以内蒙古白绒山羊毛囊为研究对象,在体外培养时添加催乳素,观察毛囊生长状况,分析催乳素对绒山羊毛囊生长和形态的影响,旨在为研究催乳素调控绒山羊毛囊生长的机理提供理论参考。
1 材料与方法
1.1 材料
1.1.1 试验动物及样品采集 本试验所采样品来源于内蒙古呼和浩特市土左旗善岱镇召上村金莱牧业有限公司。随机选取10只健康的2周岁成年阿尔巴斯绒山羊母羊,将其绑定,把靠近肩胛部附近的羊毛剪去,用碘酒和酒精棉球消毒,快速切取1 cm2大小的皮肤放入含双抗的Hanks液的采样管中,于2 h内带回实验室。
1.1.2 主要试剂及仪器 Hanks液、PBS均购自北京索莱宝科技有限公司;William’E培养液购自Gibco公司;催乳素购自武汉华美生物工程有限公司;胰岛素-转铁蛋白-亚硒酸钠混合液(100×ITS)、L-谷氨酰胺、氢化可的松和青-链霉素混合液均购自Sigma公司。解剖显微镜(SMZ800)和倒置显微镜(TE2000-S)均购自Nikon公司;超净工作台购自苏州安泰空气技术有限公司;CO2培养箱(TH3111)购自赛默飞世尔科技有限公司。
基础培养基的配制:在50 mL离心管中加入0.5 mL青-链霉素混合液,0.4 μg/mL氢化可的松,0.5 mL胰岛素-转铁蛋白-亚硒酸钠混合液(100×ITS),0.5 mLL-谷氨酰胺,用William’E培养基定容至50 mL。
1.2 方法
1.2.1 毛囊的分离 将样本裸露的毛干剪掉,用生理盐水冲洗表面污物后再用含有青-链霉素混合液的Hanks液冲洗。充分清理皮肤表面的杂物后,用酒精棉球包裹揉搓2次,再用含有青-链霉素混合液的Hanks液冲洗。使用眼科剪剪成约1 mm3左右的组织块,分别挑出无损伤、毛乳头明显的单个初级和次级毛囊。用注射器针头将毛囊周围组织去除后,置于培养液中。
1.2.2 最佳催乳素浓度筛选 用基础培养基将催乳素稀释为5、10、50、100 ng/mL 4个浓度,对照组(0 ng/mL)不添加催乳素,在37 ℃、5% CO2的恒温培养箱中培养初级毛囊。培养5 d,每天观察形态并拍照、测量其长度,计算毛囊的平均日生长长度、最终生长长度及存活率,筛选最佳催乳素处理浓度。
1.2.3 催乳素对体外培养毛囊的影响 将初级毛囊与次级毛囊分别分为对照组(K)和最适浓度催乳素组(PRL),即初级毛囊对照组(PF-K)、初级毛囊试验组(PF-PRL)、次级毛囊对照组(SF-K)、次级毛囊试验组(SF-PRL)。在24孔培养板中,试验组每孔加入0.6 mL最佳浓度催乳素的培养液,对照组用基础培养液。在显微镜下选取形态良好的初级毛囊与次级毛囊置于培养板中,每孔1根,每组24根。37 ℃、5% CO2的恒温培养箱中培养5 d,每天在倒置显微镜下观察其形态并拍照。培养前记录毛囊长度(即第0天的毛囊长度),之后每天测量并记录毛囊总长度。各组试验重复5次。
1.3 数据统计分析
用RStudio R4.1.1软件进行单因素方差分析,并采用LSD法进行多重比较。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 催乳素对毛囊体外培养的最适浓度
由表1可知,10 ng/mL催乳素组毛囊在1~5 d的平均生长长度均极显著高于其他组(P<0.01),且10 ng/mL催乳素组5 d的累计生长长度最大、存活率最高。因此,选择10 ng/mL催乳素用于后续试验毛囊的体外培养。
2.2 毛囊体外培养的形态观察
由图1可知,初级毛囊与次级毛囊5 d的平均日生长长度和生长趋势基本一致。PF-K组毛囊在生长过程中内外根鞘与毛干同时伸长,且根鞘的直径微微变细,整体形态未发生太大变化,弯曲程度较小。内部结构清晰且毛乳头部位逐渐萎缩同时颜色变浅。PF-PRL组毛囊在伸长的同时根鞘直径无明显变化,各部位的结构清晰可辨,随着长度的增加毛囊的两端变的弯曲。PF-PRL组生长长度明显高于PF-K组,弯曲更严重。SF-K和SF-PRL组的毛囊随着培养时间的延长逐渐伸长,新生长的毛干变细,毛囊的整个部位发生弯曲,内部结构清晰且毛球部位逐渐萎缩,SF-PRL组毛囊的毛球上部弯曲异常。因此,培养基中添加10 ng/mL催乳素可以促进初级毛囊与次级毛囊生长。
2.3 催乳素对体外培养初/次级毛囊生长长度的影响
由表2可知,PF-PRL、SF-PRL组毛囊在2~5 d的总长度分别极显著高于PF-K、SF-K组(P<0.01)。PF-K组除第1天与第0天差异不显著外,1~5 d毛囊的总长度依次显著增加(P<0.05);PF-PRL组0~5 d毛囊的总长度依次显著增加(P<0.05)。SF-K组毛囊第5天的总长度显著高于0~4 d(P<0.05),其余相邻2 d间差异不显著(P>0.05);SF-PRL组第4、5天毛囊的总长度显著高于0~3 d(P<0.05),第3天毛囊的总长度显著高于0~2 d(P<0.05)。由图2可知,PF-PRL、SF-PRL组毛囊在2~5 d的平均日生长长度分别极显著高于PF-K、SF-K组(P<0.01)。
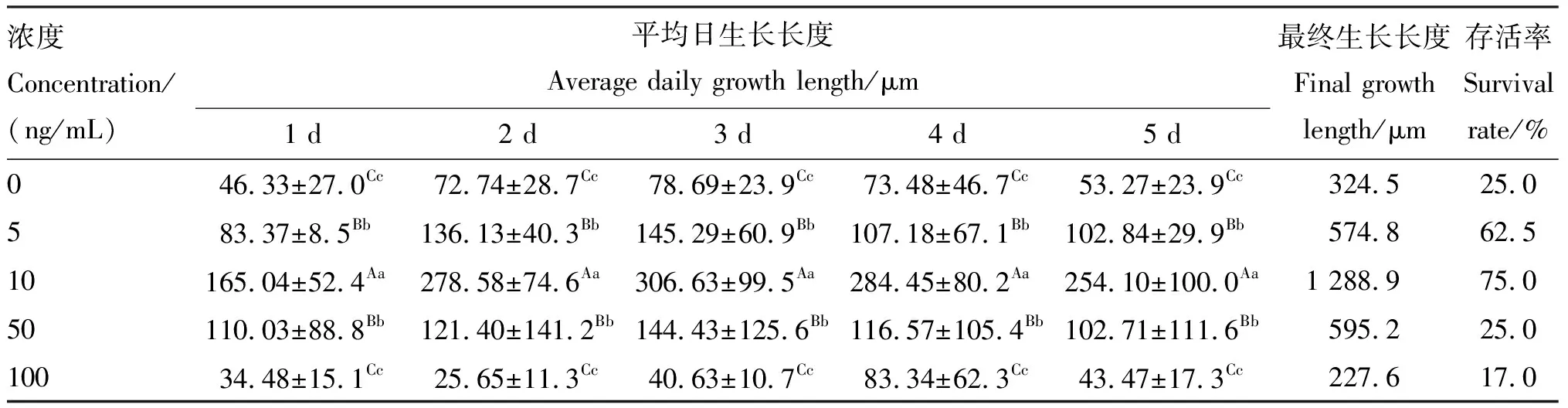
表1 不同浓度催乳素对毛囊体外生长的影响

图1 各组毛囊的形态观察(40×)Fig.1 Morphological observation of hair follicles in each group (40×)
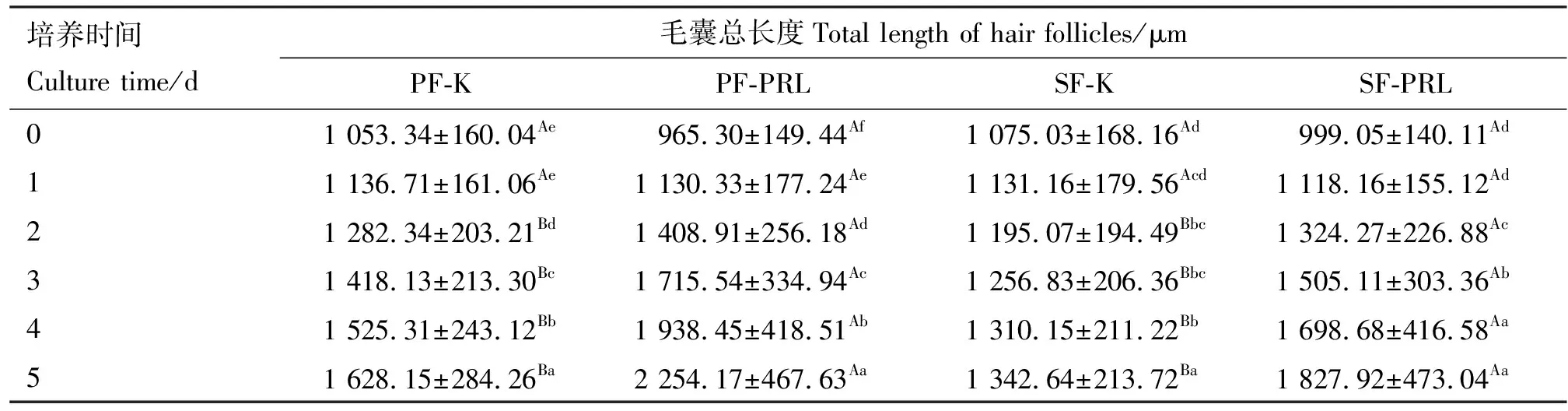
表2 各组毛囊总长度

①A,初级毛囊;B,次级毛囊。②**,差异极显著(P<0.01);无*,差异不显著(P>0.05)①A,Primary hair follicles;B,Secondary hair follicles.②**,Extremely significant difference(P<0.01);No *,No significant difference(P>0.05)图2 各组毛囊平均日生长长度Fig.2 Average daily growth length of hair follicles in each group
3 讨 论
想要获得形态结构完好的毛囊首先要了解毛囊的生理与生长特性[5-6],如在毛囊的生长期就比较容易获得形态结构完整和活性较强的毛囊,有利于后续试验的进行。采集样品时要做好充分的准备,在剪毛后对皮肤进行多次清洁,避免样品污染。本试验在采样管中保存样品时添加适量的青-链霉素可以降低污染,同时提高后期毛囊体外培养的成活率。一般采用机械法与切割法结合分离初级毛囊[7],分离毛囊的效率会随着分离手法的娴熟而提高,由于次级毛囊成簇生长且形态比较微小,用分离初级毛囊的方法分离次级毛囊极易损伤毛囊结构,所以本试验改进了毛囊分离的方式,将皮肤组织剪成薄片后置于体视显微镜下,将皮肤的表皮部分切去,在切口处可观察到次级毛囊的毛干,将皮肤用镊子拉伸后皮肤组织会变得较为疏松,用精细镊夹取次级毛囊毛干部分,这样就会很容易抽离出一簇次级毛囊,接着在显微镜下将成簇的次级毛囊分成独立的单个毛囊。此种方法减少了器械对毛球部位的损伤,提高了毛囊的存活率。
目前有关催乳素与绒山羊毛囊生长[8]的研究有很多,如杨敏等[9]研究发现,催乳素含量随次级毛囊的生长呈现出显著的周期变化,说明催乳素与毛囊的生长发育有很大关系。徐文军[10]通过检测不同季节绒山羊血清中催乳素的含量发现,绒山羊血清中的催乳素浓度随着季节的变化而变化,8月份达到最大值,在羊绒生长期的8~10月份,催乳素浓度与羊绒的生长速度呈负相关,说明羊绒的生长和脱落受催乳素的影响。但关于培养基中添加催乳素对其生长状况影响的研究很少,催乳素是一种蛋白类激素,参与代谢调节并且对毛囊的发育和生长有一定调控作用。刘志远[11]研究表明,在2~10 ng/mL催乳素浓度范围内,随着添加浓度的升高,会显著增加毛囊的生长趋势。本试验用催乳素对绒山羊的初级毛囊与次级毛囊分别进行体外培养,在显微镜下观察毛囊的生长长度与形态变化,结果表明,10 ng/mL是体外培养毛囊的最适催乳素浓度。
Ibraheem等[4]研究表明,培养基中添加催乳素对次级毛囊的生长具有促进作用,由于次级毛囊的生长与初级毛囊的生长有很大关系,所以推测催乳素对初级毛囊也有相同作用。本研究结果显示,催乳素对初级毛囊和次级毛囊生长均有极显著促进作用。徐文军等[12]研究发现,绒毛的生长受到绒山羊体内催乳素浓度的影响,当浓度达到最大时绒毛开始生长,如果抑制催乳素的分泌可能会使羊绒的生长推迟。说明催乳素对绒毛的生长具有促进作用,与本研究结果一致。孙庆林等[13]采用原位杂交法检测绒山羊皮肤毛囊中催乳素受体mRNA随季节变化的规律发现,催乳素受体mRNA分布量与毛囊活性呈负相关,即催乳素抑制毛囊生长,与本研究结果有差异,说明催乳素在体内对毛囊的影响与体外不同,在体内可能是与其他激素协同作用来调控绒毛的生长,具体机制还有待研究。
绒毛的生长是多种激素共同作用的结果,动物体内催乳素的浓度随着季节的变化而变化,且与体内褪黑激素的浓度存在一定的颉颃关系[14],当褪黑激素浓度升高时催乳素浓度降低,多个研究证明体内褪黑激素浓度升高会促进体外绒毛的生长[15],但本研究发现,在无其他激素作用条件下的毛囊体外培养试验中,适宜浓度的催乳素直接作用于毛囊也会促进其生长,但是其在体内具体的作用机制还有待深入研究。
4 结 论
10 ng/mL催乳素显著促进初级毛囊的生长,毛囊存活率最高,其对内蒙古绒山羊初级毛囊和次级毛囊体外培养的作用一致,在培养的1~5 d均有显著促生长作用。
