番茄黄化曲叶病毒和番茄褪绿病毒复合侵染的分子鉴定
2022-06-06杨淑珂孙红炜李凡徐晓辉路兴波
杨淑珂 孙红炜 李凡 徐晓辉 路兴波



摘要 以番茄黄化曲叶病毒(tomato yellow leaf curl virus, TYLCV)及番茄褪綠病毒(tomato chlorosis virus,ToCV)为对象,用分子检测方法对山东、安徽2省病原进行鉴定。选取山东、安徽2省7个地区,对2种病毒病进行田间调查,采集疑似样品扩增序列,对其进行同源性比对和遗传进化树等分析,进一步了解山东、安徽2个省蔬菜产区2种病毒病的发生情况。结果表明,YLCV在山东省大部及安徽省局部地区已经发生扩散且中国所有的分离物仍属于IL株系。明确了ToCV在安徽地区发生,且统计发现2个省6个地区ToCV、TYLCV存在单独侵染及复合侵染。ToCV分离物均可分为2个大组,其中该研究所得到的分离物均与中国其他地区的分离物聚类到一组。
关键词 番茄曲叶病毒;番茄褪绿病毒;分子鉴定;复合侵染
中图分类号 S436.412.1 文献标识码 A
文章编号 0517-6611(2022)10-0123-06
doi:10.3969/j.issn.0517-6611.2022.10.028
Molecular Identification of Tomato Yellow Leaf Curl Virus and Tomato Chlorosis Virus
YANG Shu-ke, SUN Hong-wei,LI Fan et al (Shangdong Academy of Agricultural Sciences, Jinan, Shandong 250100)
Abstract Tomato yellow leaf curl virus (TYLCV) and tomato chlorosis virus (ToCV) were identified by molecular detection in Shandong and Anhui Provinces. Seven regions of Shandong and Anhui provinces were selected for field investigation of two kinds of virus diseases, and the amplified sequences of suspected samples were collected for homology comparison and genetic evolutionary tree analysis, so as to further understand the occurrence of two kinds of virus diseases in vegetable producing areas of Shandong and Anhui Provinces. The results showed that TYLCV had spread in most of Shandong Province and some parts of Anhui Province, and all isolates in China still belonged to IL strains. It was clear that ToCV occured in Anhui, and statistics showed that there were separate infection and compound infection of ToCV and TYLCV in 6 areas of 2 Provinces. ToCV isolates could be divided into two groups, and the isolates obtained in this study were clustered into group I with those from other regions in China.
Key words TYLCV;ToCV;Molecular identification;Co-infection
基金项目
山东省2013年度农业重大应用技术创新课题“番茄黄化曲叶病毒病防控关键技术研究与应用”。
作者简介 杨淑珂(1986—),女,山东济宁人,助理研究员,硕士,从事植物病理及转基因环境安全评价研究。通信作者,研究员,博士,从事植病及转基因环境安全评价研究。
收稿日期 2021-08-03
番茄黄化曲叶病(tomato yellow leaf curldisease,TYLCD)是目前番茄生产中较为常见且危害较广的病毒病害之一,首次见于以色列[1]。染病后番茄植株发生矮化,生长迟缓或停滞,顶部叶片褪绿发黄、增厚、变小、皱缩,可发生于番茄幼苗、开花、结果等各个生长期,一旦感病,迅速扩散,不但影响番茄品质而且导致番茄减产,若早期感染甚至绝产[2]。该病毒最早发现于以色列,如今已在全球40多个国家和地区暴发,自20世纪90年代以来,由东向西、自南向北迅速在全国范围内蔓延,先后在广东、广西、浙江、上海、江苏、四川、安徽、山东、河北、天津、北京、吉林等20多个产区发生[3-6]。尤其对我国南方露地和北方秋延迟保护地番茄生产造成极重大的损失。番茄褪绿病毒隶属长线形病毒科(Closteroviridae)毛形病毒属(Crinivirus),最早发现于佛罗里达州北部温室的番茄植株上[7],ToCV的基因组为二分体争议单链RNA(+sRNA),5’端可能有一个甲基化帽子结构,而3’端没有Ploy(A)结构,也不形成tRNA样结构,可能会形成发卡结构。病毒粒子长800~850 nm,为弯曲长线形,呈螺旋对称结构[8],基因组RNA1和RNA2分别包装在2种不同的病毒粒子中,对成功侵染寄主都是必须的[9]。番茄褪绿病毒RNA1长8 594 bp,包含4个开放阅读框(ORFs);RNA2长8 242 bp,包含9个ORFs,其特征是含有与HSP70热激蛋白同源的编码区及重复的外壳蛋白基因[10]。ToCV引发的症状与缺素症极为相似,褪绿黄化症状首先自叶片中下部出现并逐渐向上发展,植株中部叶片叶脉间呈轻微褪绿黄化,而底部叶片则会出现明显的叶片褪绿黄化,叶脉深绿,老叶较新叶褪绿黄化症状更为明显,感病叶片变脆且易折[11]。
笔者以番茄黄化曲叶病毒及番茄褪绿病毒为对象,用分子检测等鉴定方法对山东及安徽2个省共7个地区的设施番茄疑似病株进行病原鉴定,以期进一步了解山东及安徽2个省2种病毒病复合侵染的发生和蔓延情况,为针对2种病毒病的防控提供预警。
1 材料与方法
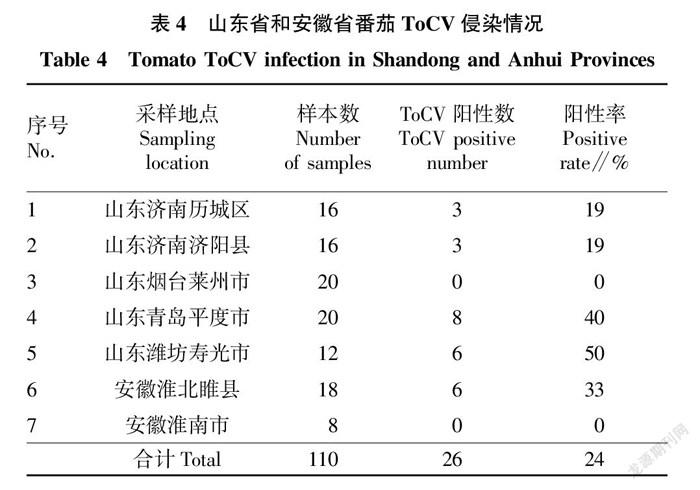
1.1 试验材料 采集设施番茄疑似病毒样品共110份,其中采集自山东省番茄样品84份(山东济南历城区16份,山东济南济阳县16份,山东烟台莱州市20份,山东青岛平度市20份,山东潍坊寿光市12份),采集自安徽番茄样品26份(安徽淮北睢县18份,安徽淮南8份)。
1.2 番茄黄化曲叶病毒DNA的检测 采用植物基因组DNA提取试剂盒(天根公司,DP305)提取样品植株总DNA。使用简并引物(Degenerate Primers)PA/PB[12]和TYLCD特异性引物(表1)进行PCR扩增。PCR体系:Taq DNA聚合酶(5 U/μL) 0.3 μL,上下游引物各1.0 μL,模板DNA 1.0 μL,dNTPs(2.5 mmol/L) 2.0 μL,10× PCR Buffer 2.5 μL,加ddH2O至25 μL。PCR程序:94 ℃預变性 4 min;94 ℃变性 40 s,54 ℃/58.7 ℃退火1.0 min,72 ℃延伸3 min,30次循环;72 ℃延伸10 min,4 ℃保存。PCR产物纯化回收送生工生物工程(上海)股份有限公司测序。
1.3 番茄褪绿病毒的检测与鉴定
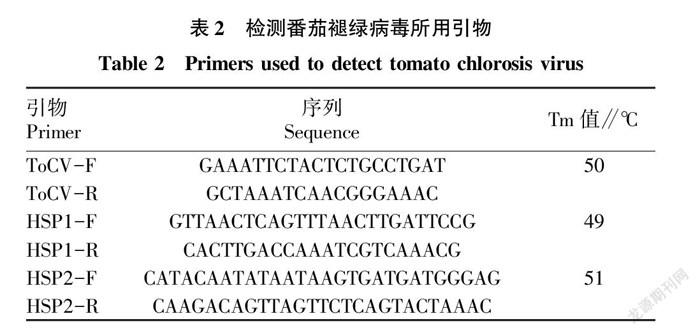
样品植株总RNA采用总RNA提取试剂盒(天根公司,DP419)进行提取。以提取的总RNA为模板,以3’端引物(下游引物)进行反转录,反应体系:模板RNA/引物的变性溶液 6.00 μL,5×M-MLVBuffer 2.00 μL,dNTP Mixture 0.50 μL,RNase Inhibitor(40 U/μL) 0.25 μL,RTaseM-MLV 0.25 μL,加RNase free dH2O至10 μL。反转录完成后-80 ℃保存。参照特异引物ToCV-F/ R[13]及Hirota等[14]的ToCV HSP70的2对特异性引物HSP1-F/HSP1-R和HSP2-F/HSP2-R(表2)进行PCR扩增。PCR反应体系:cDNA 1.0 μL,上下游引物各1.0 μL,LA Taq酶(5 U/μL) 0.2 μL,10×LA PCR 反应缓冲液(Mg2+) 2.5 μL,dNTPs (2.5 mmol/L)1.5 μL,加ddH2O至终体积为25 μL,PCR程序:94 ℃预变性3 min;94 ℃变性40 s,50 ℃/49 ℃/51 ℃退火1.0 min,72 ℃延伸2 min,30次循环;72 ℃延伸10 min,4 ℃保存。
2 结果与分析
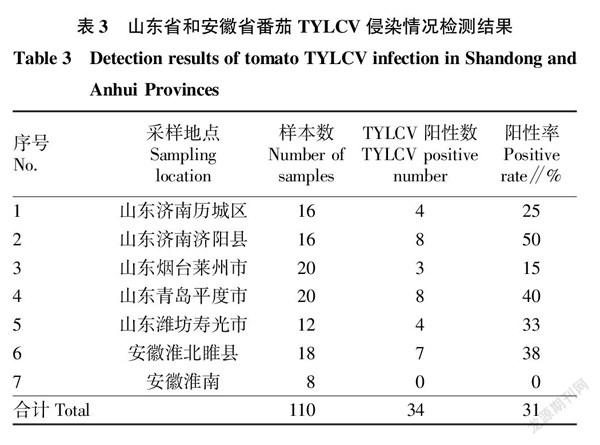
2.1 TYLCV在山东省和安徽省个别地区的发生情况 在山东省、安徽省共7个地区,包括济南历城区、济南济阳县、潍坊寿光市、青岛平度市、烟台莱州市、安徽淮北市及淮南市的设施番茄种植区,采集到疑似感染TYLCV的番茄植株样品110份,样品提取总DNA后检测结果见表3。利用PA/PB简并引物及TYLCV特异性引物扩增分别得到大小约535、838 bp的目的条带(图1、2)。
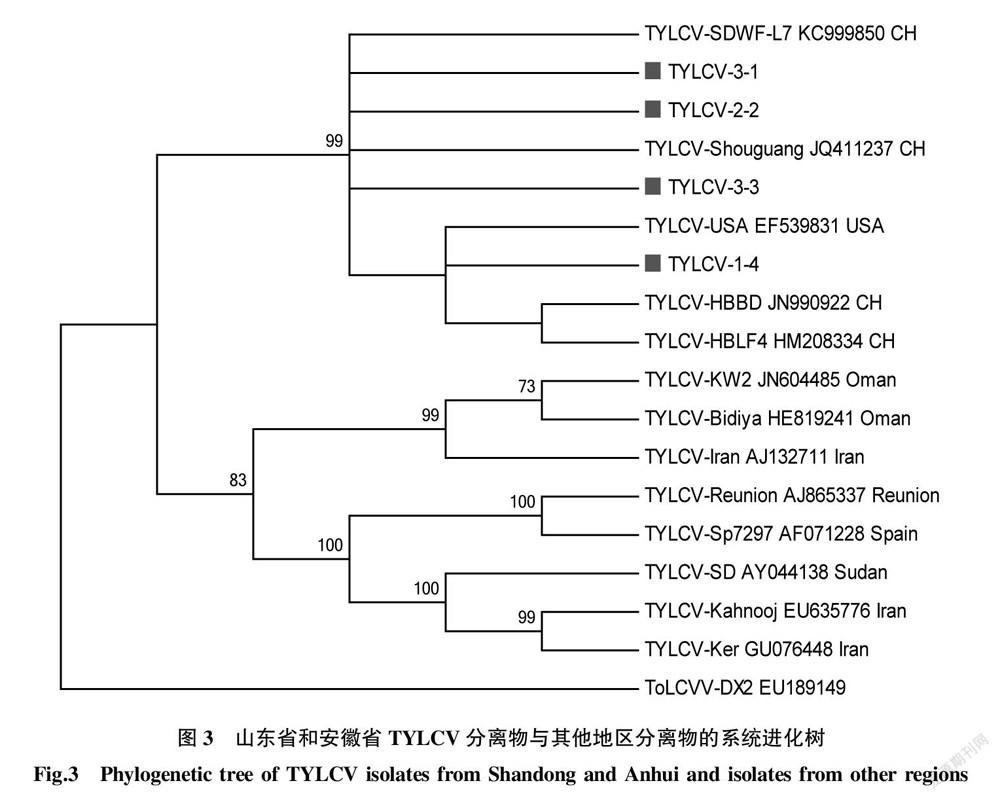
依据TYLCV系统进化树,TYLCV分离物可以分为4组,分别对应IL、IR、Mild、Gez株系[13],其中该研究的4个分离物和中国所有的分离物一起聚类在IL组(图3)。
2.2 番茄褪绿病毒在山东省和安徽省个别地区的发生情况
在山东及安徽2个省发现的疑似感染褪绿病毒的番茄植株出现了植株矮小、上部新叶片变小、叶片边缘褪绿黄化、边缘卷曲皱缩、下部老叶症状不明显、枝条直立丛生、顶部发病形似菜花的症状(图4)。
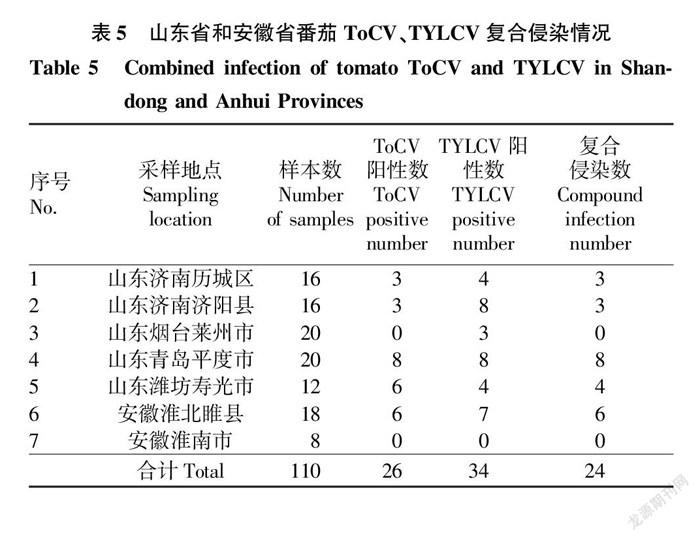
对山东省、安徽省共7个地区的设施番茄种植区调查期间,采集到番茄病株样品110份,提取总RNA后检测,结果见表4。
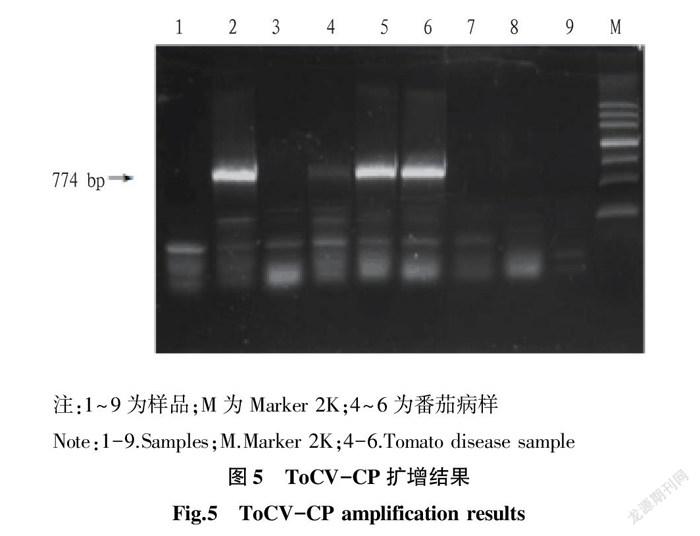
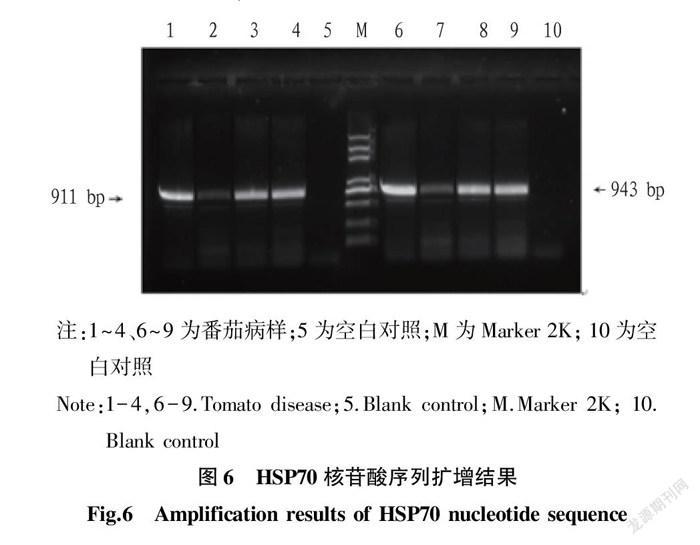
利用ToCV CP的特异性引物扩增后,选取不同地区发现的4条大小为750~800 bp的目的条带(图5),测序后利用BLAST进行序列比对,结果表明扩增产物核苷酸序列与GenBank 中的ToCV分离物的基因序列相似性最高可达99%,表明这些样品确系被ToCV感染,4个ToCV分离物CP全长均为774个核苷酸。4个分离物分别命名为1-4、2-2、3-1、3-3。利用HSP70这2对特异引物扩增后分别得到4组大小约为943、911 bp的目的条带(图6),分别包含HSP70的
上、下游及其侧翼序列,序列测定和拼接后的HSP70全长为1 665 bp,利用BLAST进行序列比对,结果表明扩增产物核苷酸序列与GenBank 中ToCV分离物的HSP70基因序列的相似性最高可达99%,进一步表明这些样品确系被ToCV感染。
选取NCBI上典型ToCV CP序列,利用DNASTAR Megalign软件进行核苷酸一致率比对,结果发现2省4个不同地区番茄样品ToCV CP基因之间序列一致率最高可达99.7%。山东分离物与北京分离物(KC887999)、韩国分离物(KP114528、KP114533、KP114534、KP114537)、日本分离物(AB513443)序列一致率最高可达99.6%;安徽分离物与北京
分离物(KC887999)序列一致率最高可达99.8%。
选取NCBI上典型ToCV HSP70序列,利用DNASTAR Megalign软件进行核苷酸一致率比对,结果发现2省4个不同地区番茄样品的ToCV HSP70基因之间序列一致率最高可达99.8%。山东分离物与韩国分离物(KP114528、KP114533、KP114534、KP114537)、日本分离物(AB513443)序列一致率最高可达99.7%;安徽分离物与韩国分离物(KP114528、KP114533、KP114534、KP114537)、日本分离物(AB513443)序列一致率最高可达99.8%。
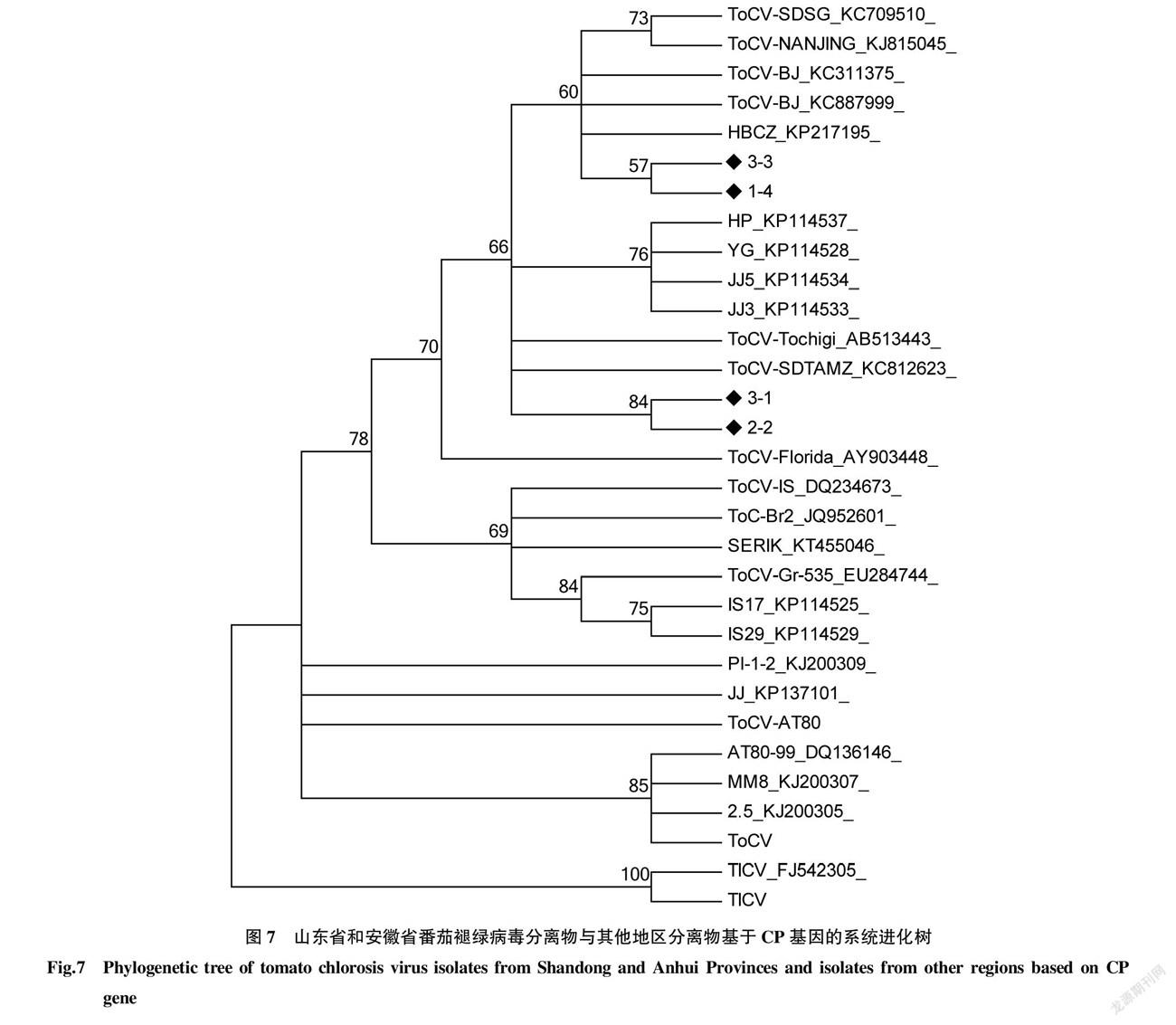
为了更好地分析其系统进化关系及其分类地位,使用MEGA 4软件,对国内外不同地区有代表性ToCV的CP及HSP70核苷酸序列构建系统树,进行分析(图7、8)。
根据ToCV CP基因构建的系统进化树,ToCV分离物可分为2组,Ⅰ 组的组内遗传距离为0.012;Ⅱ 组的组内遗传距离为0.015,两组之间的遗传距离为0.061,组间遗传距离大于组内遗传距离。其中4个分离物与中国其他地区的分离物均聚类到I组,且与东亚地区更为相近。
根据ToCV HSP70基因构建的系统进化树,ToCV分离物可分为2组,Ⅰ 组的组内遗传距离为0.006;Ⅱ 组的组内遗传距离为0.005,2组之间的遗传距离为0.017,组间遗传距离大于组内遗传距离。其中4个分离物与中国其他地区的分离物均聚类到I组。
2.3 番茄褪绿病毒与黄化曲叶病毒的复合侵染
统计TYLCV和ToCV在2省7个地区的检测结果,山东烟台莱州市只检测出TYLCV;安徽淮南市未检出TYLCV和ToCV;其余5個地区均检出TYLCV和ToCV,并存在2种病毒的单独侵染和复合侵染(表5)。
3 讨论
通过对山东省、安徽省TYLCV发生情况的调查及检测可知,目前TYLCV在山东省大部及安徽省局部地区已经发生扩散且中国所有的分离物仍属于IL株系,可能是由于地区间隔较近,存在频繁的种苗调运和烟粉虱迁徙因素。周莹等[15]研究认为TYLCV的传播路径有2条,分别为广东和江苏路线,该研究在山东和安徽发现的TYLCV均属于江苏路线。明确了ToCV在安徽地区发生,且统计发现2省6个地区ToCV、TYLCV存在单独侵染及复合侵染。分别基于ToCV CP和ToCV HSP70构建系统进化树,结果发现ToCV分离物可分为2个大组,其中该研究所得到的分离物均与中国其他地区的分离物聚类到I组。
通过计算分离物ToCV的CP与HSP70这2个基因的同义突变(dS)和非同义突变(dN)的比率(dN / dS),结果显示,CP与HSP70基因均处于负向(或净化)选择的压力之下且所承受的压力不同。
ToCV自2013年中国首次报道以来,相继在山东、天津、河北、河南、江苏省均有发现[15-19],安徽发现的ToCV从分子水平上看与中国其他地区亲缘关系较近,而ToCV并不能通过种子传播,这可能是由于种苗调运或烟粉虱的迁移造成的。研究发现ToCV为韧皮部限制病毒,其寄主范围较为狭窄,仅能侵染茄科中的番茄、辣椒、普通烟、黄花烟等[8],传播方式单一,使得病毒基因承受更多的选择压力。
复合侵染是植物病毒病常见的现象,重庆辣椒上即存在CMV和TuMV的复合侵染[20],TYLCV和ToCV的复合侵染在天津、南京均有报道[17]。产生ToCV与TYLCV复合侵染的原因:一是番茄可能在不同生育期分别被2种病毒侵染;二是由于这2种病毒均由烟粉虱进行传播,周莹等[15]发现烟粉虱可以携带2种病毒,在烟粉虱取食时,2种病毒可能同时侵染番茄。病毒的复合侵染通常能引起协生现象,会导致病害出现更加严重的症状,如PVY和PVX在普通烟草上协生可导致烟草坏死[21]。病毒的复合侵染还可以协助病毒克服寄主抗性,如当含有Sw-5的抗番茄斑萎病毒番茄被番茄褪绿病毒和番茄斑萎病毒同时侵染时,番茄褪绿病毒的侵染会导致寄主番茄对番茄斑萎病毒的抗性丧失[22]。ToCV并未发现抗性基因,TYLCV和ToCV复合侵染也可能帮助TY克服抗性基因的限制,这对番茄生产是一个潜在的威胁。ToCV和TYLCV的发生规律相近,防治方法可以相互参照,目前番茄褪绿病毒与番茄黄化曲叶病毒的协同传播机制及其协生作用仍需要进一步研究。
参考文献
[1] PIC B,DEZ M J,NUEZ F.Viral diseases causing the greatest economic losses to the tomato crop.Ⅱ.The Tomato yellow leaf curl virus:A reciew[J].Scientia horticulturae,1996,67(3/4):151-196.
[2] WU J B,DAI F M,ZHOU X P.First report of Tomato yellow leaf curl virus in China[J].Plant disease,2006,90(10):1359.
[3] 季英华,熊如意,程兆榜,等.江苏省番茄黄化曲叶病的病原分子诊断[J].园艺学报,2008,35(12):1815-1818.
[4] GHANIM M,MORIN S,ZEIDAN M,et al.Evidence for transovarial transmission of Tomato yellow leaf curl virus by its vector,the whitefly Bemisia tabaci[J].Virology,1998,240(2):295-303.
[5] 杨欢欢,赵婷婷,刘冠,等.番茄黄化曲叶病抗病基因与抗病育种的最新进展[J].分子植物育种,2016,14(8):2044-2049.
[6] 张爱红,杨菲,李希望,等.河北省番茄病毒病种类鉴定及分布[J].安徽农业科学,2019,47(14):139-141.
[7] WISLER G C,LI R H,LIU H Y,et al.Tomato chlorosis virus:A new whitefly-transmitted,Phloem-limited,bipartite closterovirus of tomato[J].Phytopathology,1998,88(5):402-409.
[8] 周涛,杨普云,赵汝娜,等.警惕番茄褪绿病毒在我国的传播和危害[J].植物保护,2014,40(5):196-199.
[9] WINTERMANTEL W M,WISLER G C.Vector specificity,host range,and genetic diversity of Tomato chlorosis virus[J] Plant disease,2006,90(6):814-819.
[10] 孙国珍.侵染茄科蔬菜的三种病毒以及番茄黄化曲叶病毒伴随卫星的检测与分子鉴定[D].泰安:山东农业大学,2015:8-9.
[11] ZHAO R N,WANG R,WANG N,et al.First report of Tomato chlorosis virus in China[J].Plant disease,2013,97(8):1123.
[12] 谢艳,张仲凯,李正和,等.粉虱传双生病毒的TAS-ELISA及PCR快速检测[J].植物病理学报,2002,32(2):182-186.
[13] 孙国珍,高利利,陆文利,等.河北省设施番茄褪绿病毒分子检测和鉴定研究[J].北方园艺,2015(9):95-98.
[14] CZOSNEK H.Tomato yellow leaf curl virus disease[M].Dordrecht:Springer,2007.
[15] 周莹,罗晨,燕继晔,等.番茄褪绿病毒与番茄黄化曲叶病毒复合侵染茄子的鉴定[C]// 彭友良,缪卫国.中国植物病理学会2015年学术年会论文集.北京:中国农业出版社,2015.
[16] 高利利,孙国珍,王勇,等.天津地区番茄褪绿病毒的分子检测和鉴定[J].华北农学报,2015,30(3):211-215.
[17] 胡京昂,万秀娟,李自娟,等.河南番茄褪绿病毒的分子鉴定[J].中国蔬菜,2015(12):25-28.
[18] ZHAO L M,LI G,GAO Y,et al.Molecular detection and complete genome sequences of Tomato chlorosis virus isolates from infectious outbreaks in China[J].Journal of phytopathology,2014,162(10):627-634.
[19] 吴淑华,李廷芳,赵文浩,等.江苏省番茄黄化曲叶病毒和褪绿病毒复合侵染的分子检测[J].园艺学报,2016,43(1):89-99.
[20] 郭思瑶,童艳,黄娅,等.重庆辣椒病毒病病原初步鉴定和分析[J].园艺学报,2015,42(2):263-270.
[21] 王洁.烟草脉带花叶病毒和马铃薯A病毒HC-Pro調控RNA沉默抑制、协生和致病力的机制[D].泰安:山东农业大学,2012.
[22] GARCA-CANO E,RESENDE R O,FERNNDEZ-MUOZ R,et al.Synergistic interaction between Tomato chlorosis virus and Tomato spotted wilt virus results in breakdown of resistance in tomato[J].Phytopathology,2006,96(11):1263-1269.
