木薯块根不同发育期β-胡萝卜素和蛋白质积累变化及其有色体蛋白质组学研究
2022-06-06周锴安飞飞李开绵陈松笔
周锴 安飞飞 李开绵 陈松笔







摘 要:木薯是世界重要的粮食作物,在我国发展潜力巨大。蛋白质和类胡萝卜素是重要的营养品质特性,但木薯蛋白质含量低,提高木薯块根类胡萝卜素和蛋白质含量,提高其营养成分,已成为木薯选育种的重要目标。本研究以蛋黄木薯(‘SC9’)、紫叶黄心木薯(‘BGM019’)和白心面包木薯(‘SC101’)3个木薯品种为试验材料,开展黄心和白心木薯块根营养品质特性的研究,分析其不同发育期类胡萝卜素和蛋白质含量的变化,同时利用双向电泳和质谱法开展木薯块根有色体亚细胞结构蛋白质组的研究,揭示其蛋白质含量提高与类胡萝卜素积累的关联性。结果表明:3个木薯品种块根b-胡萝卜素含量在块根形成期、膨大期和成熟期差异显著(<0.05),‘BGM019’和‘SC9’蛋白质含量在同一生长发育时期差异不显著(>0.05),但显著高于‘SC101’(<0.05)。随着木薯块根发育成熟,其类胡萝卜素和蛋白质含量均呈上升趋势,且二者表现为正相关。以膨大期为对照,在‘SC9’成熟期塊根有色体中检测到36个差异表达蛋白质,其中26个上调表达,10个下调表达;‘BGM019’中检测到49个差异表达蛋白质,其中28个上调表达,21个下调表达;‘SC101’检测到38个差异蛋白质,其中20个上调表达,18个下调表达。通过对上述差异蛋白质的功能分析,发现它们均参与抗氧化、碳代谢和能量代谢、信号转导等多个代谢过程,说明木薯块根类胡萝卜素积累是由多个代谢途径协同作用的结果。对比分析3个木薯品种块根有色体亚细胞结构的差异蛋白质,发现20个差异表达蛋白质在其中2个品种或3个品种间出现相同的表达趋势。它们主要涉及到碳代谢及能量代谢、抗氧化、细胞骨架蛋白、无机离子运输及代谢、分子伴侣和蛋白质合成等代谢途径,其中与抗氧化相关的蛋白质占20%。构建蛋白质生物调控网络揭示块根有色体蛋白质与β-胡萝卜素积累的关联性,为培育优质高营养的木薯新品种提供新思路。
关键词:木薯块根;蛋白质含量;b-胡萝卜素含量;有色体;蛋白质组学中图分类号:S533 文献标识码:A
Cassava is one of the most important crops in the world and has a great potential as food crop in China. Protein and carotenoids are important nutritional quality characteristics. The content of protein in the cassava tuberous root is low. Hence, to improve the carotenoid and protein content and the value nourishment of the tuberous root is an important goal for cassava breeding. In the present study, three cassava varieties including yellow cassava ‘SC9’, ‘BGM019’ and white cassava ‘SC101’ were selected to analyze the nutritional quality characteristics, and measure the change of b-carotene and protein content at different developmental stages of cassava tuberous roots. Additionally, 2-DE in combination with mass spectrometry were used to analyze the proteome profile of the chromoplast in order to understand the coupling mechanism of increasing the protein content related with carotenoid accumulation. The results showed that there were significant differences (<0.05) between the genotypes in β-carotene content in the periods of formation, enlargement and maturation of cassava tuberous roots. There were no significant differences (>0.05) between ‘SC9’ and ‘BGM019’ regarding the protein content of tuberous roots, however, the protein contents in both yellow cassava genotypes weresignificantly higher than that of ‘SC101’ (<0.05). A positive correlation between the carotenoid and protein content was observed during the development of the tubers in the genotypes. The tuberous-root chromoplasts of enlargement period were used as references, proteome profile of tuberous-root chromoplast in maturation period revealed a total of 36 protein spots in ‘SC9’, in which 26 were classified as up-regulated and 10 down-regulated, while in ‘BGM019’, 49 differential proteins were identified with 28 up-regulated spots and 21 down-regulated, and in ‘SC101’ 38 differential proteins identified, in which 20 were up-regulated and 18 were down-regulated. Most of the identified differential proteins were found to be involved in carbon and energy metabolism, detoxifying and antioxidant and signal transduction mechanism. The results indicate that the accumulation of proteins and carotenoid in cassava storage roots is regulated by different proteins complex. There were 20 common proteins observed between or among the genotypes. The proteins played the same expression pattern and were related to carbon and energy metabolism, detoxifying and antioxidant, structure, inorganic ion transport and metabolism, chaperones and protein biosynthesis. The protein biological regulatory network was constructed and revealed the relationship of protein content and b-carotene accumulation in chromoplast of tuberous root, and would provide a new clue for the selection of new cassava varieties with high quality and high nutrition.
cassava tuberous roots; protein contents; b-carotene content; chromoplasts; proteome
: 10.3969/j.issn.1000-2561.2022.05.001
木薯(Crantz)为大戟科(Euphorbiaceae)木薯属()植物,是世界第六大粮食作物。食用木薯风味独特,然而相比其他谷类作物(蛋白质占干重7%~14%),木薯蛋白质含量低,一般为干重的0.7%~2.5%,造成许多以木薯为主食的非洲国家青少年营养不良、生长发育迟缓、免疫力下降等。目前在我国的粮食作物中,木薯占比很低,食用性能差的木薯粗粮逐步向饲料、淀粉加工和生产能源酒精转移,但随着我国经济的快速发展,人们生活水平不断提高,与其他山珍野菜一样,木薯又以营养美味的粗粮杂粮形式,逐渐回归人们的餐桌。目前中国热带农业科学院已培育出块根富含b-胡萝卜素的蛋黄木薯和紫叶黄心木薯等品种,其块根蛋白质含量显著高于普通白心木薯,因此,木薯作为粮食作物和低糖、高能、美味的特色食品又重新成为人们关注的焦点。
木薯块根中有色体是b-胡萝卜素的载体,但关于b-胡萝卜素在蛋黄和紫叶黄心木薯有色体中的高积累与有色体是否也可能作为蛋白质积累的载体目前仍不很清楚。研究发现块根中造粉体可以向有色体转变,但对造粉体向有色体转变的调控知之甚少。而从基因表达到最终合成蛋白质,很多因素会影响并改变蛋白质的功能,如蛋白质翻译的调控、糖基化、磷酸化等,因此直接研究蛋白质的变化意义无法替代。而采用蛋白质组学技术能够对块根内淀粉体向有色体转变以及类胡萝卜素积累过程中的蛋白质调控网络有广泛而完整的认识,找到关键蛋白质,有利于揭示类胡萝卜积累的机理。
本研究选用蛋黄木薯(‘SC9’,b-胡萝卜素和蛋白质含量高)、紫叶黄心木薯(‘BGM019’,b-胡萝卜素含量中等)和白心面包木薯(‘SC101’,b-胡萝卜素含量低)块根及有色体为研究对象,研究木薯块根不同生长发育时期b-胡萝卜素和蛋白质含量的变化,筛选出与b-胡萝卜素积累和蛋白质含量相關的差异表达蛋白质,为推测出关键基因和蛋白质,培育优质高营养木薯新品种提供新思路。
材料与方法
材料
供试材料‘BGM019’、‘SC101’和‘SC9’由中国热带农业科学院热带作物品种资源研究所儋州国家木薯种质资源圃提供。选择生长健壮、无病虫感染的木薯主茎为种茎,在直径40 cm,高45 cm的盆内盆栽种植。盆插木薯杆长15 cm,盆栽土为椰糠、菜园土(2∶1)的混合基质。常规管理,并于植后1个月进行间苗及补苗,分别于木薯块根形成期(植后3个月)、膨大期(植后6个月)、成熟期(植后9个月)取样进行实验。3个木薯品种块根成熟期横切面如图1所示。
方法
1.2.1 块根可溶性蛋白质含量测定 参考CARVALHO等的丙酮沉淀法经改良后应用于木薯块根蛋白质的提取,根据蛋白沉淀物含量加入适量的蛋白质溶解液[9.5 mol/L Urea,2 mol/L Thiourea,4%(/)CHAPS,1% DDT,2.5 mmol/L EDTA,2.5 mmol/L EGTA],常温下溶解45 min后转移至0.5 mL离心管内,常温下以13 000 r/min离心2 min。取上清液,再使用Sigma公司生产的Bradford试剂盒对蛋白质含量进行测定。
1.2.2 块根β-胡萝卜素含量测定 参考杨龙等优化后的方法,以丙酮/石油醚为提取液,甲醇/叔丁基甲醚(70/30, /)为流动相的高效液相色谱法测定不同生长发育时期木薯块根中β-胡萝卜素含量。
1.2.3 块根有色体蛋白质提取、分离、差异蛋白质分析及质谱鉴定等 参考邓昌哲等改良后的Percoll密度梯度离心法提取块根有色体。参考CHEN等的苯酚抽提法提取有色体蛋白质,溶解后离心取上清液后用Bradford试剂盒进行定量,之后再参考CHEN等的蛋白质双向电泳技术进行分离。使用Delta 2D软件分析获得的蛋白质双向电泳图谱,比较分析不同生长发育时期图谱的蛋白质点,从中选出重复性较好的差异表达蛋白质点,进行下一步的蛋白质鉴定。参考AN等的蛋白质谱鉴定方法,将样品点到Anchorchip标靶上,并置于质谱仪(Bruker Daltonics)中扫描,进行肽指纹图谱及二级质谱测定,获取差异蛋白质点的MALDI-TOF-TOF-MS/MS图谱。使用在线程序Matrix Science(http://www.matrixscience.com)在NCBI数据库(分类学选择绿色植物Vuiridi plantae)中进行检索,以半胱氨酸碘乙酰胺化为固定修饰,甲硫氨酸氧化为可变修饰,每次匹配允许最大的未被酶切位点数为1,二级质谱肽段质量误差为1.5 Da,检出与二级质谱图最佳匹配的多肽段。
数据处理
采用Excel 2010软件和DPS 7.0统计软件对数据进行分析处理。
结果与分析
木薯块根不同生育期可溶性蛋白质含量与-胡萝卜素含量变化分析
从表1可看出,‘SC9’、‘BGM019’和‘SC101’在块根形成期b-胡萝卜素含量差异达显著水平(<0.05),其中‘SC9’的b-胡萝卜素含量最高,为1.727 mg/g,高于‘BGM019’的1.063 mg/g;‘SC101’的b-胡萝卜素含量最低,为0.653 mg/g。而‘SC9’(1.270 mg/g)和‘BGM019’(1.150 mg/g)块根形成期蛋白质含量没有显著性差异,但明显高于‘SC101’(1.093 mg/g)(<0.05)。在木薯块根膨大期,‘SC9’、‘BGM019’和‘SC101’b-胡萝卜素和蛋白质含量与形成期相比,均有明显提高。‘SC9’b-胡萝卜素和蛋白质含量均达最高,分别为2.470 mg/g和1.420 mg/g,‘BGM019’次之,分别为1.210 mg/g和1.280 mg/g,‘SC101’最低,分别为0.807 mg/g和1.143 mg/g。在木薯块根成熟期,‘SC9’和‘BGM019’的b-胡萝卜素(‘SC9’:2.737 mg/g;‘BGM019’:1.267 mg/g)和蛋白质含量(‘SC9’:1.537 mg/g;‘BGM019’:1.383 mg/g)均比膨大期高,相反‘SC101’块根b-胡萝卜素(‘SC101’:0.653 mg/g)和蛋白质含量(SC101:0.883 mg/g)比膨大期低。
从表1可知,随着‘SC9’块根发育从形成期到膨大期到成熟期,β-胡萝卜素与蛋白质含量也逐渐升高,成熟期达到最高。在不同的发育期,随着β-胡萝卜素含量的积累,蛋白质含量也呈上
升趋势。‘BGM019’的β-胡萝卜素和蛋白质含量均是随着块根的不断成熟而积累增多;但‘SC101’块根中β-胡萝卜素和蛋白质含量却是在块根膨大期时达到最大值,到成熟期反而下降。根据这一结果对不同木薯品种在块根发育的不同阶段进行收获以获得最大的食用营养品质。
木薯块根不同生育期有色体蛋白质组学分析
2.2.1 ‘SC9’块根不同生育期有色体蛋白质组学分析 ‘SC9’块根成熟期与膨大期有色体蛋白质表达图谱如图2所示。‘SC9’块根成熟期有色体与膨大期有色体蛋白质组相比,有36个差异表达的蛋白质点,其中上调表达26个,下调表达10个。经MALDI- TOF-TOF-MS/MS质谱法结合在线程序MASCOT与NCBI数据库搜索分析,成功鉴定到其中23个差异蛋白质,包括上调表达蛋白质15个,下调表达蛋白质8个,其详细信息见附表1。这些差异蛋白质涉及能量代谢(3个)、分子伴侣(5个)、抗氧化(5个)、细胞骨架(3个)、核酸代谢(1个)、防御(1个)、无机离子运输及代谢(1个)共7个蛋白质功能群,此外,还包括4个功能未知的蛋白质。参与碳代谢与能量代谢的蛋白有ATP结合蛋白及磷酸丙糖异构酶;抗坏血酸类过氧化酶、超氧化物歧化酶及硫氧還蛋白与抗氧化相关;分子伴侣主要为各种热激蛋白;酰谷胱甘肽裂解酶参与细胞防御;与结构相关的主要为肌动蛋白及等离子体膜多肽家族蛋白;而与无机离子运输及代谢相关蛋白主要为钙调蛋白。
2.2.2 ‘BGM019’块根不同生育期有色体蛋白质组学分析 ‘BGM019’成熟期与膨大期块根有色体蛋白质的表达图谱如图3所示。‘BGM019’块根成熟期有色体与膨大期有色体蛋白质组相比,共得到49个差异表达量在2.0倍以上的蛋白质点,其中28个上调表达,21个下调表达。经二级质谱鉴定技术结合数据库搜索分析,成功鉴定到其中37个差异蛋白质,其中包括上调点20个,下调点17个,其详细信息见附表2。这些差异蛋白质涉及能量代谢(7个)、分子伴侣(7个)、抗氧化(7个)、结构(5个)、核酸代谢(2个)、蛋白合成(1个)、光合作用相关(1个)、信号转导(1个)、无机离子运输及代谢(1个)共9个蛋白质功能群,此外,还包括5个功能未知的蛋白质。参与碳代谢和能量代谢的7个蛋白质中,分别为异黄酮还原酶、磷酸丙糖异构酶、ADP葡糖焦磷酸化酶、ATP合酶β亚基、芥子醇脱氢酶、尿卟啉原脱羧酶、多萜基磷酸甘露糖合成酶;7个分子伴侣主要为各种热激蛋白;抗坏血酸类过氧化酶为主要的抗氧化蛋白质;与蛋白合成相关的是一个延伸因子;与核酸代谢相关的蛋白质为富含甘氨酸的RNA结合蛋白和二磷酸核苷激酶B;参与信号转导的为表达上调的生长素应答蛋白X10A;钙调蛋白参与无机离子运输及代谢过程,上调表达。
2.2.3 ‘SC101’块根不同生育期有色体蛋白质组学分析 以膨大期块根有色体蛋白质图谱为对照,对膨大期及成熟期块根有色体的双向电泳图谱进行分析,如图4A~C所示。共发现38个重复性较好且差异表达量达2.0倍以上的蛋白质点,其中上调蛋白质点为20个,其余18个为下调蛋白。经过MALDI-TOF-TOF-MS/MS鉴定技术成功鉴定出其中的31个蛋白质,包括15个上调表达蛋白质和16个下调表达蛋白质。
这些差异蛋白质涉及能量代谢(8个)、分子伴侣(5个)、抗氧化(3个)、结构(3个)、蛋白合成(1个)、氨基酸代谢(1个)、光合作用相关(1个)、信号转导(1个)、无机离子运输及代谢(1个)共9个蛋白质功能群,此外,还包括7个功能未知的蛋白质(附表3)。8个参与碳代谢和能量代谢的蛋白质中,包括表达上调的ATP结合蛋白,下调表达的磷酸甘油酸酯酶、葡萄糖基转移酶、丙酮酸脱氢酶E1β亚基等;除硫氧还蛋白H表达下调外,抗坏血酸过氧化酶及异黄酮还原酶等与抗氧化相关的蛋白质上调表达;天冬氨酸蛋白酶前体参与氨基酸代谢;与生长素相关的SAUR家族蛋白上调表达;同样上调表达的还有参与无机离子运输与代谢的钙调蛋白。
个木薯品种不同生育期块根有色体差异表达蛋白质分析
木薯生长发育进入成熟期后,‘SC9’块根有色体检测出36个差异表达蛋白质,‘BGM019’块根有色体中检测到49个蛋白质出现了差异表达,而‘SC101’块根有色体则检测到38个差异表达蛋白质。利用质谱法结合数据库搜索成功鉴定出23个在‘SC9’块根有色体内差异表达的蛋白质点、37个在‘BGM019’块根有色体内差异表达的蛋白质点,以及31个在‘SC101’块根有色体内差异表达的蛋白质点。对比分析3个品种木薯块根有色体差异蛋白质(图5),发现5个差异表达蛋白质在3个品种内表达趋势相同,其中2个蛋白质均上调表达,2个蛋白质均下调表达。但有1个蛋白质表达特殊,仅在‘SC9’块根有色体中下调表达,而在另外2个品种内上调表达。此外,‘SC9’与‘BGM019’块根有色体共同出现了4个差异表达蛋白质,除了1个蛋白质在‘SC9’上调表达,而在‘BGM019’则下调表达外,其他3个均表现为相同表达特性。而‘SC9’与‘SC101’块根有色体蛋白质有2个共同的蛋白质出现差异表达,且均为上调表达。‘BGM019’与‘SC101’块根有色体中则发现了9个共同表达的蛋白质,其中有1个功能未知的蛋白质在‘BGM019’内下调表达而在‘SC101’中则上调表达,另外8个共同差异表达的蛋白质中,6个均为下调表達,2个均为上调表达。
对3种品种块根有色体间共有差异表达的蛋白质点进行功能分析,发现它们主要涉及碳代谢与能量代谢、分子伴侣、抗氧化、细胞骨架蛋白、蛋白质合成、无机离子运输与代谢和光合作用等。其中抗氧化、分子伴侣和细胞骨架蛋白各占20%,碳代谢与能量代谢占10%,而蛋白质合成、无机离子运输与代谢以及光合作用各占5%,功能未知的占15%(附表4)。
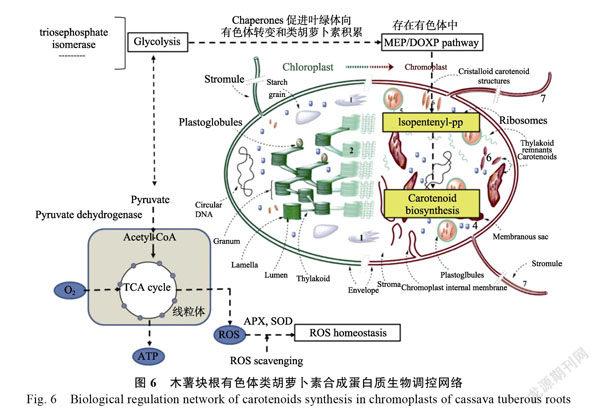
木薯块根有色体类胡萝卜素合成蛋白质生物调控网络
通过‘SC9’、‘BGM019’和‘SC101’块根有色体差异蛋白质鉴定得出,‘SC9’有色体的独有蛋白质12个,‘BGM019’有色体19个,‘SC101’15个(表2)。这些有色体特有的差异蛋白质对黄心木薯和白心木薯在类胡萝卜素和蛋白质的积累中起到比较重要的作用,根据KEGG代谢途径的数据库(http://www.genome.jp/kegg/pathway.html)
和差异蛋白质的功能构建木薯块根有色体类胡萝卜素合成蛋白质生物调控网络,如图6所示。
类胡萝卜素的合成和积累涉及糖酵解、三羧酸循环和MEP/DOXP等代谢途径,其中MEP/DOXP主要发生在有色体中。在‘SC9’、‘BGM019’和‘SC101’块根有色体的独特蛋白质主要和糖酵解、三羧酸循环和MEP/DOXP等代谢途径相关。据报道,在花椰菜中发现的OR蛋白具有类似DnaJ的锌指结构,能够调控细胞中丰富的前体或无色体向有色体转变,在有色体中形成丰富的类胡萝卜素螯合结构,从而使大量的β-胡萝卜素积累得到合成和积累。研究还发现独特的类胡萝卜素生物合成调控因子能促进有色体的发育,如在番茄中发现的HSP21能够促进叶绿体向有色体的转化,过量表达HSP21促进了果实提前积累类胡萝卜素。在本研究中黄心木薯‘SC9’和‘BGM019’的chaperones蛋白质均有上调表达,而‘SC101’的chaperones蛋白质下调,这也说明黄心木薯有色体形成比白心木薯多,黄心木薯类胡萝卜素合成和积累比白心木薯高(表2)。
讨论
本研究结果表明,随着黄心木薯‘SC9’和‘BGM019’块根发育成熟,从形成期、膨大期至成熟期,其块根蛋白质含量和类胡萝卜素含量呈不断增加趋势,且二者成正相关。原因主要是木薯块根中有色体是类胡萝卜素的载体,而有色体一般认为是由白色体或叶绿体转变而形成的。在木薯块根中白色体主要是淀粉体,因此,淀粉体向有色体转变后,为类胡萝卜的合成和积累提供了场所和载体。为保证有色体结构稳定和功能发挥以及类胡萝卜素积累的持续,导致一系列蛋白质参与促成这些代谢过程的稳定运行,因而从总体上提高了蛋白质的含量。本研究结果与CARVALHO等研究结果一致。
以‘SC9’与‘SC101’为例,其类胡萝卜素含量在2个生长发育时期差异均达极显著,而‘SC9’上调表达蛋白质在差异表达蛋白质中占优势,这可能与其有色体类胡萝卜积累能力更强相关。此外,对3个木薯品种在膨大期与成熟期差异蛋白质点进行进一步的对比分析发现,20个差异表达蛋白质在其中2个品种或3个品种间出现相同的表达趋势。但这20个差异蛋白质点表达特征并不完全一致,有4个差异蛋白质点在其中1个品种上调表达,而在另外的1个或2个品种则下调表达。这4个差异蛋白质点分别是:属于细胞骨架蛋白的肌动蛋白(actin-1),其在‘SC9’块根有色体上调表达,而在‘BGM019’块根有色体则下调表达;功能未知的假定蛋白(hypothetical protein SORBIDRAFT_08g0185 60),在‘BGM019’块根有色体下调表达,而在‘SC101’块根有色体则上调表达;分子伴侣的小热激蛋白(small heat shock protein isoform 2-T. cacao),其在‘SC9’块根有色体下调表达,而在‘BGM019’及‘SC101’块根有色体均上调表达;以及在‘SC9’表达上调,而在‘BGM019’表达下调的抗坏血酸过氧化物酶。肌动蛋白是生物体中微丝的两个单体亚基之一,对细胞活动起着很大的作用,比如细胞的转移、分裂和原质的流动、细胞间信息的传递、以及细胞的形状和连结的建立和维持等。因此推测‘SC9’块根成熟期由于类胡萝卜素的不断积累导致细胞活动更频繁,从而使肌动蛋白上调表达。抗坏血酸过氧化物酶(APX)是植物活性氧代谢中重要的抗氧化酶之一,在植物抗氧化系统中,是清除过氧化氢的主要酶类。有关拟南芥的某些研究表明,APX2主要在极端光照或者热胁迫时起作用。有研究表明APX2也与信号转导相关,而且ABA也参与到了此信号转导的调控网络中。APX2在‘SC9’上调表达,在‘BGM019’下调表达,而成熟期时‘SC9’类胡萝卜含量极显著高于‘BGM019’,可能是由于APX2提高了信号转导的效率,同时ABA促进了类胡萝卜素的积累;当细胞受到感染、热激或氧化损伤等反应时,热激蛋白会大量表达,识别错误折叠或去折叠的蛋白质,同时标记它们以供蛋白酶体降解。而小热激蛋白在‘SC9’下调表达,而在‘BGM019’和‘SC101’均上调表达,推测在成熟期时3个品种同时发生了细胞应激反应,从而导致热激蛋白的表达,而其在‘BGM019’和‘SC101’中上调表达,则致使一些蛋白质被降解,从而导致块根蛋白质含量下降。
还有16个差异表达蛋白质点在3个品种间或两两间表达特征一致,主要功能为抗氧化(3个,占总相同差异蛋白质点的15%)、碳代谢与能量代谢(2个)、分子伴侣(3个)、细胞骨架蛋白(3个)、蛋白合成(1个)、光合作用(1个)和无机离子运输与代谢(1个),另外2个蛋白质功能未知。抗氧化类的主要为L-抗坏血酸氧化酶、硫氧还蛋白h、异黄酮还原酶同系物。碳代谢与能量代谢的主要为磷酸丙酮异构酶、ATP结合蛋白。分子伴侣类均为热激蛋白,而细胞骨架蛋白主要为肌动族蛋白,以及Remorin蛋白。与无机离子运输与代谢相关的蛋白是钙调蛋白,而与光合作用相关的蛋白质与光系统Ⅰ相关。
抗坏血酸氧化酶是一种存在于细胞质中,能与细胞壁结合的含铜的酶,作为一种末端氧化酶参与一系列的氧化还原反应。能催化抗坏血酸的氧化过程,具有抗衰老等作用,是植物体内物质代谢中重要的酶类。有研究表明,使用脱落酸(ABA)处理植物后,植株体内抗坏血酸氧化酶的活性显著提高,而ABA是类胡萝卜素合成的前体,因此抗坏血酸氧化酶活性也影响类胡萝卜素的合成与积累。硫氧还蛋白h主要存在植物细胞质内,内质网和线粒体内也有发现。硫氧还蛋白在谷物类种子中含量丰富,在种子萌发初期作为种子萌发的信号,导致水解酶抑制剂失活,从而激活丝氨酸蛋白酶活性,最终导致蛋白质降解。还可参与细胞通讯、繁殖等过程。硫氧还蛋白h活性在3个品种木薯块根成熟期都表达上调,而3个品种木薯块根成熟期蛋白质含量高于膨大期含量,故推测硫氧还蛋白h促进了合成酶活性,使蛋白质含量升高。
磷酸丙糖异构酶在糖酵解中的作用不可替代,是有效的能量生成不可或缺的酶。ATP结合蛋白也与能量代谢相关,而‘SC9’在成熟期这2个蛋白均上调表达,而‘BGM019’和‘SC101’分别是磷酸丙糖异构酶与ATP结合蛋白上调表达,说明类胡萝卜素的积累与蛋白质的合成都是需要大量能量的代谢过程,而3个木薯品种在能量代谢的主要途径上有相同也有不同的地方。
Remorin蛋白是一个与质膜/脂筏相联的植物专一性的蛋白家族,在细胞骨架和膜骨架中发挥重要作用,而且可能参与植物发育过程中的信号转导,响应植物防御及生长发育基因的激活而磷酸化。因此,在塊根成熟期,在3个木薯品种块根表达水平均上调,提高了信号转导的效率,促进了块根的生长发育,提高了类胡萝卜素及蛋白质的积累。
钙调蛋白(也称钙调素)是一种能与钙离子相结合的蛋白,且仅在与Ca结合后才具有活性。但其可以与多种蛋白质相结合,从而影响细胞功能的发挥。主要可参与新陈代谢、细胞内运动、细胞凋亡等生命活动。但很多钙调素结合蛋白本身并不能与钙离子直接结合,但钙离子在细胞信号传导过程中作为第二信使,意义重大,因此这些钙调素结合蛋白便利用钙调素作为钙感应器和信号转导分子。转录以及如磷酸化、乙酰化和蛋白酶解等的翻译后修饰均可调节钙调蛋白的功能。钙调蛋白表达水平的上调提高了块根有色体在类胡萝卜素积累及蛋白质合成过程中信号转导的效率,使块根迅速响应类胡萝卜素及蛋白质的合成与积累机制,提高蛋白质含量与类胡萝卜素的积累。
很多与信号转导相关的蛋白质表达上调,促进了整个过程的信号转导效率,加速块根对蛋白质含量与有色体类胡萝卜素积累偶联机制的响应,从而提高了蛋白质含量与类胡萝卜素含量。整个积累代谢过程是需要大量能量供应的,从而导致了与能量代谢相关的蛋白质表达上调。因此,根据上述代谢过程中相关蛋白表达水平的变化,说明影响木薯块根蛋白质含量与有色体中类胡萝卜素的积累的蛋白质表达是一个复杂的调控过程,是由很多蛋白质群组协同作用的结果。
结论
随着木薯块根发育成熟,b-胡萝卜素含量和蛋白质含量均呈上升趋势,且二者之间表现为正相关。说明食用木薯块根中蛋白质含量与β-胡萝卜素的积累可能存在一定的关联性。3个食用木薯品种在同一生长发育时期β-胡萝卜素含量差异达极显著水平,‘BGM019’和‘SC9’蛋白质含量差异不显著,但显著高于‘SC101’。
以膨大期木薯块根为对照,研究成熟期木薯块根有色体蛋白质表达的变化,在‘SC9’成熟期块根有色体检测到36个差异表达蛋白质点,其中26个上调表达,10个下调表达;在‘BGM019’成熟期块根有色体检测到49个差异表达量达2.0倍以上的蛋白质点,其中28个上调表达,21个蛋白质下调表达;而在‘SC101’成熟期块根有色体则检测到38个差异表达的蛋白质点,其中有20个上调表达,18个下调表达。上述差异表达蛋白质分别参与碳代谢与能量代谢、抗氧化、蛋白质合成、无机离子运输与代谢等多个代谢途径,说明木薯块根蛋白质含量的提高和类胡萝卜素积累是由多个代谢途径协同作用的结果。
参考文献
[1] BARSAN C, SANCHEZ-BEL P, ROMBALDI C V, EGEA I. Characteristics of the tomato chromoplast revealed by proteomic analysis[J]. Journal of Experimental Botany, 2010, 61(9): 2413-2431.
[2] CARVALHO L J C B, LIPPOLIS J, CHEN S, SOUZA C R B D, VIEIRA E A, ANDERSON J V. Characterization of carotenoid-protein complexes and gene expression analysis associated with carotenoid sequestration in pigmented cassava ( Crantz) storage root[J]. The Open Biochemistry Journal, 2012, 6: 116-130.
[3] 杨 龍, 周 锴, 安飞飞, 李开绵, 陈松笔. 高效液相色谱测定木薯块根b-胡萝卜素的方法优化[J]. 热带农业科学, 2015, 35(12): 67-72.YANG L, ZHOU K, AN F F, LI K M, CHEN S B. Optimization of HPLC determination method for β-carotene in cassava tuberous roots[J]. Chinese Journal of Tropical Agriculture, 2015, 35(12): 67-72. (in Chinese)
[4] 邓昌哲, 姚 慧, 安飞飞, 李开绵, 陈松笔. 木薯块根有色体分离及其蛋白质组学的研究[J]. 作物学报, 2017, 43(9): 1290-1299.DENG C Z, YAO H, AN F F, LI K M, CHEN S B. Chromoplast isolation and its proteomic analysis from cassava storage roots[J]. Acta Agronomica Sinica, 2017, 43(9): 1290-1299. (in Chinese)
[5] CHEN S, GOLLOP N, HEUER B. Proteomic analysis of salt-stressed tomato () seedlings: effect of genotype and exogenous application of glycinebetaine[J]. Journal of Experimental Botany, 2009, 60(7): 2005-2019.
[6] AN F, CHEN T, STEPHANIE D M A, LI K, LI Q X, CARVALHO L J C B, TOMLINS K, LI J, GU B, CHEN S. Domestication syndrome is investigated by proteomic analysis between cultivated cassava ( Crantz) and its wild relatives[J]. PLoS One, 2016, 11(3): e0152154.
[7] 王凌健, 方 欣, 杨长青, 李建戌, 陈晓亚. 植物萜类次生代谢及其调控[J]. 中国科学: 生命科学, 2013, 43(12): 1030-1046.WANG L J, FANG X, YANG C Q, LI J X, CHEN X Y. Biosynthesis and regulation of secondary terpenoid metabolism in plants[J]. Scientia Sinica Vitae, 2013, 43(12): 1030-1046. (in Chinese)
[8] CARVALHO L J C B, CHEN S B. Genetic resources, evaluation, application and breeding of cassava crop[J]. Chinese Journal of Tropical Crops, 2020, 41(10): 1968- 1978.
[9] 陈 颖, 王 刚, 赵俊霞. 高等植物体内的肌动蛋白[J].生物学通报, 2003, 38(1): 13-15.CHEN Y, WANG G, ZHAO J X. Actin in higher plants[J]. Bulletin of Biology, 2003, 38(1): 13-15. (in Chinese)
[10] GALVEZ-VALDIVIESO G, FRYER M J, LAWSON T, SLATTERY K, TRUMAN W, SMIRNOFF N, ASAMI T, DAVIES W J, JONES A M, BAKER N R, MULLINEAUX P M. The high light response in involves ABA signaling between vascular and bundle sheath cells[J]. The Plant Cell, 2009, 21(7): 2143-2162.
[11] ZHANG M, PICKART C M, COFFINO P. Determinants of proteasome recognition of ornithine decarboxylase, a ubiquitin-independent substrate[J]. The EMBO Journal, 2003, 22(7): 1488-1496.
[12] SCHWARTZ S H, QIN X, ZEEVAART J A. Elucidation of the indirect pathway of abscisic acid biosynthesis by mutants, genes, and enzymes[J]. Plant Physiology, 2003, 131(4): 1591-1601.
[13] 柯希贤. 花生种子萌发过程中硫氧还蛋白h作用研究[D]. 广州: 华南师范大学, 2012.KE X X. Study on the function of thioredoxin h on germinating peanut seed[D]. Guang Zhou: South China Normal University, 2012. (in Chinese)
[14] 程彦伟, 韩建明, 徐晓燕, 张 炜, 王平诸. 植物Remorin蛋白的研究进展[J]. 河南工业大学学报(自然科学版), 2009, 30(4): 88-93.CHEN Y W, HAN J M, XU X Y, ZHANG W, WANG P Z. The research progress of Remorin protein of plants[J]. Journal of Henan University of Technology (Natural Science Edition), 2009, 30(4): 88-93. (in Chinese)
[15] CHIN D, MEANS A R. Calmodulin: a prototypical calcium sensor[J]. Trends in Cell Biology, 2000, 10(8): 322-328.
[16] KORTVELY E, GULYA K. Calmodulin and various ways to regulate its activity[J]. Life Sciences, 2004, 74(9): 1065- 1070.
