氯/氯胺和紫外顺序消毒对管网抗性基因的去除
2022-06-02江海溶张明露
王 玥,白 淼,江海溶,张明露*,张 灿
氯/氯胺和紫外顺序消毒对管网抗性基因的去除
王 玥1,白 淼1,江海溶1,张明露1*,张 灿2*
(1.北京工商大学生态环境学院,北京 100048;2.北京建筑大学环境与能源工程学院,北京 102616)
为探究供水系统中氯/氯胺与低压紫外顺序消毒对抗生素抗性基因(ARGs)分布特征的影响,采用生物膜反应器模拟供水管网,对管网出水和生物膜进行60mJ/cm2低压紫外线(254nm)消毒,并利用高通量定量PCR技术检测模拟管网进、出水及生物膜内的典型ARGs和遗传原件(MGEs).结果表明,管网反应器运行150d,氯和氯胺管网出水ARGs总相对丰度分别为0.13和0.137,生物膜ARGs分别为2.45和0.277,表明供水管网中低剂量的氯或氯胺可有效降低水相和生物膜相中ARGs的相对丰度达90%,且氯胺消毒对生物膜中的ARGs控制作用更显著.氯和氯胺消毒后管网出水再经低压紫外线照射后,ARGs相对丰度分别为0.0682和0.0537,管网生物膜中ARGs的相对丰度分别为2.01和0.194. ARGs与MGEs间的相关性发生显著变化,转座子与和的相关性增强,与和相关性减弱,而整合子与及的相关性增强.研究表明,将紫外线消毒工艺设置在用水终端可以显著降低氯和氯胺管网水中ARGs丰度,但对管网生物膜中的ARGs影响较小.
模拟管网;抗性基因;氯化消毒;低压紫外;高通量定量PCR
20世纪,抗生素的发现挽救了生命的同时也带来了新型的污染物,抗生素抗性基因(ARGs)和抗性细菌(ARB),作为新型污染物会通过人类和牲畜的粪便投放到环境中,已成为公众关注的焦点问题[1-2].目前,ARGs在多种水环境中均有不同程度的检出[3-4].研究表明,ARGs在饮用水中的污染程度现已日益加剧,饮用水供水系统很有可能已经是ARGs的富集场所,迫切需要加强关于如何有效控制供水管网中ARGs的研究.
紫外线(UV)消毒对微生物具有广谱消毒效果,消毒效率高,且不产生有毒有害副产物,但其没有持续消毒效果,存在光复活、暗复活现象[5].研究表明,低剂量的紫外线消毒后,细菌可被重新激活,且其内部基因依旧保留转移能力,然而较高的紫外线消毒后,重新活化的细胞数量不仅减少且其转移能力显著降低[6-7].由于紫外线消毒直接作用于DNA,因此为去除ARGs提供极大可能.已有研究在实验室条件下采用低压紫外对城市污水进行消毒,发现当紫外线剂量为5~10mJ/cm2时,红霉素和四环素类ARGs浓度大幅降低,甚至低于仪器检出限[8].此外,饮用水水厂可以减少一定程度的ARGs,但残留的ARGs仍可能通过水平基因转移造成二次污染.当前有关饮用水中抗性基因去除的研究并不多见.
为探究不同消毒方式的供水管网系统中低压紫外线消毒后ARGs的分布及其去除效果,本文以模拟管网反应器内的抗性基因为研究对象,向管网中分别添加低浓度的氯和氯胺,采集管网进、出水及生物膜进行低压紫外线(254nm)照射,并通过高通量定量PCR技术探究氯/氯胺和紫外线顺序消毒对部分典型ARGs及MGEs的控制情况及去除机制,以期为终端水处理净化工艺对氯和氯胺消毒管网水ARGs的传播和控制提供理论依据和技术支持,保障饮水安全.
1 材料与方法
1.1 模拟给水管网系统
通过连续运行生物膜反应器(CDC)以模拟实际的供水管网系统[9-10].运行过程中,利用磁力搅拌器的转子带动隔板转动,模拟实际管网内的水利条件.采用聚碳酸酯材质(PE)的挂片模拟给水管网管道,磁力搅拌器转速控制在200~300r/min,水力停留时间为12h.进水口为消氯后的实验室自来水(来自城市管网),余氯为0.4~0.6mg/L,浊度为0.62~0.72NTU, TOC为2.28~2.42mg/L, pH值为7.4~7.8.投药进样口分别采用40mg/L的次氯酸钠和氯胺溶液连续进样,通过调整投药进样泵的转速以保证反应器内部总氯浓度始终为0.5mg/L,并每天检测进水口及出水口的总氯及余氯变化.稳定运行后,每隔30d采集水样测定,共运行150d.实验共运行6台反应器,1、2、3号反应器通过蠕动泵连续添加次氯酸钠溶液,4、5、6号反应器连续添加氯胺溶液.
1.2 各相样品的收集
水相样品:通过蠕动泵对水样进行富集,将微生物过滤至孔径为0.22µm、直径为90mm的滤膜上,在超净台中用刮刀刮取20L水样过滤所得滤膜上的微生物菌群,共吸取12mL无菌PBS溶液对刮刀和滤膜表面的菌群进行洗脱,得到水相样品.
生物膜相样品:取CDC反应器的5个挂片置于50mL无菌离心管中,加入12mL PBS溶液,震荡2min,再用超声仪进行脱附,重复3遍.
1.3 目的基因的确定和高通量定量PCR(HT- qPCR)
选取了环境中常见的53种抗生素抗性基因进行高通量定量PCR检测,同时选取16S rRNA通用引物对抗性基因的浓度进行相对定量.
目的基因的确定和高通量定量PCR(HT-qPCR) HT-qPCR检测采用StepOnePlus™实时荧光定量PCR(Thermo),试剂盒为:TB Green™ Premix Ex Taq™ II (Tli RNaseH Plus)(Takara, Code No. RR820A).模板稀释倍数为4倍.qPCR反应条件:95℃预变性30s, 95℃变性5s,60℃退火延伸30s,共40个循环.CT检测限为40个循环.
1.4 低压紫外线照射实验
采用紫外平行光束仪进行紫外照射,测试所用紫外灯功率为30W、254nm的低压汞灯,待光源稳定工作后用UV-B型紫外辐照计检测培养皿表面中心的紫外线强度.
将样品放置于遮光筒正下方,使用石英培养皿作为容器,用磁力搅拌器持续搅拌样品以保证均匀照射.设定紫外强度为60mJ/cm2,在紫外实验前需将处理后的样品通过紫外可见分光光度计测定吸光度,根据吸光度将样品稀释至3倍以排除样品内部颗粒物等造成的遮挡干扰,并依次分两批取18mL水样注入培养皿中,根据国际紫外线协会数据进行紫外照射[11].
1.5 数据处理
使用Microsoft Excel 2010进行数据分析,使用SPSS软件(PASW Statistics 20.0)进行统计分析.使用Canoco 5.0版软件用于主成分分析(PCA)和冗余分析(RDA),以观察样品的分布特征及相关性.
2 结果与讨论
2.1 模拟管网中ARGs的分布特征
2.1.1 模拟管网中抗性基因检出数量 水相和生物膜相中共检出39种ARGs(表1).结果显示紫外线照射后,ARGs的数量及类型分布无明显变化.
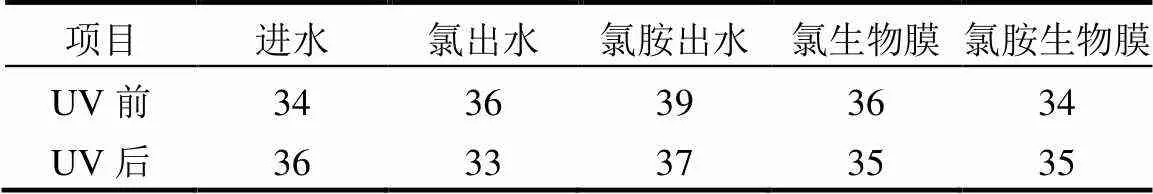
表1 模拟管网中抗性基因检出数量
2.1.2 模拟管网水相中抗性基因丰度变化 由图1可知,未经紫外线照射的进水中ARGs的相对丰度高于两组管网出水,而经紫外线照射后的进水中部分ARGs的相对丰度升高,其中Beta Lactamase、FCA和MLSB类最为显著,其相对丰度变化分别从0.671、0.0202、0.128升至1.62、0.0637、0.218. 其中,Beta Lactamase类在进水中占比最大(占43%).未经紫外线照射的管网出水中,ARGs类型分布区别较大,总丰度分别为0.13和0.137,但氯消毒后的管网出水以Beta Lactamase(9.67´10-2)为主,而氯胺消毒后的管网出水中ARGs分布比较均匀,以Aminoglycoside (2.88´10-2)、Beta Lactamase(9.80´10-3)、other/efflux (2.87´10-2)、Sulfonamide (1.96´10-2)和MGEs(3.43´10-2)类为主.
研究表明,Beta Lactamase类ARGs在管网水中占有较高比例,在环境中广泛存在,且Beta Lactamase类对几种抗菌药赋予了耐药性[12-13].而两组管网出水中ARGs种类的不同可能与管网生物膜脱落有关[14],研究表明生物膜可以通过调节其内部的微生物群落来适应不同种类的消毒剂[15],而成熟的生物膜在落入水体后可增加自来水中抗性菌的浓度,导致出水中ARGs含量升高,但微生物群落同样影响了ARGs种类[16-18],这使得氯和氯胺消毒的管网出水中基因种类具有较大的差异性.紫外线照射后,两组管网出水中ARGs丰度均呈现显著降低,该现象在氯胺消毒后的管网水中尤为明显,但其中Beta Lactamase及FCA类在紫外线照射后相对丰度出现不同程度上升,分别从9.80´10-3、9.01´10-4升至4.17´10-2、1.95´10-3.
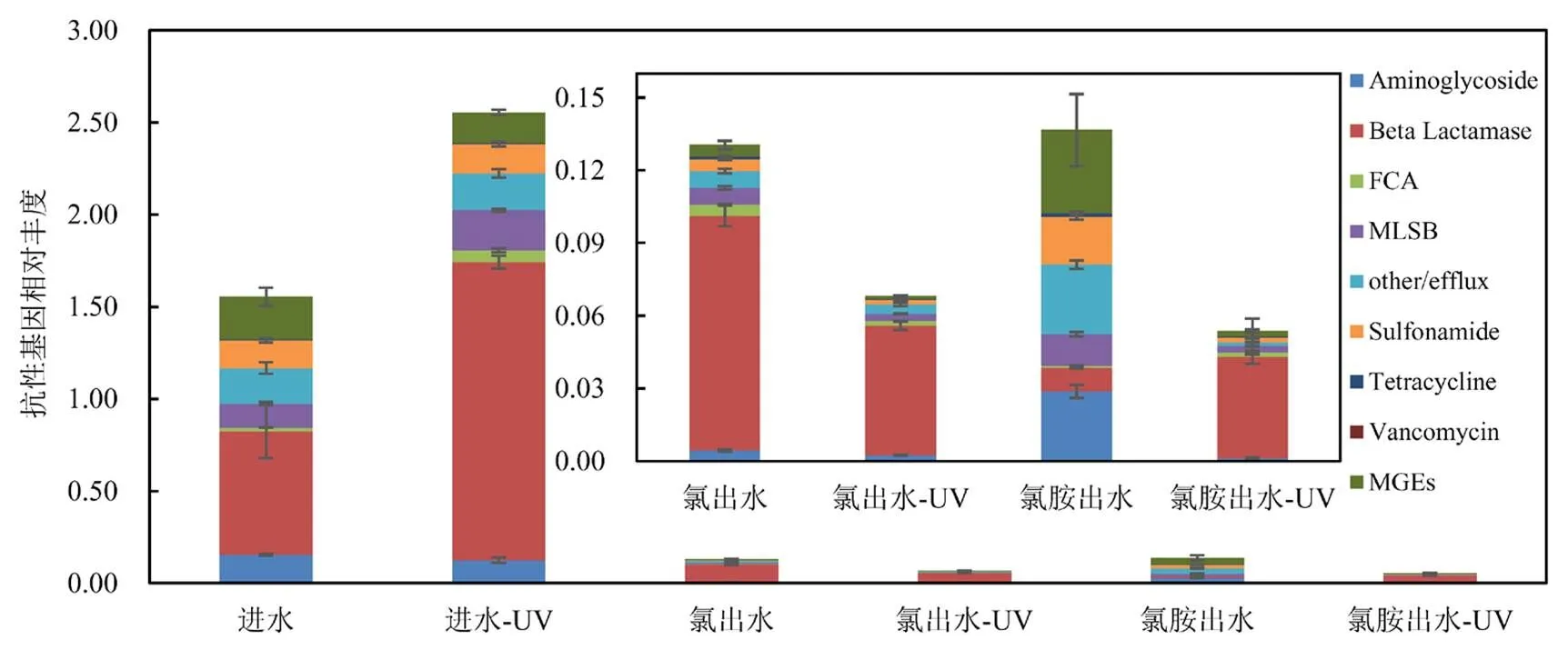
图1 模拟管网水相中抗性基因的相对丰度
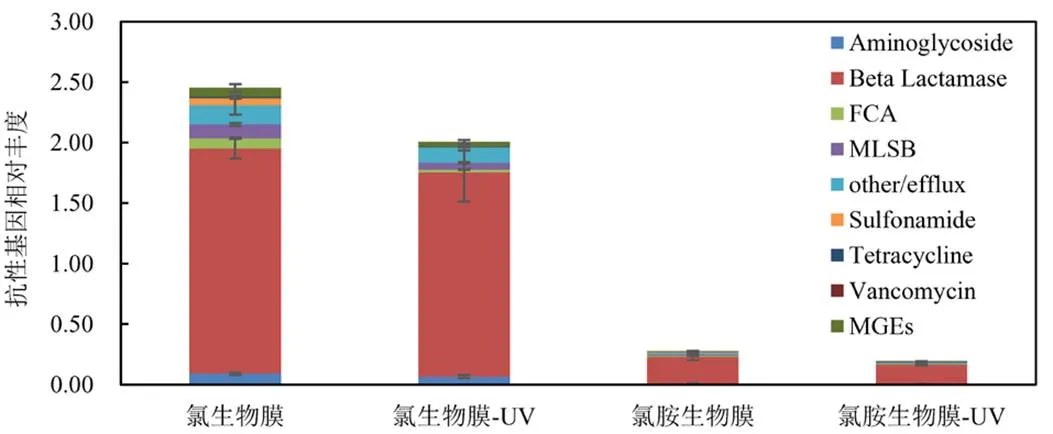
图2 模拟管网生物膜中抗性基因的相对丰度
2.1.3 模拟管网生物膜中抗性基因丰度变化 在供水系统中投加氯/氯胺有助于去除水中部分ARGs,且与紫外顺序消毒可促进ARGs含量进一步降低,但紫外线消毒在单独应用时效果微弱.氯胺与紫外顺序消毒使用时对ARGs的控制作用优于氯与紫外顺序消毒.由图2可知,氯和氯胺生物膜中的ARGs总丰度分别为2.45和0.277.生物膜内的ARGs丰度高于水相,这是由于生物膜形成的微环境会使得其内部活跃或休眠状态的细胞可以在不利的化学条件下触发应激反应[19],成熟的生物膜会导致表型异质性,可在压力最大的生物膜区域形成持久性细胞以及存活但不可培养的(VBNC)细胞[20],因此,生物膜中发现的细菌通常比浮游细菌具有更强的抗生素抗性[21].与氯消毒相比,氯胺消毒管网生物膜中的ARGs丰度显著降低,这是由于氯胺可以更好地穿透生物膜,但这不一定立即导致细胞的失活,而氯消毒虽然穿透速度较慢,但其更有效地灭活了生物膜表面的微生物,从而更易导致细胞失活(释放)[22-23].
未经紫外线照射的样品中,氯消毒管网生物膜内的ARGs丰度远高于氯胺消毒,可见氯胺消毒不易于生物膜内ARGs的传播和扩散.与水相结果相比,生物膜相内的ARGs在紫外线照射后丰度均呈下降趋势.紫外线照射后,两组生物膜的Beta Lactamase类虽有不同程度下降,但在各样品中依旧占有较高比例.
2.1.4 模拟管网多相界面下抗性基因主成分分析 如图3所示,图中前两个PC解释了总计84.56%的偏差,其中PC1解释了69.44%的偏差,PC2解释了15.12%的偏差.由图可知,紫外线消毒前,样品点分布较散,表明样品间ARGs的相对丰度具有显著差异性.紫外线消毒后,样品内ARGs的相对丰度均发生明显变化,其中水相的进水和氯胺消毒出水变化最为显著,氯消毒出水变化程度较小.生物膜相的变化幅度较小,可见紫外线消毒对水体的影响强于生物膜.
2.2 紫外线照射对抗性基因的影响
2.2.1 紫外线照射对抗性基因的削减作用 未经紫外线照射的样品中,水相中氯消毒对ARGs的去除率范围为0.64log(FCA)~1.69log(MGEs),氯胺消毒对ARGs的去除率范围为0.47log(Tetracycline)~ 1.84log(Beta Lactamase),其中氯对Aminoglycoside、MLSB、other/efflux、Sulfonamide、Tetracycline和MGEs类的去除率明显高于氯胺消毒.但氯胺对于Beta Lactamase和FCA类抗性基因的去除效果强于氯消毒,且这两类ARGs在紫外线照射后去除率并没有增加,表明氯胺对Beta Lactamase和FCA类ARGs本身具有较强的去除能力.氯和紫外顺序消毒对ARGs的去除率范围变为0.94log (Vancomycin)~ 2.24log(MGEs),氯胺和紫外顺序消毒对ARGs的去除率范围变为0.92log (Tetracycline)~2.09log (Aminoglycoside),两组管网出水中基因的去除效果发生明显改变.氯胺和紫外顺序消毒对Aminoglycoside、MLSB、other/efflux和Vancomycin类ARGs的去除效果优于氯和紫外顺序消毒.
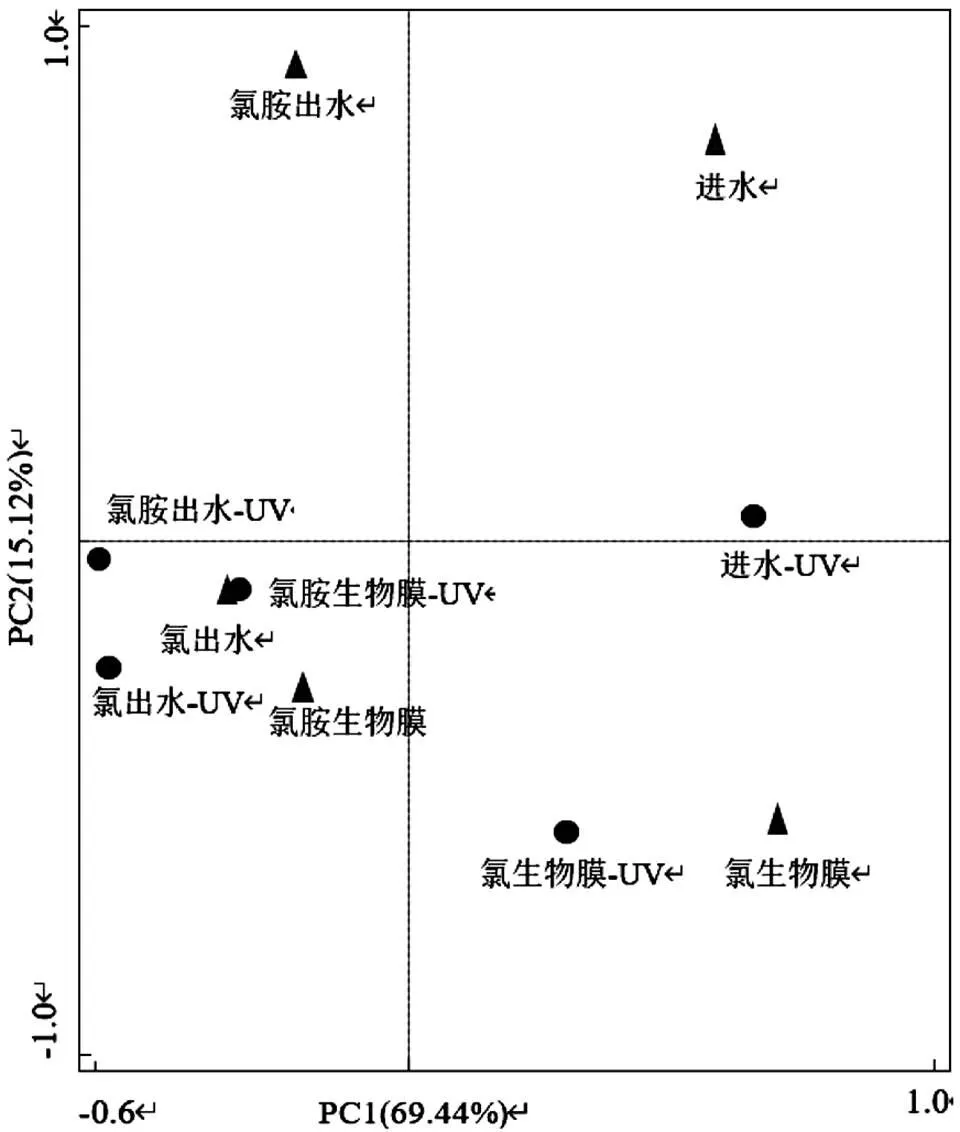
图3 模拟管网多相界面下抗性基因相对丰度的主成分分析(PCA)
生物膜相中氯和紫外顺序消毒对ARGs的去除率范围为0.04log (Beta Lactamase)~1.39log (Sulfonamide),氯胺和紫外顺序消毒对ARGs的去除率范围为0.04log(MGEs)~0.36log (Aminoglycoside、other/efflux);氯和紫外顺序消毒对FCA、MLSB、Sulfonamide、Tetracycline、Vancomycin和MGEs类的去除效果强于氯胺和紫外顺序消毒,在Sulfonamide类的去除效果上尤为显著.
研究发现,氯胺与氯消毒相比无法有效地控制供水系统中ARGs的丰度[24].而Hu认为紫外线消毒能够有效降低嗜盐菌的丰度[25],这可能正是氯胺和紫外顺序消毒后ARGs出现大幅降低的原因.紫外线消毒通常被认为是削减ARGs极为有效的一种方法,但一些细菌由于细胞壁结构或细胞外聚合物(EPS)的保护而具有抗紫外线辐射的能力[26],因此紫外线照射对水体ARGs的削减效果优于生物膜.
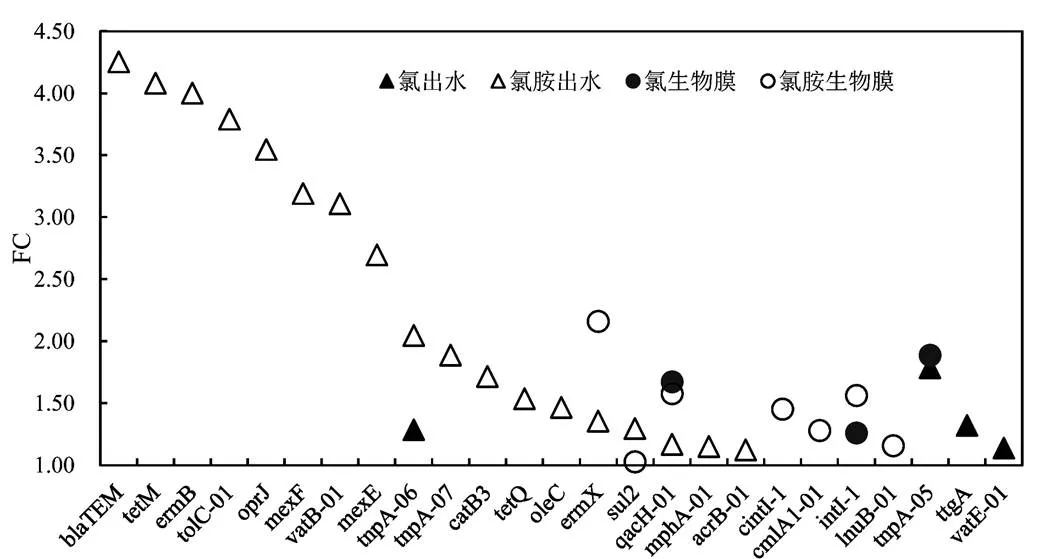
图4 紫外线照射后水相和生物膜抗性基因亚型的倍数变化
表2是水相和生物膜相中的ARGs亚型在消毒剂、紫外线照射及二者顺序消毒后削减的log值.水相结果显示,对于氯胺和紫外顺序消毒,水中内部整合子和的去除率较高,而的去除率也均略高于氯和紫外顺序消毒.所以经过紫外线照射后,氯胺消毒管网出水中ARGs削减的程度高于氯消毒管网出水.图5(a)的相关性证实这几类抗性基因亚型与整合子有着不同程度的正相关性.有研究认为,部分ARGs()的减少主要是由于的减少[27-29].MGEs和细菌群落是影响ARGs变化的两个关键因素,而Ren的研究显示,紫外线消毒过程中,二者的影响效果基本相同[30].
2.2.2 紫外线照射对抗性基因亚型的富集作用 如图4所示,模拟管网的水相及生物膜相样品中共检测出ARGs亚型41个(包括MGEs).紫外线照射后,氯胺消毒管网出水中有18个ARGs发生富集,但9个ARGs的倍数变化(FC值)大于2,其中bla、和的富集倍数最大分别为4.25、4.08和4.00;氯消毒管网出水中仅有4个ARGs发生富集,且FC值均小于2,其中的FC值最大为1.79;氯和氯胺消毒生物膜中分别有3、7个ARGs产生富集,富集程度最大的分别是、, FC值是1.89和2.16.有研究认为,紫外线消毒可通过RND外排系统的耐药机制增强部分ARGs的丰度,如邹爽等报道紫外线消毒富集了多个属于该外排系统的基因[31].
2.2.3 抗性基因亚型相对丰度显著性分析 以未经紫外线照射的样品结果为对照组,计算紫外线照射后ARGs亚型的P值(p-value).模拟管网水相和生物膜相的结果分别如表3和表4所示.紫外线照射后,水相中有11种ARGs亚型在氯和氯胺消毒管网出水中出现显著差异,但氯胺消毒管网出水中的差异更为显著,且、、、、仅在氯胺消毒管网出水中具有显著差异;生物膜相中的ARGs亚型在氯消毒后具有较强的差异性,而在氯胺消毒后的生物膜中差异性较小,且通过与水相结果的对比,可发现紫外线照射对生物膜内的ARGs影响较弱.

表2 水相和生物膜相中抗性基因亚型的去除率

表3 紫外线照射后水相中抗性基因亚型的P值
注:*表示值<0.05,代表有显著差异;**表示值<0.01,代表有极显著差异.

表4 紫外线照射后生物膜相中抗性基因亚型的P值
注:*表示值<0.05,代表有显著差异;**表示值<0.01,代表有极显著差异.
2.2.4 抗性基因与移动原件的相关性分析 如图5(a)所示,该部分ARGs选取自2.2.3中具有显著差异的基因;其中,整合子包括,、;转座子包括,、、、、、.图5(a)中,前两个轴分别解释了98.75%和1.19%.可以观察到,、、与整合子具有显著正相关性;、、、bla、、、、、及与转座子具有显著正相关;、、、、分别与整合子及转座子具有正相关性,这与紫外线照射前后抗性基因相对丰度变化相一致.在Yan[32]的研究中同样发现与和具有显著正相关性,这可能是由于在1类整合子的3'-保守区段(CS)区域中起部分结构的作用[33].
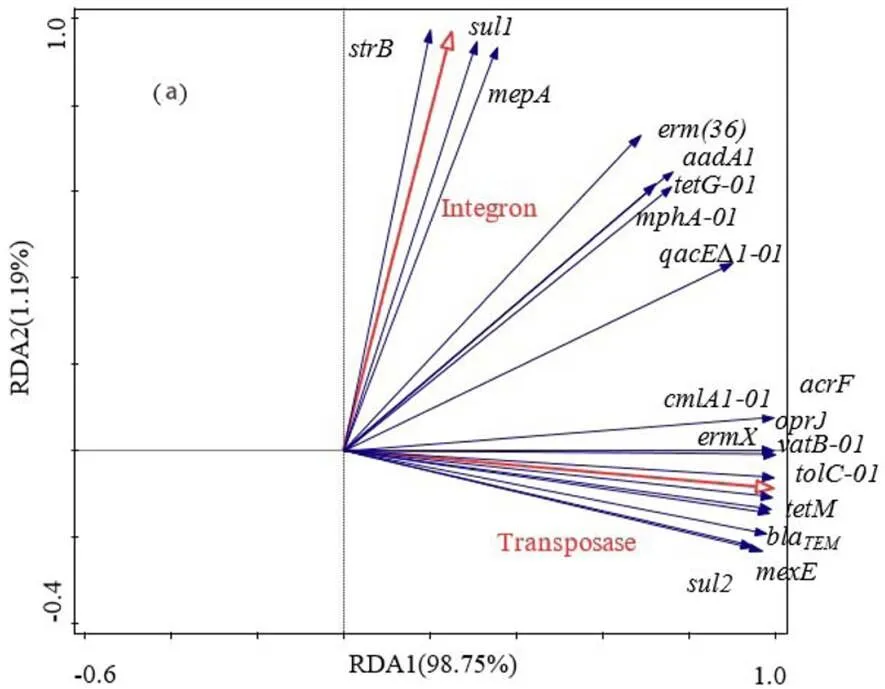
由图5(b)可以观察到,前两个轴分别解释了98.57%和1.00%,与未经紫外线照射的结果具有明显差异,ARGs亚型均与整合子及转座子具有正相关性.与整合子、与转座子分别具有显著的正相关性,与未经紫外线照射的结果相似;但、与整合子的相关性减弱,与转座子的相关性增强;、bla及与转座子的相关性均出现不同程度的减弱,其中相关性削减的最严重,且同时发现及与整合子的相关性增强.由于紫外线对基因产生的破坏导致紫外线照射后ARGs与MGEs之间的关系发生变化[34].在Habimana等[35]的研究中,通过DNA凝胶电泳证实氯消毒剂和紫外顺序消毒不仅可以对ARGs ()造成损伤,且其损伤程度均大于消毒剂和紫外线单独作用.
3 结论
3.1 添加低剂量的氯或氯胺消毒剂可以有效降低模拟管网水相和生物膜相中ARGs的相对丰度,且氯胺消毒对生物膜中的ARGs具有更好的控制作用,可降低90%以上.
3.2 氯或氯胺和60mJ/cm2低压紫外线顺序消毒可提高ARGs的去除率,其中,氯胺和紫外顺序消毒对水相中ARGs的去除效果优于氯和紫外线顺序消毒,但均对生物膜中ARGs的影响较小.此外,紫外线与氯胺的顺序消毒作用也能导致部分ARGs富集,如bla、和等.
3.3 通过RDA相关性分析,紫外线照射后,ARGs与MGEs间的相关性发生显著变化,其中,转座子与和的相关性增强,与和相关性减弱,而整合子与及的相关性增强.
[1] Hall C W, Mah T F. Molecular mechanisms of biofilm-based antibiotic resistance and tolerance in pathogenic bacteria [J]. FEMS Microbiology Reviews, 2017,41(3):276-301.
[2] Li B, Yang Y, Ma L, et al. Metagenomic and network analysis reveal wide distribution and co-occurrence of environmental antibiotic resistance genes [J]. ISME Journal, 2015,9(11):2490-2502.
[3] Su H C, Liu Y S, Pan C G, et al. Persistence of antibiotic resistance genes and bacterial community changes in drinking water treatment system: From drinking water source to tap water [J]. Science of the Total Environment, 2018,616-617:453-461.
[4] Zheng J, Zhou Z C, Wei Y Y, et al. High-throughput profiling of seasonal variations of antibiotic resistance gene transport in a peri-urban river [J]. Environment International, 2018,114:87-94.
[5] 尤作亮,张金松,刘 茜.饮用水紫外消毒技术 [J]. 城镇供水, 2004, 1:61-63.
You Z L, Zhang J S, Liu Q. UV disinfection technology for drinking water [J]. City and Town Water Supply, 2004,1:61-63.
[6] Guo M T, Kong C. Antibiotic resistant bacteria survived from UV disinfection: Safety concerns on genes dissemination [J]. Chemosphere, 2019,246:827-832.
[7] 庞宇辰,席劲瑛,胡洪营,等.再生水紫外线-氯联合消毒工艺特性研究 [J]. 中国环境科学, 2014,(6):6.
Pang Y C, Xi J Y, Hu H Y, et al. Evaluation of sequential use of UV irradiation and chlorination to disinfect reclaimed water [J]. China Environmental Science, 2014,(6):6.
[8] Guo M T, Yuan Q B, Yang J. Ultraviolet reduction of erythromycin and tetracycline resistant heterotrophic bacteria and their resistance genes in municipal wastewater [J]. Chemosphere, 2013,93(11):2864- 2868.
[9] Ling F, Liu W T. Impact of chloramination on the development of laboratory-grown biofilms fed with filter-pretreated groundwater [J]. Microbes & Environments, 2013,28(1):50-57.
[10] Zhang M L, Wang L, Xu M Y, et al. Selective antibiotic resistance genes in multiphase samples during biofilm growth in a simulated drinking water distribution system: Occurrence, correlation and low- pressure ultraviolet removal [J]. The Science of the total environment, 2018,649:146-155.
[11] 李梦凯,强志民,史彦伟,等.紫外消毒系统有效辐射剂量测试方法研究进展 [J]. 环境科学学报, 2012,32(3):513-520.
Li M K, Qiang Z M, Shi Y W, et al. Research progress on the effective dose measurement methods for UV disinfection facilities [J]. Acta Scientiae Circumstantiae, 2012,32(3):513-520.
[12] Guo M T, Yuan Q B, Yang J. Distinguishing effects of ultraviolet exposure and chlorination on the horizontal transfer of antibiotic resistance genes in municipal wastewater [J]. Environmental Science & Technology, 2015,49(9):5771-5778.
[13] 韩小姣,黄 正.自来水消毒对内毒素及微生物处理效果分析 [J]. 中国公共卫生, 2016,32(2):215-217.
Han X J, Huang Z. Effect of disinfection treatment on endotoxin and microorganism in drinking water in Wuhan City [J]. Chinese Journal of Public Health, 2016,32(2):215-217.
[14] Moxon C A, Paulus S. Beta-lactamases ininfections in children [J]. Journal of Infection, 2016,72:41-49.
[15] Zhang J, Li W, Chen J, et al. Impact of biofilm formation and detachment on the transmission of bacterial antibiotic resistance in drinking water distribution systems [J]. Chemosphere, 2018,203: 368-380.
[16] 孙 凤,俞鸿飞,胥辰卉,等.蓝藻胞外聚合物对供水管网水质的影响 [J]. 中国环境科学, 2020,40(12):5343-5351.
Sun F, Yu H F, Xu C H, et al. Influence of cyanobacterial extracellular polymeric substances on the water quality in water supply distribution system [J]. China Environmental Science, 2020,40(12):5343-5351.
[17] 罗 晓,张文丽,袁立霞,等.纳污河流抗性基因和微生物群落相关性 [J]. 中国环境科学, 2019,39(6):2606-2613.
Luo X, Zhang W L, Yuan L X, et al. Correlation between resistance genes and microbial community in polluted rivers [J]. China Environmental Science, 2019,39(6):2606-2613.
[18] 付树森,王 艺,王肖霖,等.氯和紫外消毒过程中胞外抗性基因的产生特征 [J]. 中国环境科学, 2021,41(10):7.
Fu S S, Wang Y, Wang X L, et al. Generation of extracellular antibiotic resistance genes during municipal wastewater chlorination and UV disinfection [J]. China Environmental Science, 2021, 41(10):7.
[19] Flemming H C, Wingender J, Szewzyk U, et al. Biofilms: An emergent form of bacterial life [J]. Nature Reviews Microbiology, 2016,14(9): 563-575.
[20] Ayrapetyan M, Williams T C, Oliver J D. Bridging the gap between viable but non-culturable and antibiotic persistent bacteria [J]. Trends in Microbiology, 2015,23(1):7-13.
[21] 尹 朗,赵 丹,张素佳,等.饮用水管网生物膜细菌群落特征及其对腐蚀的影响 [J]. 环境工程学报, 2016,10(10):5453-5458.
Yin L, Zhao D, Zhang S J, et al. Characteristics of biofilm bacterial communities in drinking water pipelines and their effects on corrosion [J].Chinese Journal of Environmental Engineering, 2016,10(10): 5453-5458.
[22] Lee W H, Wahman D G, Bishop P L, et al. Free chlorine and monochloramine application to nitrifying biofilm: Comparison of biofilm penetration, activity, and viability [J]. Environmental Science & Technology, 2011,45(4):1412-1419.
[23] 刘炫圻,冯萃敏,汪长征,等.紫外线-茶多酚联用对供水管网的消毒效果 [J]. 中国环境科学, 2020,40(4):1563-1569.
Liu X Q, Feng C M, Wang C Z, et al. Effect of combined disinfection using ultraviolet and tea polyphenols in network [J]. China Environmental Science, 2020,40(4):1563-1569.
[24] Hu Q, Zhang X X, Jia S, et al. Metagenomic insights into ultraviolet disinfection effects on antibiotic resistome in biologically treated wastewater [J]. Water Research, 2016,101(15):309-317.
[25] 周海东,黄丽萍,陈晓萌,等.人工生态系统对城市河流中抗生素和ARGs的去除 [J]. 环境科学, 2021,42(2):850-859.
Zhou H D, Huang L P, Chen X M, et al. Removal of antibiotics and antibiotic resistance genes from urban rivers using artificial ecosystems [J]. Environmental Science, 2021,42(2):850-859.
[26] 文尚胜,左文财,周悦,等.紫外线消毒技术的研究现状及发展趋势 [J]. 光学技术, 2020,46(6):664-670.
Wen S S, Zuo W C, Zhou Y, et al. Research status and development trend of ultraviolet disinfection technology [J]. Optical Technology, 2020,46(6):664-670.
[27] Cesare A D, Fontaneto D, Doppelbauer J, et al. Fitness and recovery of bacterial communities and antibiotic resistance genes in urban wastewaters exposed to classical disinfection treatments [J]. Environmental Science & Technology, 2016,50(18):10153-10161.
[28] Zheng J, Su C, Zhou J, et al. Effects and mechanisms of ultraviolet, chlorination, and ozone disinfection on antibiotic resistance genes in secondary effluents of municipal wastewater treatment plants [J]. Chemical Engineering Journal, 2017,317:309-316.
[29] 侯鸾凤.饮用水给水处理系统微生物多样性研究 [D]. 广州:华南理工大学, 2018.
Hou L F. Study on microbial diversity of drinking water treatment system [D]. Guangzhou: South China University of Technology, 2018.
[30] Zhuang Y, Ren H, Geng J, et al. Inactivation of antibiotic resistance genes in municipal wastewater by chlorination, ultraviolet, and ozonation disinfection [J]. Environmental Science and Pollution Research, 2015,22(9):7037.
[31] 邹 爽,单旭亮,汤 杰,等.超声波/紫外协同氯消毒处理砂滤水的试验研究 [J]. 工业水处理, 2018,38(2):31-35.
Zou S, Shan X l, Tang J, et al. Experimental research on the treatment of sand-filtered water by the combined process US/UV-sodium hypochlorite disinfection [J]. Industrial Water Treatment, 2018,38(2): 31-35.
[32] Yan M, Xu C, Huang Y, et al. Tetracyclines, sulfonamides and quinolones and their corresponding resistance genes in the Three Gorges Reservoir, China [J]. The Science of the Total Environment, 2018,631-632:840-848.
[33] Zhang T Y, Hu Y, Jiang L, et al. Removal of antibiotic resistance genes and control of horizontal transfer risk by UV, chlorination and UV/chlorination treatments of drinking water [J]. Chemical Engineering Journal, 2019,358:589-597.
[34] 李树铭,王 锦,王海潮,等.UV、O3及UV/O3削减耐药菌和抗性基因性能 [J]. 中国环境科学, 2019,39(12):5145-5153.
Li S M, Wang J, Wang H C, et al. Reduction of ARB and ARGs by ultraviolet, ozone and combined disinfection technology [J]. China Environmental Science, 2019,39(12):5145-5153.
[35] Habimana O, Heffernan R, Casey E. Nanofiltration-induced cell death: An integral perspective of early-stage biofouling under permeates flux conditions [J]. Journal of Membrane Science, 2017,541:93-100.
Research on removal of antibiotic resistance genes in pipe networks by chlorine/chloramine and UV sequential disinfection.
WANG Yue1, BAI Miao1, JIANG Hai-rong1, ZHANG Ming-lu1*, ZHANG Can2*
(1. School of Ecology and Environment, Beijing Technology and Business University, Beijing 100048, China;2.School of Environmental and Energy Engineering, Beijing University of Architecture and Technology, Beijing 102616, China)., 2022,42(5):2136~2143
In order to explore the influence of chlorine/chloramine and low-pressure ultraviolet sequential disinfection on the distribution characteristics of antibiotic resistance genes (ARGs) in the water supply system, a biofilm reactor was used to simulate the water supply network. The effluent and biofilm of the pipe network were taken for 60mJ/cm2low-pressure ultraviolet (254nm) disinfection, and high-throughput quantitative PCR was used to detect the number of typical ARGs and mobile genetic elements (MGEs) in the inlet, outlet, and biofilm of the simulated pipe network. After 150days, the total relative abundance of ARGs in the effluent of chlorine and chloramine pipe network were 0.130 and 0.137, and the abundance of biofilm were 2.45 and 0.277, respectively. This indicated that low dose of chlorine or chloramine in the water supply pipe network could effectively reduce the relative abundance of ARGs in the water phase and biofilm phase by 90%, and chloramine disinfection has a more significant control effect on ARGs in biofilms. After UV disinfection, the relative abundances of ARGs in chlorine and chloramine disinfected pipe network water were 0.0682 and 0.0537, respectively. The relative abundances of ARGs in biofilms after chlorine and chloramine disinfection were 2.01 and 0.194, respectively. The correlation between ARGs and MGEs changed significantly. The correlation between the transposon andwas enhanced, and the correlation withandwas weakened, while the correlation between the integron and,-01,and-01 was enhanced. The results showed that the ultraviolet disinfection can significantly reduce the abundance of ARGs in the chlorine and chloramine disinfected pipe network water, but it had less effect on the ARGs in the pipe network biofilms.
simulated water distribution system;antibiotic resistance genes;chlorination;low-pressure UV;high-throughput quantitative PCR
X703.5
A
1000-6923(2022)05-2136-08
王 玥(1996-),男,北京人,北京工商大学研究生,主要从事环境微生物方面的研究.
2021-10-20
国家自然科学基金资助项目(51408010,52070193);北京市自然科学基金资助项目(8192053)
* 责任作者, 张明露, 教授, zhangminglu@th.btbu.edu.cn; 张灿, 副研究员,zhangcancqu@163.com
