输注陈旧红细胞对肝细胞癌切除术后病人预后的影响
2022-06-02薛瑞峰赵崇希王培宗陈东泰陈晓辉曾维安
薛瑞峰,赵崇希,王培宗,陈东泰,陈晓辉,曾维安,李 强
(1.中山大学肿瘤防治中心手术麻醉科,广东广州 510060;2.中山大学中山眼科中心麻醉科,广东广州 510060;3.福建省立医院麻醉科,福建福州 350001)
肝细胞癌(hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一,肝细胞癌切除术是肝细胞癌的主要治疗方法[1]。尽管外科技术日益精进,但仍有许多患者在行肝细胞癌切除术时需要术中输血[2]。长时间储存的红细胞会逐渐发生结构和功能的改变,包括红细胞变形性降低、一氧化氮生物活性降低、乳酸和钾离子累积、消耗2,3-二磷酸甘油酸(2,3-diphosphoglycerate,2,3-DPG)和腺苷三磷酸(adenosine triphosphate,ATP),这些红细胞的损伤统称为“储存损伤”[3]。既往有相关临床研究表明,术中是否输注红细胞及红细胞的储存时长与增加死亡率和术后并发症、延长住院时间、延长重症创伤病人与心脏手术病人重症监护(intensive care unit,ICU)的住院时间相关[4-6],术前输血对肝细胞癌切除术后肿瘤预后有不良影响[7-8],但在上述研究中,红细胞的储存时间对病人长期生存和复发的影响却没有被讨论。已有研究认为血制品的储存时间是肿瘤复发的一个显著的不良影响[9],长时间储存的红细胞有促进肿瘤发生的作用[10],输注陈旧红细胞可能会使肿瘤预后恶化。因此,我们将研究红细胞的储存时间是否与接受肝细胞癌切除术患者的长期生存和复发有关。其中,我们也将研究了一种假说,即术中输注储存时间较长的红细胞与肝细胞癌切除术后总生存期缩短和肝细胞癌(肝内和肝外)复发增加相关。
1 材料与方法
1.1 病历资料
本研究对2008 年8 月1 日 至2012 年6 月30 日在中山大学肿瘤防治中心(广州,PR China)接受肝细胞癌切除术的1221 例患者进行了回顾性分析。本研究经中山大学肿瘤防治中心伦理委员会批准,并豁免患者个人知情同意书。
1.2 病例分组
根据术中是否输血(术中至少输注1U 红细胞)将患者分为输血组与未输血组。目前,对于“新鲜”和“陈旧”红细胞的储存时间没有明确定义,但参考相关研究将陈旧性红细胞的储存时间定义为大于14 d[11-13]。根据红细胞的储存时间进一步将红细胞的储存时间小于等于14 d 的病例分为新鲜红细胞组,储存时间大于14 d 的病例分为陈旧红细胞组。为减少混杂因素,本研究剔除了同时接受新旧红细胞的患者(图1)。

图1 入组流程图Fig.1 Flow chart of the patient grouping
在肝细胞癌切除术中,是否需要为患者输注红细胞是由外科和麻醉团队针对患者具体情况作出的判断,没有标准化的准则。其他血液制品(新鲜冷冻血浆、血小板或白蛋白)的输注不能认为是输血。当要求输血时,不同储存时长的红细胞由医院血库随机供应。没有麻醉或外科医生参与选择红细胞的储存时间。
1.3 病例记录及随访
记录患者术前基本情况、肿瘤病理情况及患者术后随访情况。患者术前基本情况包括年龄、性别、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、乙肝血清学检查、术前血红蛋白、术前γ -谷氨酰转肽酶(gamma-glutamyl transpeptidase,GGT)水平、血清(a-fetoprotein,AFP)水平、Child-Pugh 分级以及是否合并门脉高压。我们还收集了其他手术情况进行后续分析,包括肿瘤是否破裂、术中是否阻断血管、肿瘤数量、肝脏切除范围、术中出血量、肿瘤切缘范围、输注红细胞的储存时间等。通过对切除标本的系统回顾,确定病理情况,包括肿瘤最大直径、肝硬化程度、肿瘤分化程度、血管侵犯情况、有无卫星灶以及肿瘤包膜是否完整。
在这项研究中,门脉高压的定义是存在食管胃底静脉曲张和/或脾肿大且血小板计数小于100 000/µL。肝大部分切除定义为切除大于等于3个肝段,肝小部分切除定义为切除小于3个肝段。肿瘤分化分级采用Edmonson -Steiner 分级系统。肿瘤卫星灶是指在主瘤2 cm 内且直径小于2 cm 的病灶。TNM 分期采用美国联合委员会发表的国际抗癌联盟第六版(2002)进行分类。
随访数据截止于2017年6月底,中位随访时间为62.8 个月。肝细胞癌切除术后每隔2 个月进行一次肝脏超声检查,每6 个月进行一次计算机断层扫描或磁共振成像检查。所有随访资料均来自门诊及电话随访。肝内复发的具有典型肝细胞癌特征的肿瘤可根据超声或CT诊断。肝外转移和影像学特征不典型的肝细胞癌均可通过活检确诊。我们将总生存期(overall survival,OS)定义为从手术日期到死亡日期或最后一次随访的时间。肝内无复发生存期(intrahepatic recurrence-free survival,IRFS)定义为从手术日期到首次肝内复发或死亡日期或最后一次随访的时间。肝外无转移生存期(extrahepatic metastasis-free survival,EMFS)定 义为从手术日期到第一次肝外转移日期,或死亡日期或最后一次随访的时间。
1.4 统计方法
比较新鲜红细胞组和陈旧红细胞组患者的术前特征和病理特点。连续变量以均数±标准差()或中位数(下四分位数~上四分位数)[M(P25~P75)]表示。分类变量以数量和比率(%)表示。对于连续变量,分别采用Student’st检验和Mann-Whitney U 检验进行参数分析和非参数分析。分类变量比较采用χ2检验。采用Kaplan-Meier 分析与log-rank 检验对未输血组、新鲜红细胞组、陈旧红细胞组间的OS、IRFS、EMFS 进行比较。采用单因素和多因素Cox 分析确定库存红细胞的存储时间与OS、IRFS 和EMFS 之间的关系,控制临床病理变量。P<0.05 被认为有统计学意义。使用SPSS 18.0软件(Chicago,IL)进行统计分析。
2 结果
2.1 患者基本情况
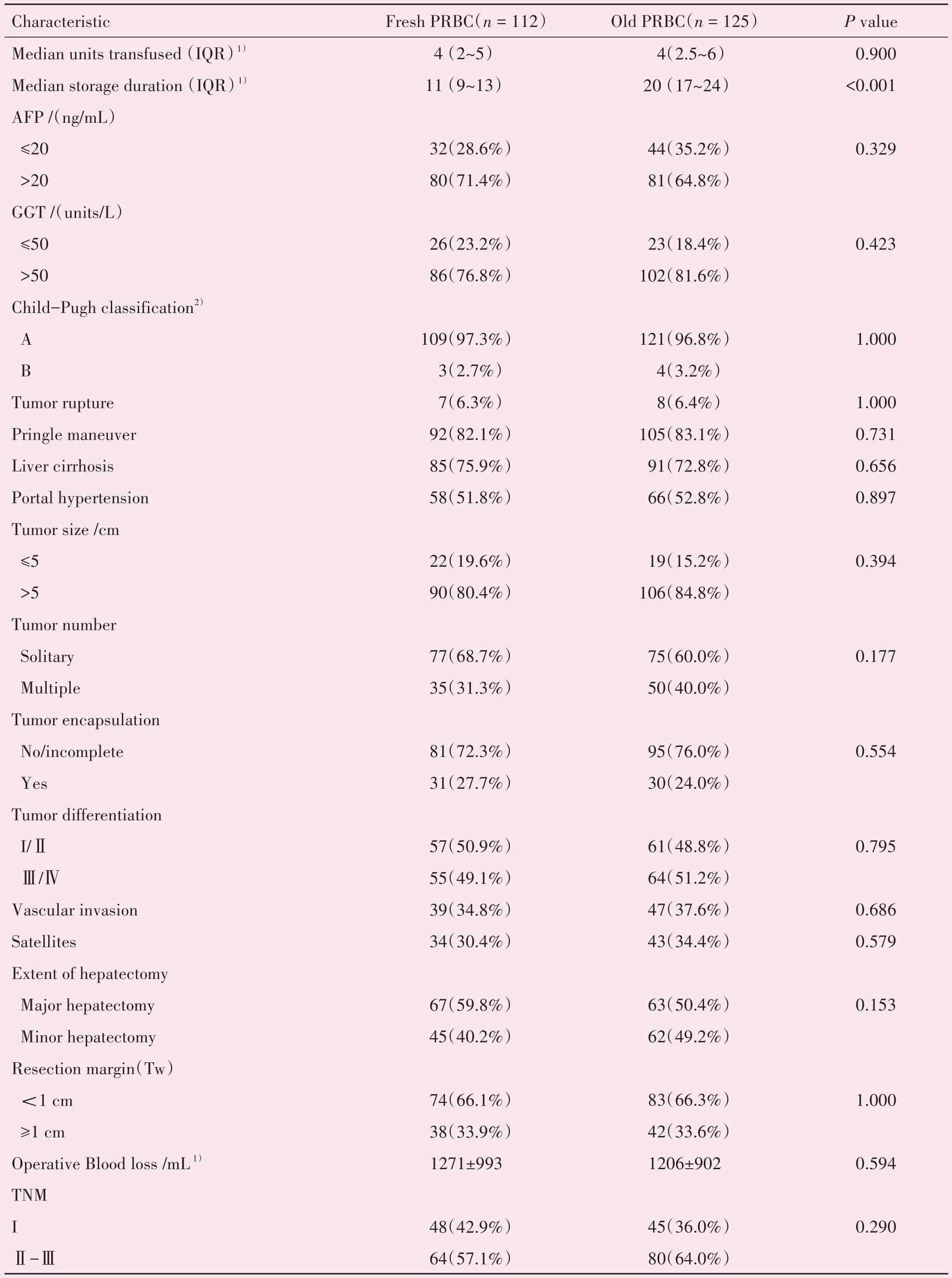
信息不充分、合并其他恶性肿瘤、既往有放化疗史、随访失败或新旧红细胞混合输注的患者被剔除。最终,1221名患者被纳入研究。其中112例患者在手术中输注新鲜红细胞,125 例患者输注陈旧红细胞,984 例患者未输血。根据美国血库协会(American Association of Blood Banks,AABB)的指南,红细胞储存期限根据保存液不同可分为35 d(柠檬酸磷酸葡萄糖CPDA-1 保存液)和42 d(氯化钠腺嘌呤葡萄糖甘露醇SAGM 保存液)[14]。本研究中所输注的红细胞中最长储存时间为35 d,中位时间为15(11~20)d。表1 为接受新鲜和陈旧红细胞患者的基线特征和手术情况。新鲜红细胞组与陈旧红细胞组之间,红细胞的中位贮存天数分别为11(9~13)d 和20(17~24)d。除此之外,输血患者的其他变量在两组之间没有显著差异(表1)。
表1 新鲜红细胞组与陈旧红细胞组之间临床资料比较分析Table 1 Comparisons of patients’characteristics and preoperative variables between the fresh PRBC and old PRBC groups[(),M(P25~P75)]

表1 新鲜红细胞组与陈旧红细胞组之间临床资料比较分析Table 1 Comparisons of patients’characteristics and preoperative variables between the fresh PRBC and old PRBC groups[(),M(P25~P75)]
续表
2.2 长期预后比较
我们使用Kaplan-Meier 分析了红细胞的储存时间与接受肝细胞癌切除术患者长期生存和复发的关系。随访期间,术中输注新鲜红细胞的患者5年总生存率(OS)为42%,而输注陈旧红细胞的患者为37%,未接受任何输血的患者为62%(P<0.001)。术中输血也与肿瘤复发有关,对5 年肝内无复发生存的比较显示,输注陈旧红细胞组的无复发率为33%,相比,输注新鲜红细胞组为48%,未输血组的患者无复发率为57%(P<0.001)。同时,新鲜红细胞组(77%)与陈旧红细胞组(75%)患者的5年无肝外转移生存率(EMFS)低于未输血患者(91%;P<0.001;图2)。与新鲜红细胞组相比,陈旧红细胞组的5 年OS、IRFS 和EMFS 均有下降趋势(图3)。
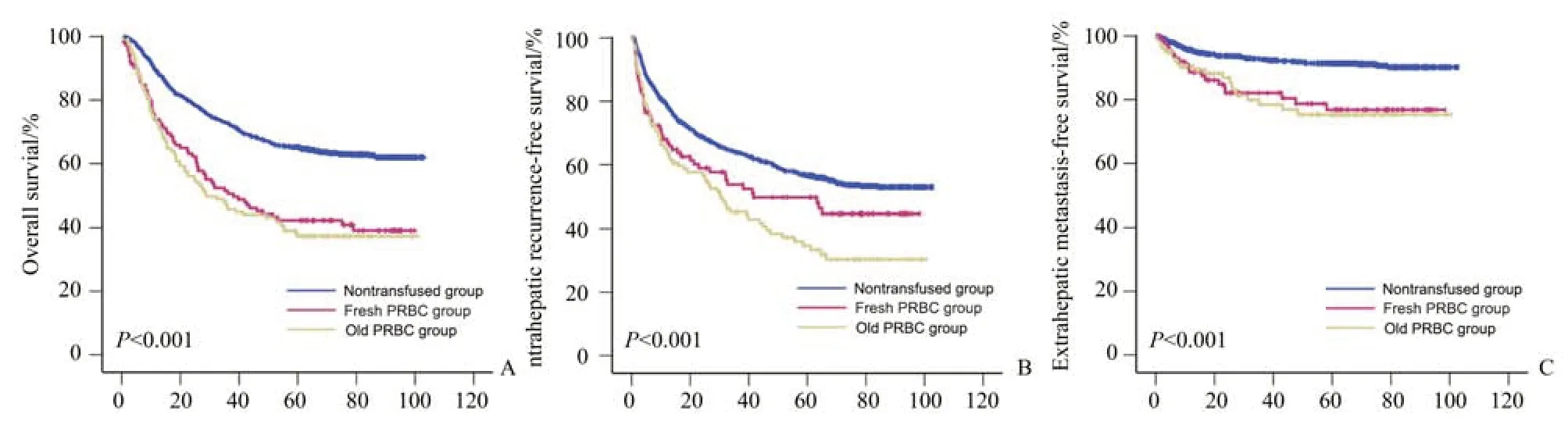
图2 未输血组、新鲜红细胞组、陈旧红细胞组间生存分析比较Fig.2 Cumulative survival in 1221 hepatocellular carcinoma patients with respect to transfusion and storage time of PRBC
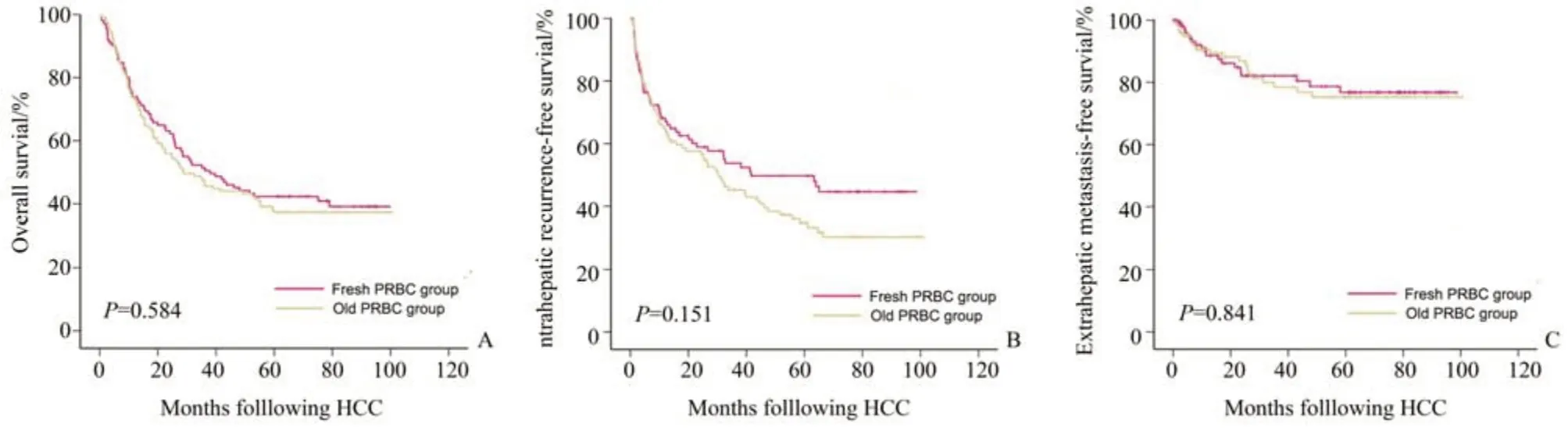
图3 新鲜红细胞组与陈旧红细胞组间生存分析比较Fig.3 Cumulative survival in 237 transfused hepatocellular carcinoma patients with respect to storage time of PRBC
2.3 单因素与多因素COX回归分析
1221例接受肝细胞癌切除术患者的OS、IRFS、EMFS 的单因素回归分析分别见表2-表4。将单因素Cox 回归分析中P<0.05 的变量及与肿瘤临床预后相关的几个变量(P>0.05)纳入多因素分析。由于TNM 分期是根据肿瘤数量、肿瘤大小和血管浸润情况来确定的,所以我们的多因素分析中没有直接使用TNM 分期。在多因素Cox回归分析中(见表5-表7),术中输注陈旧红细胞是与OS(HR95%置信区间:1.417(1.001,2.006);P=0.049)和IRFS(HR95%置信区间:1.545(1.102,2.167);P=0.012)相关的独立危险因素,与EMFS 无关(P=0.223)。然而,术中输注新鲜红细胞并不是增加总死亡率(P=0.081)、肝内复发(P=0.183)和肝外转移(P=0.318)的独立危险因素。
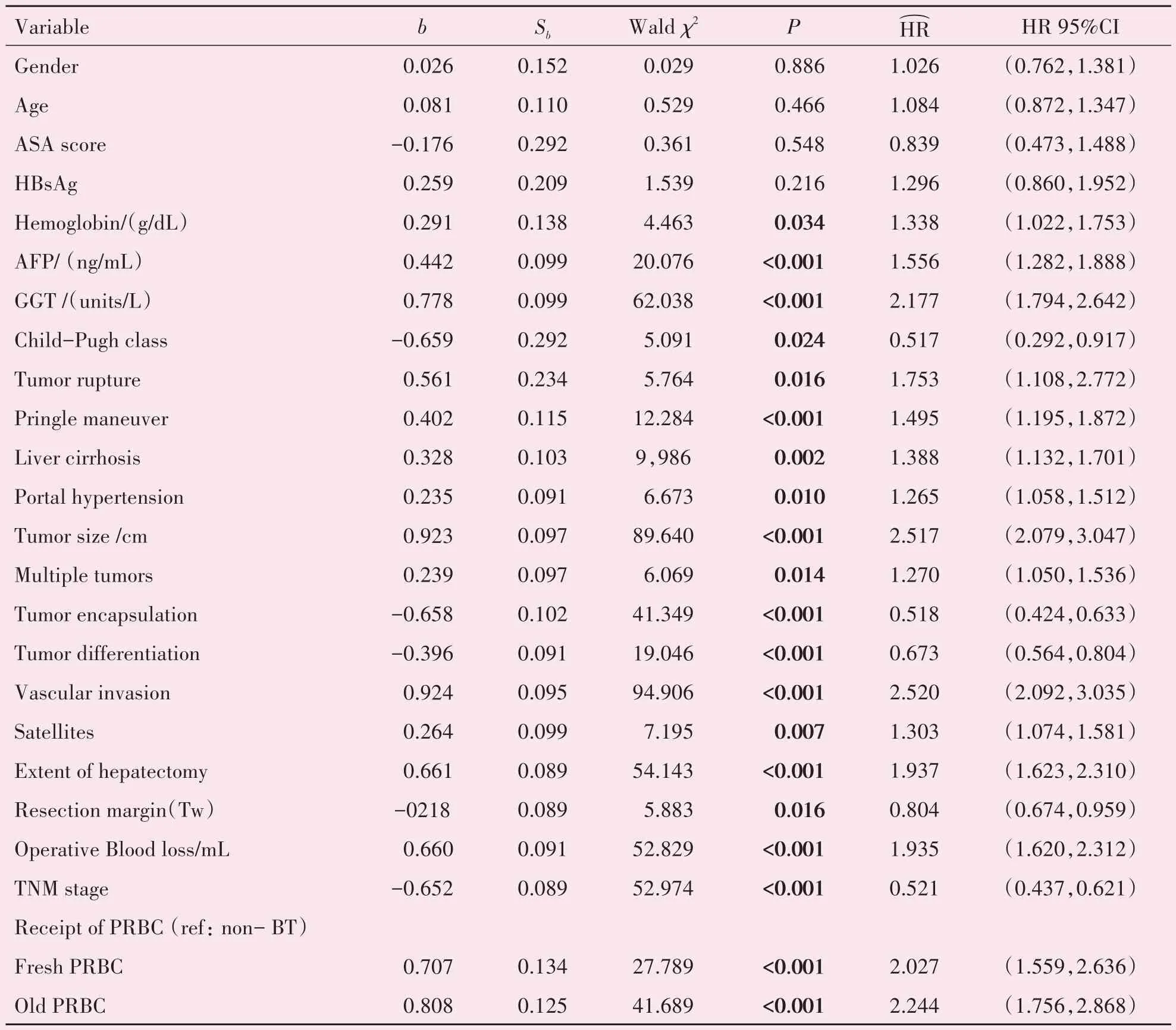
表2 1 221例患者中影响总生存时间的单因素COX分析Table 2 Univariate analysis of prognostic factors associated with OS for 1 221 HCC patients following curative resection

表3 1 221例患者中影响无复发生存时间的单因素COX分析Table 3 Univariate analysis of prognostic factors associated with IRFS for 1 221 HCC patients following curative resection

表4 1 221例患者中影响无转移生存时间的单因素COX分析Table 4 Univariate analysis of prognostic factors associated with EMFS for 1 221 HCC patients following curative resection

表5 1 221例患者中影响总生存时间的多因素COX分析Table 5 Cox multivariate analysis of prognostic factors associated with OS for 1 221 HCC patients following curative resection
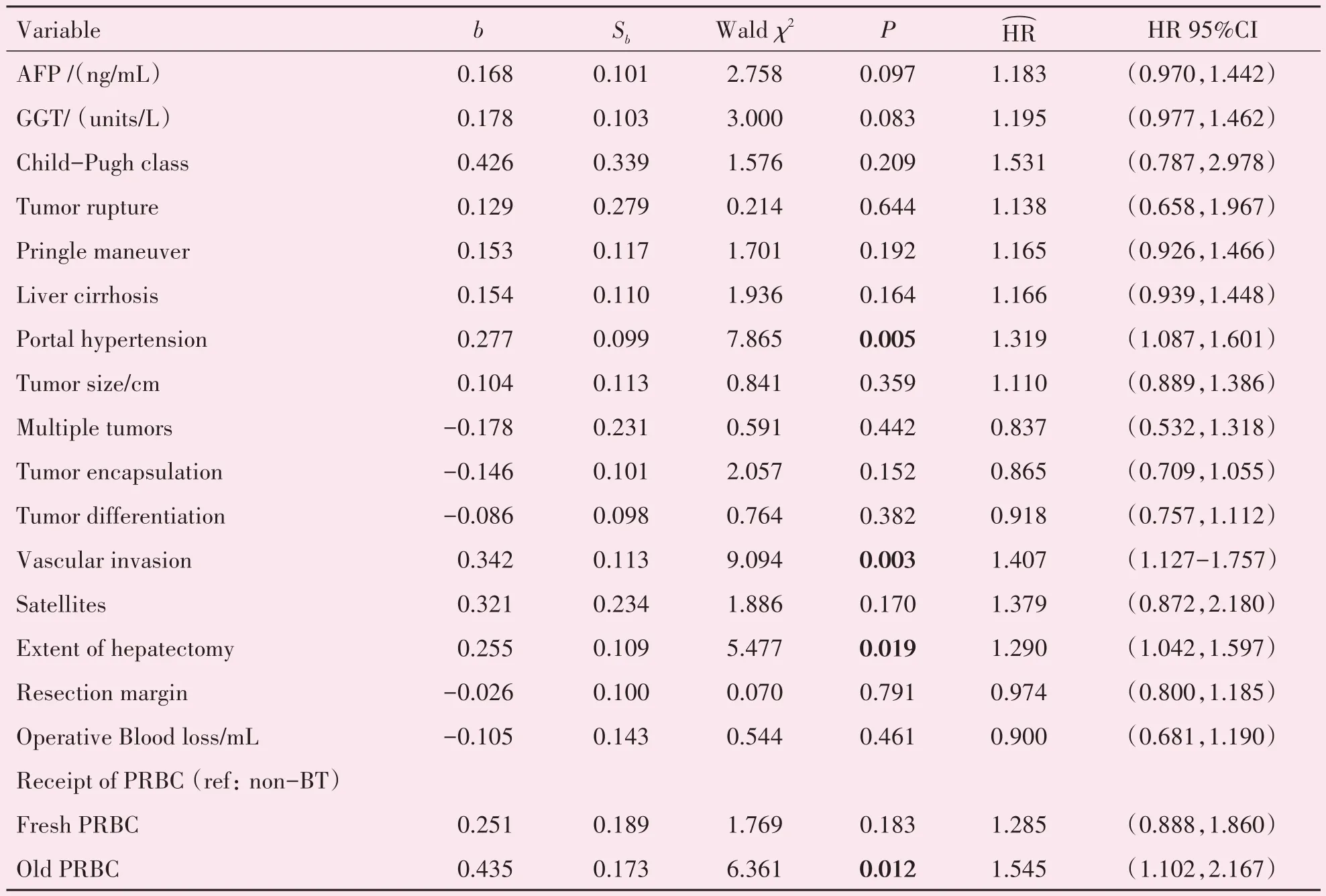
表6 1 221例患者中影响无复发生存时间的多因素COX分析Table 6 Cox multivariate analysis of prognostic factors associated with IRFS for 1 221 HCC patients following curative resection
3 讨论
多项研究表明,围术期输血会促进肝细胞癌切除术后肿瘤的复发并降低长期生存率,同时多因素分析表明,输血是肿瘤不良预后的独立危险因素。尽管输血引起不良预后的潜在病理生理机制仍不清楚,但长时间储存对红细胞造成的损伤已被提出为一种可能的潜在机制。既往研究中,术中输红细胞对肝细胞癌切除术的患者预后的影响尚未被广泛研究。
红细胞的储存损伤大约在储存2 周后变得明显[15],因此使用14 d的临界值来区分新鲜或陈旧红细胞是合理的。在我们的研究中,红细胞的中位保存时间为15 d,因此新鲜红细胞组和陈旧红细胞组的患者数量基本相等。此外,不同储存时间的红细胞由血库随机分配,两组患者基本情况与手术情况无明显差异。我们将讨论长时间储存的红细胞是不是恶化肝细胞癌术后患者预后的独立危险因素。在本研究的所有病例中,Kaplan-Meier 生存分析显示,与未输血的患者相比,术中输血的患者OS、IRFM 和EMFS 更差。此外,陈旧红细胞组的患者与新鲜红细胞组的患者相比,肿瘤预后更差,尤其是对肝内复发的影响(p=0.15)。在多因素Cox 回归分析中,考虑相关临床和病理因素后,我们发现术中输注陈旧红细胞与肝内复发风险显著增加和总生存期降低独立相关。而输注新鲜红细胞对肿瘤不良结局的发生影响不大。我们的研究结果与既往其他相关研究一致,认为在肿瘤患者中,红细胞储存时间的延长对输血后的临床结果是不利的[12,16]。然而,对于红细胞储存时间对肿瘤复发的影响还没有共识[17-18]。
既往有较多相关研究探讨了异基因输血可能会对泌尿系统肿瘤的预后产生不良影响,但这些研究不能证明红细胞的储存时间与异基因输血后肿瘤复发的关系[17,19]。Mynster等[18]指出,输注储存时间小于21 d 的红细胞的患者与未输血的患者相比较,其术后局部复发率较高,而输注储存时间大于21 d的红细胞的患者,其预后结果与未输血的患者相似。既往研究中,患者输血时间混杂,患者在术中和/或术后接受了输注红细胞[17-18,20-22]。我们的研究与上述研究有很大的差异,例如,不同类型的恶性肿瘤,不同输血时间(如,术前、术中、术后),以及对红细胞储存时间的不同分组。我们认为术中输血与肿瘤手术后患者复发风险和死亡率的增加相关[23]。本研究纳入的病例均为术中输注红细胞的患者,这有助于进一步解释红细胞的储存时间与肿瘤预后不良结局之间的正相关关系。
肝细胞癌术后复发分为肝内复发和肝外转移两种。肝内复发包括两种类型:早期复发和晚期复发。早期复发常发生在肝细胞癌切除术后的前2年,由原发肿瘤直接播散形成,而晚期复发是残余肝脏中新生肿瘤的形成。不同类型的复发情况在机制、时间和预后上有很大的不同[24]。许多研究已经对肝细胞癌切除术后复发相关的预后因素进行了探讨,这些研究表明,围术期输注红细胞与肝细胞癌复发有关。然而,大多数相关研究并没有在分析中区分不同类型的复发情况来进行探讨。有关结直肠癌的研究认为围手术期输血与局部复发有关,但与远处转移无关[18]。一些关于肝细胞癌的临床研究显示,输血与肝内复发风险的增加显著相关,尤其是在I-Ⅱ期[25]和无肝内转移的患者中[26]。这些研究似乎表明输血相关的肝内复发可能是肝内晚期复发风险增加的结果。我们的研究进一步发现,输注新鲜红细胞和陈旧红细胞的患者其肝内无复发生存曲线在术后前两年保持平行,但之后两组之间却出现显著差异。这一结果提示输注陈旧红细胞可能会增加残余肝脏内新生肿瘤的复发,而不是增加早期原发肿瘤肝内播散。
术中输注储存时间大于14 d 的陈旧红细胞的患者,其肝内复发率更高且总生存率低的机制尚不完全清楚,但有实验和临床研究表明,输血引起的不良肿瘤预后与术后感染和输血相关免疫调节有关[27-28]。输血相关免疫调节的机制包括抑制性T细胞的活性增加,T4/T8(辅助/抑制)淋巴细胞比率下降,自然杀伤细胞活性和细胞毒性T 细胞功能下降[27]。这将大大降低自身免疫细胞对残余肿瘤细胞的抑制和消除作用。从炎症免疫调节的角度来看,相比新鲜血液制品,输注陈旧血液制品可能会产生更加有害的影响[29]。动物实验表明,红细胞的长期储存会增强促进肿瘤生长和血管生成的免疫调节作用,因此可能在输血的促癌作用中发挥关键作用[10]。与此一致的是,术后感染发生率和死亡率与输注红细胞的储存时间有关[13,30]。围术期输血和术后感染往往导致肿瘤手术后更高的复发率和更低的长期生存率[31]。
本研究有以下几点局限性。首先,该研究是一项回顾性研究,可能会受到其他混杂因素的影响。然而,我们使用了COX 多因素回归方法,发现已知混杂因素在陈旧性红细胞组和新鲜红细胞组的患者之间分布较为均衡。其次,本研究定义了14 d的储存时间来区分红细胞的新鲜程度,所以我们无法进一步分析更长储存时间的红细胞(即,21 d 和/或28 d)与肿瘤预后的关系,在我们的研究中,术中输注储存时间超过21 d 或更长时间红细胞的患者样本量小,可能导致统计效力的丧失。最后,我们的目的是讨论整个样本中长期肿瘤预后的差异,我们没有探讨输血对其他围术期并发症的影响。
综上所述,术中输注储存时间超过14 天的红细胞与肝细胞癌切除术后发生肝内复发率和总体死亡率增加相关,是影响预后的独立危险因素。本研究为肿瘤患者的术中输血管理提供了新的参考信息。
