CFTR氯通道调控小鼠内毒素血症血小板活化及炎症因子生成
2022-06-02王冠蕾
胡 瑞,周 仪,李 梅,王冠蕾
(1.中山大学中山医学院药理学教研室和心脑血管研究中心,广东广州 510080;2.中山大学附属第三医院特诊医疗病区,广东广州 510630)
血小板在体内主要的生理功能是参与凝血、血小板血栓形成及血管收缩[1]。近年来发现血小板通过免疫炎症机制在多种细菌和/或病毒感染性疾病、心血管疾病及肿瘤的发生发展中发挥重要作用[2]。活化的血小板还与单核细胞及淋巴细胞相结合形成微颗粒,促进中性粒细胞胞外捕获网(neutrophil extracellular traps,NETs)的形成,促进炎症因子的生成,从而加重炎症反应[3-4]。最近临床证据表明,部分COVID-19 感染患者血小板过度激活,促血栓形成风险增加,并出现血小板减少的现象[5]。这些新发现支持血小板在疾病相关的炎症因子生成过程中发挥重要作用。脂多糖(lipopolysaccharide,LPS),也称为内毒素,是一种内源性炎症物质。LPS 上的疏水区脂质A 是Toll 样受体4(TLR4)的配体,LPS通过与TLR4结合,激活先天性免疫细胞(如单核细胞和巨噬细胞等)从而介导免疫和炎症反应[6]。LPS 亦可刺激血小板的TLR4 表达上调,诱导促炎性细胞因子包括IL-1β、IL-6、CRP、TNF-α 等的释放,是内毒素血症血小板介导的免疫和炎症反应的关键步骤[7-8]。活化的血小板还通过促进微血栓形成导致血小板减少和加重炎症反应,进一步加重感染[9-10]。但是LPS 诱导内毒素血症血小板活化及其介导炎症因子生成的机制并未完全清楚。囊性纤维化跨膜电导调节体(cystic fibrosis transmembrane conductance regulator,CFTR)是一种cAMP 调节的Cl-通道蛋白,介导氯离子的跨膜转运。CFTR 单基因突变是一种常染色体隐形遗传病囊性纤维化(cystic fibrosis,CF)的主要病因。在CF 患者及CFTR 基因突变小鼠的研究发现:在LPS诱导的肺部炎症模型上,血小板-中性粒细胞相互作用增加[11],主要是由于CFTR 调控中性粒细胞功能所致。另外,应用Cftr-/-小鼠的研究发现,CFTR 可通过调控巨噬细胞的浸润参与动脉粥样硬化[12]。但是,目前尚未有CFTR 氯通道调控血小板炎症反应的报道。静脉注射LPS 制备内毒素血症模型可模拟临床上如严重创伤、感染时TLRs 介导的免疫和炎症。我们通过应用VX-661(一种CFTR 矫正剂)和腺病毒介导的CFTR cDNA过表达和LPS 诱导的内毒素血症小鼠模型,探索CFTR 基因缺失是否可通过上调TLR4 和活化血小板,进而促进内毒素血症时炎症因子的生成?
1 材料与方法
1.1 实验动物
本研究所涉及的所有动物实验经中山大学实验动物伦理委员会的批准,批准编号为:SYSU-IACUC-2020-000446,并且符合科技部《实验动物护理和使用指南》。CFTR 基因敲除小鼠(CFTRtm1Un-crTg(FABPCFTR)1Jaw/J;Cftr-/-)购于美国The Jackson Laboratory,该小鼠是C57BL/6,TVB/N 和129 的混合遗传背景。文中所涉及的C57BL/6 小鼠全部购置于中山大学实验动物中心,动物许可证编号为SCXK(粤)2018-0003。本研究中所有小鼠均为8~12 周龄,性别为雄性,体质量匹配。所有小鼠饲养于中山大学实验动物中心。饲养条件为:SPF 级动物房,每笼5 只小鼠,每日清扫,专人喂养。室温(25±2)℃,相对湿度(60±10)%,模拟正常昼夜生物节律。
1.2 主要材料
人巨核细胞株(megakaryocyte cell strains;MEG-01)细胞购自美国American type culture collection(ATCC),RPMI-1640培养基、胎牛血清(FBS)购自美国Gibco 公司,CFTR 抗体购自美国Novus 公司,β-actin、GAPDH 抗体购自中国Boster生物公司,BCA 试剂盒购自美国赛默飞公司,ECL试剂盒购自美国Millipore公司。
1.3 主要仪器设备
高速冷冻离心机:德国Eppendorf Centrifuge 公司;电转装置:美国Bio-Rad 公司;凝胶成像系统:美国ChemiDoc XRS 公司;流式细胞仪,美国Beckman Coulter 公司;细胞自动计数仪,美国Corning 公司;Q-PCR仪,美国赛默飞公司。
1.4 实验方法
1.4.1 LPS 诱导内毒素血症模型 取8~12 周龄Cftr-/-和Cftr+/+雄性小鼠,分别给予股静脉注射10 mg/kg LPS刺激12 h以建立小鼠内毒素血症模型。
1.4.2 小鼠外周血血小板提取 静脉注射LPS 12 h 后,再给予10 g/L 戊巴比妥钠腹腔注射麻醉,打开小鼠腹腔,使用2 mL 注射器进行腹主动脉取血,全血转移到15 mL 离心管中。在25℃,300×g条件下离心2 min,得到上层富含血小板血清。将上层血清在25℃,500×g条件下再次离心5 min,弃去上清得到血小板沉淀,留下备用。
1.4.3 CFTR 过表达病毒转染 将约2×105个/mL细胞接种于培养皿,当MEG-01 细胞密度达到60%~70%时,取800µL 无血清无抗生素的培养基稀释CFTR 过表达病毒[21]。该病毒由美国爱荷华大学John F.Engelhardt 教授赠与,扩增与优化使其MOI 值为100。将800 µL 稀释后的病毒液加入培养皿,细胞培养箱中培养6 h后吸去培养基,加入正常培养细胞的培养基,继续培养。
1.4.4 CFTR 矫正剂VX661 预处理 将VX-661 充分溶解于DMSO中,之后将浓度调整为0.1 mmol/kg;在LPS 注射前6 h,采用静脉注射的方式给与VX-661使其充分发挥作用。
1.4.5 流式细胞实验 将富含血小板(106个细胞/mL)的PRP在4 ℃条件下用荧光偶联抗体(包括FITC偶联CD61(Biolegend,USA)和APC-eFlour 780 偶联CD62p(P-selectin,Biolegend,USA))标记30 min。然后4%PFA 固定细胞10 min。使用Beckman Gallios 流式细胞仪测量样本,并使用Cytexpert 软件(Beckman Coulter,USA)进行分析。
1.4.6 MEG-01细胞培养 将MEG-01细胞株用含有10%FBS 的RPMI-1640 培养基进行培养,待细胞密度至5×105时进行后续实验。
1.4.7 免疫印迹法 将细胞或血小板加入RIPA 裂解液和蛋白酶抑制剂(cocktail)冰上裂解20 min。在4 ℃,15 000×g条件下离心15 min,得到蛋白上清液。SDS-PAGE 电泳2 h,转膜。封闭90 min 后,与一抗4 ℃孵育过夜,洗膜后,用二抗孵育90 min,ECL 反应显色,显影。使用Image J 1.42 软件,对目的蛋白表达进行相对定量分析。
1.4.8 实时定量PCR 用Trizol试剂(Invitrogen)从血小板和巨核细胞中提取总RNA,用Roche 的Transcriptor cDNA Synthesis Kit逆转录RNA。以GAPDH和β-actin mRNA 作为内参,采用2-ΔΔCt法测定各基因mRNA表达的倍数变化。
1.5 统计学分析
数据数值均采用均数±标准差表示。数据处理两样本间比较采用t检验。多组数据比较采用单因素方差分析(One-way ANOVA),多组数据比较差异有统计学意义后,对于不同浓度处理组检测结果和对照组比较采用Dunnett’st检验;所有数据均采用Graphpad Prism version 8.20 软件统计。P<0.05表示差异具有统计学意义。
2 结果
2.1 CFTR 敲除促进LPS 诱导的小鼠内毒素血症模型的血小板活化和血小板减少
8~12 周龄Cftr-/-和Cftr+/+小鼠分别给予股静脉注射10 mg/kg LPS 刺激12 h 以建立小鼠内毒素血症模型后,分离小鼠外周循环血液的血小板。如图1A 所示,经单因素方差分析,四组间差异具有统计学意义(F=476.4,P<0.000 1)。流式细胞仪分析实验显示,Cftr-/-和Cftr+/+小鼠的血小板P-selectin(CD62P)表达并无显著差异,给予LPS 刺激后,引起P-selectin 表达显著升高,CFTR 敲除进一步促进LPS 诱导的P-selectin 升高(P<0.001)。如图1B 所示,经单因素方差分析,四组间差异具有统计学意义(F=453.2,P<0.000 1)。血小板计数实验结果显示,Cftr-/-和Cftr+/+小鼠血小板数量并无显著差异,给予LPS 刺激后,血小板数量显著降低,CFTR 敲除进一步减低。LPS 刺激可引起血小板显著激活和血小板数量减少(P<0.05),CFTR 敲除进一步促进之。

图1 CFTR敲除加剧LPS诱导的血小板活化和数量减少Fig.1 LPS-induced platelet activation and thrombocytopenia promoted by CFTR knockout
2.2 CFTR 敲除加重LPS 诱导的小鼠外周血血小板TLR4表达上调和促炎症因子mRNA表达上调
应用上述LPS 诱导的小鼠内毒素血症模型,在分离的小鼠外周循环血液的血小板上应用western blot 检测TLR4 的表达。如图2A 所示,经单因素方差分析,四组间差异具有统计学意义(F=116.1,P<0.000 1)。静息时,Cftr-/-和Cftr+/+小鼠血小板的TLR4 蛋白表达并无显著性差异,LPS 刺激后引起血小板TLR4 蛋白表达升高;在Cftr+/+小鼠,与给药前相比,LPS 增加TLR4 表达至274%;在Cftr-/-小鼠,与给药前相比,LPS 增加TLR4 表达至351%;表明CFTR 敲除增加了LPS 诱导的血小板TLR4 蛋白表达,差异具有统计学意义(P<0.01,图2 A)。采用实时定量PCR 检测血小板炎症因子(IL-6、IL-1β、TNF-α、IL-10和CRP)的表达,如图2B 所示,发现CFTR 敲除会加剧LPS诱导的血小板炎症因子IL-6(F=168.9,P<0.000 1)、IL-1β(F=99.26,P<0.000 1)、TNF-α(F=1 336,P<0.000 1)和CRP(F=271.1,P<0.000 1)表达,但降低IL-10(F=93.69,P<0.000 1)表达。

图2 CFTR敲除加重LPS诱导的小鼠外周血血小板TLR4表达上调和促炎症因子mRNA表达上调Fig.2 TLR4 protein expression and mRNA expression of pro-inflammatory cytokines enhanced by CFTR KO in peripheral circulating platelets from mice injected with LPS
2.3 CFTR 过表达抑制LPS 诱导的MEG-01 细胞上TLR4蛋白表达升高
如图3B 所示,经单因素方差分析,四组间差异具有统计学意义(F=269.4,P<0.000 1)。以1µg/mL LPS 与MEG-01 细胞共孵育不同时间,发现LPS 呈时间依赖性地升高TLR4 蛋白表达,这与前述小鼠内毒素血症模型结果一致。为了特异性地研究CFTR 对血小板TLR4 和血小板介导的炎症因子生成,我们在MEG-01 细胞上过表达CFTR cDNA(Ad-CFTR)的腺病毒。应用构建的腺病毒介导的CFTR cDNA 感染MEG-01细胞后,在荧光显微镜下观察,发现与Ad-CFTR 组相比,CFTR 过表达病毒感染之后荧光显著增强,CFTR蛋白表达显著增加,Ad-CFTR 组CFTR 表达量为Vector 组的约183%,表明CFTR 过表达后MEG-01 细胞CFTR 蛋白表达显著增加(图3 A,F=94.44,P<0.000 1)。CFTR cDNA 过表达后,可显著降低LPS 诱导的TLR4 蛋白表达升高(P<0.01),单独应用CFTR 过表达病毒则对TLR4 蛋白表达并无显著影响(图3 C,F=122.1,P<0.000 1)。
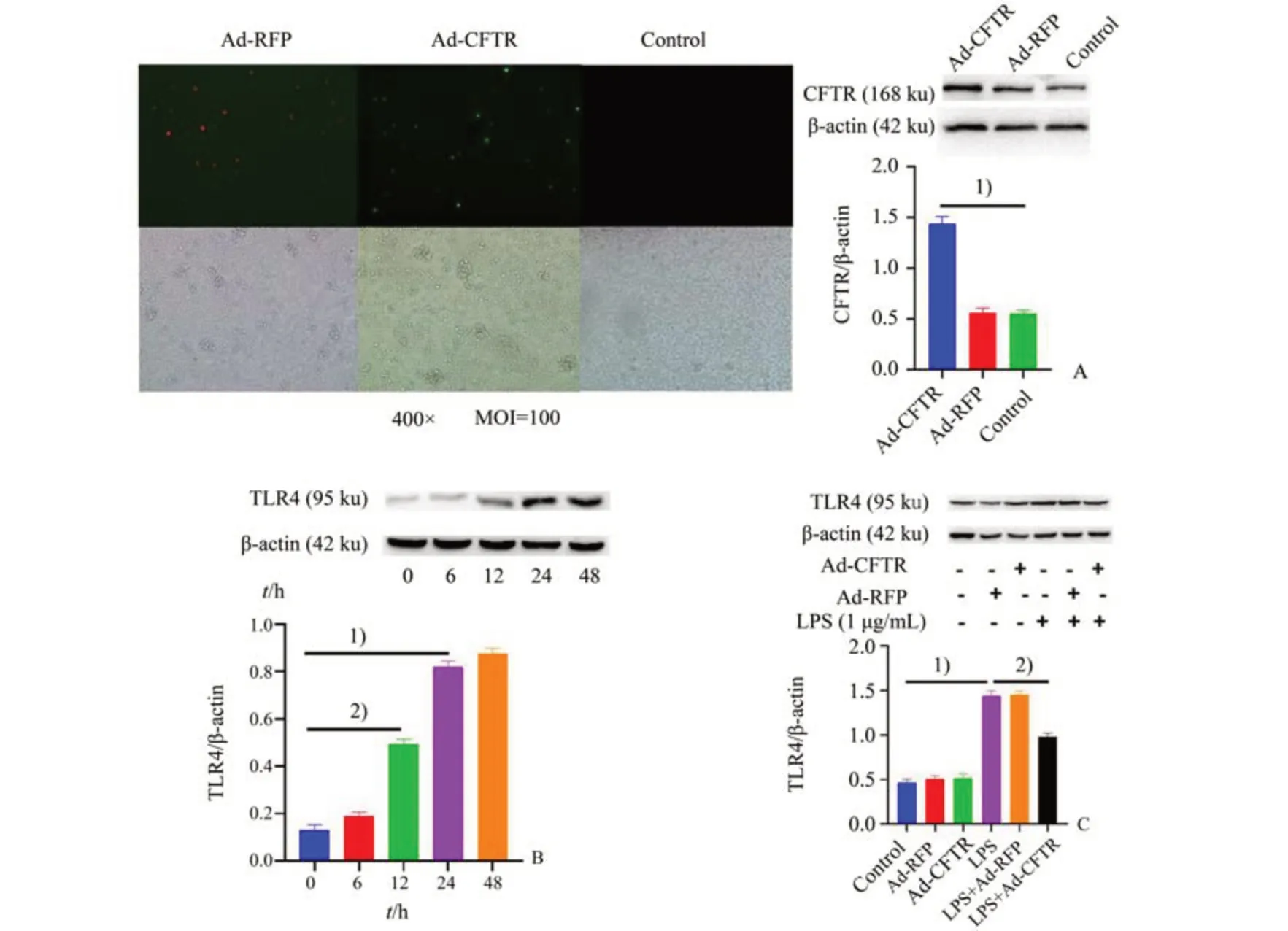
图3 腺病毒介导CFTR过表达抑制LPS诱导的MEG-01细胞上TLR4表达升高Fig.3 LPS-induced increase of TLR4 protein expression in MEG-01 cells inhibited by Ad-CFTR
2.4 VX661 抑制LPS 诱导的MEG-01 细胞和小鼠血小板炎症因子mRNA表达升高
已报道HEK-293 细胞给予CFTR 特异性矫正剂VX-661(5µmol/L)后,可促进胞内CFTR 蛋白转运至细胞膜上。VX-661 不仅上调CF 突变体细胞膜CFTR氯通道的功能,也可在非CF细胞上促进细胞膜CFTR 氯通道的功能。我们在LPS 诱导的MEG-01 细胞上预先孵育CFTR 特异性矫正剂VX-661 以上调CFTR 氯通道功能,再采用实时定量PCR 测定VX661 对LPS 诱导的炎症因子表达的影响[13-14]。如图4所示,LPS可诱导促炎因子IL-1β(F=226.4,P<0.000 1),CRP(F=63.77,P<0.000 1),TNF-α(F=278,P<0.000 1),IL-6(F=105.4,P<0.0001)表达增加(P<0.001),而减少抗炎因子IL-10(F=71.56,P<0.000 1)的表达(P<0.001),预先孵育VX661 可显著逆转之(P<0.01)。我们继而在LPS 诱导的小鼠内毒素血症模型上重复了该实验,得出了相似的结果。如图5 所示,预先孵育VX-661可显著逆转LPS诱发的小鼠外周血小板上促炎因子IL-1β(F=435.5,P<0.000 1),CRP(F=88.9,P<0.000 1),TNF-α(F=817.1,P<0.000 1),IL-6(F=252.4,P<0.000 1)表达增加,而增加抗炎因子IL-10(F=96.92,P<0.000 1)的表达(P<0.01)。
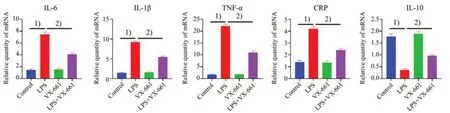
图4 VX-661抑制LPS诱导的MEG-01细胞炎症因子mRNA表达水平Fig.4 LPS-induced mRNA expression of pro-inflammatory cytokines in MEG-01 cells inhibited by VX-661
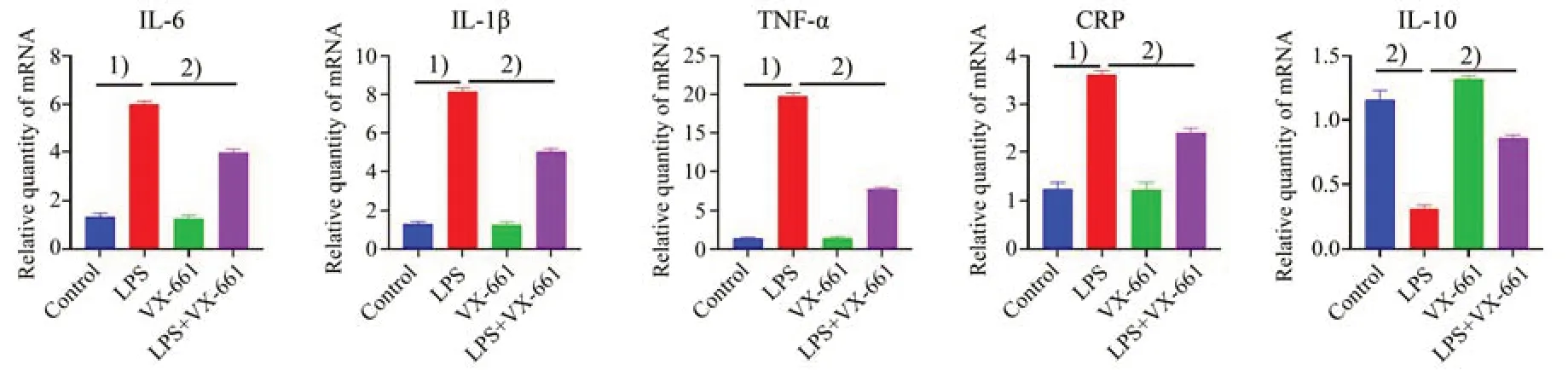
图5 VX-661抑制LPS诱导的小鼠血小板炎症因子mRNA表达水平Fig.5 LPS-induced mRNA expression of pro-inflammatory cytokines in platelets from mice inhibited by VX-661
2.5 Ad-CFTR 对LPS 诱导的MEG-01 细胞上炎症因子mRNA表达的调节
我们在MEG-01细胞应用Ad-CFTR,观察过表达CFTR cDNA 对LPS 诱导的MEG-01 细胞炎症因子mRNA 表达的影响。如图6 所示,LPS 刺激引起MEG-01细胞促炎炎症因子包括IL-6、IL-1β、CRP、TNF-α表达增加,但降低抗炎症因子IL-10的表达;Ad-CFTR可显著下调促炎因子IL-6(F=372,P<0.000 1)、IL-1β(F=346.9,P<0.000 1)、CRP(F=493.2,P<0.000 1)、TNF-α(F=401.6,P<0.000 1)的水平(图6 A,B,C,D),而上调IL-10(F=135.9,P<0.000 1)的表达(图6 E)。
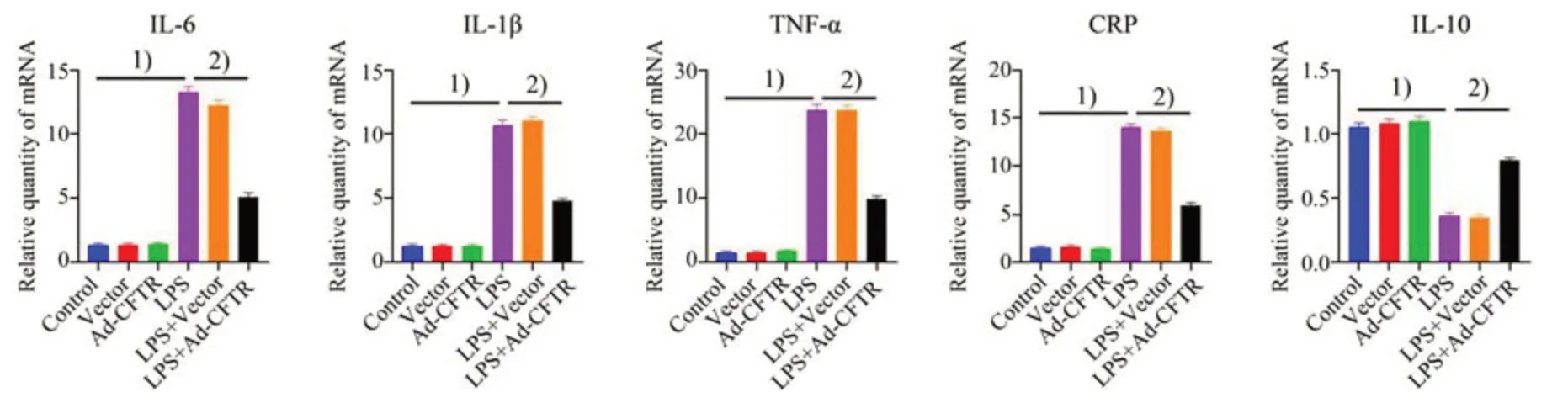
图6 CFTR过表达对LPS诱导的MEG-01细胞上炎症因子mRNA表达的调节Fig.6 LPS-induced mRNA expression of inflammatory cytokines in MEG-01 cells regulated by Ad-CFTR
3 讨论
研究表明:CFTR 是血小板活化的重要调控因子。本文应用Cftr-/-小鼠,发现CFTR 基因敲除加重了LPS 诱导的内毒素血症小鼠模型外周血血小板的显著激活、血小板数量减少和血小板介导的炎症因子生成。LPS 刺激可引起小鼠血小板TLR4 蛋白表达和促炎炎症因子mRNA水平升高,引起抗炎因子如IL-10表达的降低。这提示CFTR 可通过调控血小板TLR4 介导的炎症信号通路,从而影响血小板介导的炎症反应。我们继而应用LPS刺激MEG-01 人巨核细胞体外模型和腺病毒过表达CFTR cDNA 实验验证了上述发现,并进一步应用CFTR 矫正剂VX661 发现上调CFTR 氯通道功能可通过降低TLR4 表达,从而有效地抑制血小板促炎因子mRNA水平。
血小板活化是血小板介导的免疫炎症早期关键环节,在内毒素血症、动脉粥样硬化、糖尿病和肿瘤的病理生理过程中均已确证。最近的研究[15-18]发现,应用血小板CFTR 基因特异性敲除小鼠制备LPS 诱导的肺损伤模型,CFTR 敲除可加重LPS 诱导的血小板活化[19-20],这与本研究的实验结果是一致的。LPS 刺激后血小板膜表面P-selectin 表达增加,P-selectin 可与淋巴细胞和单核细胞上P-selectin 的配体P-选择素糖蛋白配体1(P-selectin glycoprotein ligand 1,PSGL-1)相结合,从而形成血小板-单核细胞聚集体或者是血小板-淋巴细胞聚集体,这是血小板介导炎症因子生成过程中的重要环节。最近多项研究已证实CFTR 可通过调控中性粒细胞凋亡、中性粒细胞胞外捕获网形成以及促炎症的因子释放而参与炎症过程[13-14]。MEG-01细胞过表达CFTR 显著抑制LPS诱导的促炎症因子生成。这些研究结果表明:CFTR 可直接通过调控血小板活化影响血小板介导的炎症因子生成,进而调控内毒素血症的炎症反应。
我们应用腺病毒过表达CFTR 的研究发现,过表达CFTR 可显著抑制LPS 诱导的MEG-01 细胞TLR4 蛋白表达。TLR4 是LPS 的内源性配体,两者结合触发了TLR4 介导的免疫炎症反应。研究报道,LPS 诱导的血小板活化主要是通过激活TLR2或TLR4,进而活化下游的NF-κB炎症信号通路,并促进血小板炎性细胞因子如IL-1β 和sCD40L 等的释放,从而诱发和加重血小板炎症反应[16]。本研究在体和体外实验结果均表明CFTR 基因干预可能通过调控血小板TLR4 介导的炎症信号通路,进而影响血小板炎症因子生成,但CFTR如何调控TLR4的具体分子机制还需要进一步探讨。
由于CFTR 单基因突变是引起CF 临床症状的分子基础,自2012 年第一个治疗药物Kalydeco(ivacaftor)被FDA 批准上市,至今已有数种针对CFTR 基因突变的治疗药物在国外上市,包括本研究所应用的VX661(商品名:Tezacaftor)。这些药物可明显改善CF 患者的临床症状,使CF 患者的预期寿命明显延长,生活质量明显改善。CFTR 与炎症的密切关系在多种炎症细胞上已多有报道[21-22],但CFTR 在血小板介导炎症过程中的作用则少有研究。VX661 可促进细胞内正常的CFTR 氯通道向细胞膜的转运,从而增强跨细胞膜CFTR 氯通道介导的氯离子转运[7,9]。我们发现VX661 可显著改善MEG-01 细胞和LPS 诱导的小鼠血小板炎症因子mRNA 的表达,如降低LPS 诱导的血小板活化、TLR4 表达增加和血小板促炎症因子mRNA 表达。腺病毒过表达CFTR 的实验结果进一步提供了细胞特异性和基因特异性的证据。我们的研究结果提示:血小板CFTR 氯通道有可能是一个新的、潜在的治疗内毒素血症血小板介导的炎症因子生成的治疗靶点。这也为未来应用更多感染疾病的动物模型以深入研究血小板CFTR 氯通道在免疫和炎症反应中的作用指出了方向。
综上所述,本研究揭示了CFTR可通过调控血小板活化和血小板TLR4表达,从而调控LPS诱导的内毒素血症过程中血小板介导的促炎症因子生成。本研究提示CFTR可能是一个新的、潜在的干预内毒素血症血小板功能及其介导的炎症因子生成的靶点。
