猪表皮生长因子的原核表达及纯化
2022-06-02汤慧唐青海薛姣雄吴广艳马洁赵婷芳唐斯萍
刘 庭,汤慧,唐青海,刘 莎,薛姣雄,吴广艳,马洁,赵婷芳,唐斯萍
(衡阳师范学院生命科学与环境学院南岳山区生物资源保护与利用湖南省重点实验室动物微生物新型检测技术及生物制剂衡阳市重点实验室,湖南 衡阳 421008)
1 引言
研究的重要意义:猪表皮生长因子(porcine epidermal growth factor,pEGF)有利于猪的早期胚胎发育[1]、能提高母猪的窝产仔数[2]、提高仔猪成活率[3-4]以及促进断奶仔猪的生长[5],同时pEGF可作为添加剂增加仔猪断奶早期细胞对必须微量元素的吸收[6]、能改善断奶仔猪生长性能和缓解腹泻[7],这在兽医临床研究以及养猪业具有十分广阔的应用前景。
前人研究进展:表皮生长因子(epidermal growth factor,EGF)由Stanley Cohen在1962年从小鼠下颌腺中分离提纯出的一种单链多肽类活性物质[8],经众多学者努力,发现其家族包括EGF和类EGF因子,它们具有高度相似的结构和功能[9],分子量为6 kDa,含有53个氨基酸残基,分子内含有3个二硫键[10],其活性中心位于第48~53个氨基酸残基之间。孙卫国等发现表皮生长因子普遍存在于人、犬和猪等动物体内[11-13],EGF是动物乳中含量最丰富的生长因子之一,在体外和体内均能刺激表皮细胞增殖和角质化[14],同时也是一种强有力的细胞有丝分裂原[15],具有刺激细胞分裂增殖与分化,促进离子交换和细胞外基质合成等生物学特性[1],槐玉英等发现猪表皮生长因子(porcine epidermal growth factor,pEGF)是卵巢和子宫局部重要的调节因子,对猪的繁殖性能有一定的影响[5,16]。
研究切入点:人工合成、克隆并表达pEGF基因,构建原核表达菌株,优化表达条件,通过GSTTag亲和层析纯化方法提高pEGF的纯度。
本研究拟解决的关键问题:提高蛋白表达量,摸索效果良好的表达条件及纯化工艺。
2 材料与方法
2.1 实验材料
原核表达载体pGEX4T-1均购自美国Novagen公司,细菌蛋白抽提试剂盒购自康为世纪生物科技有限公司,重组质粒PMD18-T Vector-pEGF、IPTG、内切酶(BamHI、ECoRI)、考马斯亮蓝R250和氨苄霉素均购自TaKaRa公司,质粒提取试剂盒购自Axygen公司,GST-Tag-Mouse MAb和Goat anti-Mouse-IgG均购自武汉三鹰生物技术有限公司,DAB显色试剂盒购自Solarbio公司,GST标签蛋白纯化试剂盒购自碧云天生物技术有限公司。
2.2 方法
2.2.1 重组质粒pGEX-pEGF的构建
(1)人工合成pEGF,串联顺序如下:pEGF全长基因为159bp,编码53aa,蛋白分子量6 kDa,序列如下:
AATAGTTACTCTGAATGCCCGCCGTCCCACG ACGGGTACTGCCTCCACGGTGGTGTGTGTATGTAT ATTGAAGCCGTCGACAGCTATGCCTGCAACTGTG TTTTTGGCTACGTTGGCGAGCGATGTCAGCACAG AGACTTGAAATGGTGGGAGCTGCGC
以上序列由TaKaRa公司合成,载体为pGEX4T-1,采取GST-pEGF融合表达,酶切位点:BamHI+pEGF+EcoRI。
(2)对pMD18-TVector-pEGF菌株提取质粒后进行双酶切,对目的基因部分进行切胶回收,得到目的基因pEGF片段。将原核表达载体pGEX4T-1溶液、目的基因DNA溶液和连接液混合均匀,质粒载体pGEX4T-1与pEGF基因进行联结,得到重组质粒pGEX-pEGF,将其转化到TOP10感受态细胞中,然后提取质粒进行核酸电泳鉴定,结果呈现阳性表示pGEX-pEGF构建成功,便将提取出的重组质粒转化到Rosseta(DE3)感受态细胞中进行表达,筛选得到Rossetta(DE3)-pGEX-pEGF的阳性菌株。
2.2.2 重组表达菌株Rossetta(DE3)-pGEX-pEGF的诱导表达与SDS-PAGE电泳检测
分别对Rossetta(DE3)-pGEX-pEGF和pGEX4T-1空载的转化菌液Rosseta(DE3)进行诱导培养,均按照1∶500的比例将菌液分别接种于两瓶含有Amp(终浓度为200μg/mL)的4mL LB液体培养基中,放入37℃的摇床,200r/min震荡培养16~18h,进行首次活化;按1∶4的接种比例接种,分别将首次活化后的1mL菌液接种于4mL含Amp(终浓度为200μg/mL)的LB液体培养基中,放入37℃摇床,200 r/min震荡培养2.5h,进行二次活化;其后加入终浓度为1 mmol/L的IPTG,37℃,200 r/min诱导4h,收集菌体,分别用100μL PBS悬起,离心20min,包涵体用100μL包涵体溶解液悬起,进行SDSPAGE电泳。分别对Rossetta(DE3)-pGEX-pEGF和pGEX4T-1空载的转化菌液Rosseta(DE3)进行未诱导培养,首次活化和二次活化均同上,其后不加入IPTG,但同样放入37℃摇床,200r/min震荡培养4h,其余操作均同上。
2.2.3 重组表达菌株Rosseta(DE3)-pGEX-pEGF的诱导表达条件的优化
(1)最佳诱导剂浓度试验:将重组表达菌株Rossetta(DE3)-pGEX-pEGF进行诱导表达,每管分别加入终浓度为1mmol/L、0.1mmol/L、0.01mmol/L的诱导剂IPTG,15℃诱导培养16h。收集菌液,提取蛋白进行SDS-PAGE凝胶电泳检测,SDS-PAGE检测对比不明显时,利用Western Blot技术进行鉴定,对其含量做一个初步判断。取样品进行Western Blot鉴定,在转膜仪中转膜,取下PVDF膜,用2%雀巢脱脂奶粉-PBS封闭,用PBST洗涤;再用2%雀巢脱脂奶粉-PBS将GST-Tag-Mouse mAb按照1:3000稀释,进行一抗孵育;在同样的条件下用PBST洗涤;用2%雀巢脱脂奶粉-PBS将Goat anti-Mouse-IgG进行1:5000稀释,进行二抗孵育;用PBST洗涤。配制显色液,弃去PBST溶液,用DBA显色液显色,记录显色结果。
(2)最佳诱导温度和时间试验:将重组表达菌株Rossetta(DE3)-pGEX-pEGF在5℃、10℃、15℃条件下分别诱导培养24h、48h、72h、96h,收集菌液,提取蛋白进行SDS-PAGE凝胶电泳检测。
2.2.4 重组表达菌株Rossetta(DE3)-pGEXpEGF的诱导表达以及蛋白纯化
(1)对重组表达菌株Rossetta(DE3)-pGEXpEGF进行大量表达,首次活化将50μL的菌株接种到50mLLB液体培养基中,二次活化将首次活化后的菌液全部转移至200 mL新鲜LB液体培养基,活化后的菌液按照最优诱导表达条件即加入IPTG至终浓度为0.01 mmol/L,于15℃条件下诱导培养24h。收集菌体。
(2)蛋白纯化
①按GST标签蛋白纯化试剂盒说明书步骤进行试验:在细菌沉淀中加入裂解缓冲液,充分重悬菌体。加入溶菌酶混匀,冰水浴或冰上放置30min。超声裂解细菌,严格控制温度在4℃以下,离心收集细菌裂解液上清并置于冰水浴或冰上,取20μL上清留作检测。取混合均匀的BeyoGoldTMGST-tag Purification Resin,4℃离心弃去储存液,向凝胶中加入裂解缓冲液以重悬并平衡凝胶,4℃离心弃液体,重复平衡2~3次即可,加入细菌裂解液上清混匀,置于4℃摇床进行缓慢震荡。将裂解液和BeyoGoldTMGST-tag Purification Resin的混合物装入亲和层析柱空柱管中。将纯化柱底部的盖子打开,使柱内液体流出,重复上柱3~5次,收集20μL流穿液留作检测。洗柱5次,每次加入0.5~1 mL裂解缓冲液,每次收集20μL洗涤液留作检测。洗脱目的蛋白6次,每次用0.5 mL洗脱缓冲液,收集的洗脱液即为纯化的GST标签目的蛋白样品。
②超声条件优化:方案一:超声功率300W,每次超5s,停5s,合计45min,严格控制温度4℃以下;方案二:超声功率300W,每次超5s,间隔10s,合计30min,严格控制温度4℃以下。
2.2.5 纯化蛋白浓度测定
取5μL不同浓度蛋白标准加到96孔板的蛋白标准孔中,E1、E2、E3、E4各取5μL样品到96孔板的样品孔中,在各孔加入250μL G250染色液,用酶标仪测定A595或A560~A610之间的其波长的吸光度,2小时内测定,根据标准曲线和使用的样品体积计算出样品中的蛋白浓度。
3 结果
3.1 重组质粒pGEX-pEGF的构建
图1显示四组克隆均出现了两条清晰的显色条带,大小为250bp的条带代表的是目的基因pEGF片段,上面的那一条带代表的是载体pMD18-Tvector的片段,目的载体和目的基因均回收成功。图2的双酶切结果全为阳性,表明重组质粒pGEX-pEGF已成功转入克隆菌株TOP10中,重组质粒pGEX-pEGF也已成功转化到感受态细胞Rossetta(DE3)中。
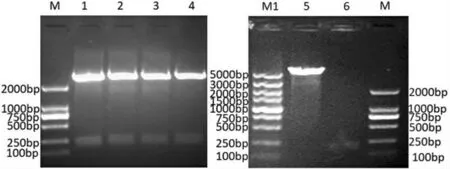
图1 p MD18-T Vector-p EGF质粒、pGEX载体、pEGF目的片段双酶切回收鉴定

图2 pGEX-pEGF重组质粒双酶切及p GEX-pEGF单酶切结果
3.2 重组表达菌株Rossetta(DE3)-pGEX-pEGF的诱导表达与SDS-PAGE电泳检测
将pGEX-pEGF重组质粒、pGEX空载体进行诱导表达以及对pGEX-pEGF重组质粒、pGEX空载体进行未诱导表达,形成对照,由图3可知,在26-34kDa处有较明显条带,重组质粒pGEX-pEGF的诱导表达大部分在沉淀即包涵体中,未诱导表达的在26kDa处有条带,经比对可知,此处是GST标签蛋白条带,上清中表达量较多。空载体的诱导表达与未诱导表达均未有其他明显条带。这表明pEGF基因诱导表达成功。
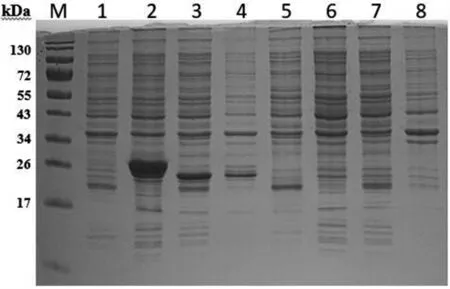
图3 pGEX-pEGF重组质粒、pGEX空载诱导表达及未诱导表达SDS-PAGE电泳结果
3.3 重组表达菌株Rossetta(DE3)-pGEX-pEGF的诱导表达条件的优化
对诱导剂IPTG终浓度三个梯度的诱导表达结果进行SDS-PAGE检测,图4显示目的蛋白在包涵体中含量较多,且三个梯度的目的蛋白表达量并无明显区别,而Western Blot鉴定显示部分蛋白溶解在上清中,诱导剂IPTG终浓度为0.01 mmol/L诱导表达的上清目的蛋白含量较另外两组多,其包涵体的目的蛋白含量较另外两组多,为了目的蛋白能在上清中表达更多,诱导剂IPTG的最佳终浓度为0.01 mmol/L。图5显示,5℃诱导培养24h、48h、72h和96h相比较,培养24h后的包涵体中目的蛋白较多,培养48h、72h和96h后的上清和包涵体中的目的蛋白含量均无明显差别,因此5℃诱导表达最适培养时间是48h。10℃诱导培养24h与培养48h、72h和96h相比,培养24h包涵体的目的蛋白较多,培养48h、72h和96h后的上清和沉淀中的目的蛋白含量无明显差别,因此10℃诱导表达最适培养时间是48h。15℃培养24h与培养48h、72h和96h相比,上清和沉淀中的目的蛋白含量均无明显差别,由此15℃诱导表达最适培养时间是24h。经比较可得15℃诱导培养24h的上清包含的目的蛋白较多,且沉淀包含的目的蛋白较少,因此诱导表达的最佳温度和时间分别是15℃和24h。

图4 Rossetta(DE3)-p GEX-pEGF蛋白SDS-PAGE电泳和Western Blot结果

图5 Rossetta(DE3)-pGEX-p EGF诱导表达条件优化结果
3.4 重组表达菌株Rossetta(DE3)-pGEX-pEGF诱导表达目的蛋白的纯化
由图6可知,超声45min(图中序号为①)的纯化失败,超声35min(图中序号为②)的纯化成功,超声45min强度较大,导致目的蛋白变性,即目的蛋白几乎全在流穿液和洗涤液里;反之超声30min的条件较为温和,能够较好洗脱出目的蛋白,即超声功率300W,每次超5s,间隔10s,合计30min,严格控制温度4℃以下的超声效果更好。SDS-PAGE检测显示后续洗脱液的条带在32kDa附近,表示目的蛋白纯化成功。流穿液和洗涤液中目的蛋白含量极少,洗脱液中,E5、E6目的蛋白含量极少,E1目的蛋白含量较少,E3和E4目的蛋白含量较多,E2目的蛋白含量最多。由此可以判断目的蛋白纯化成功并且纯化效果尚可。
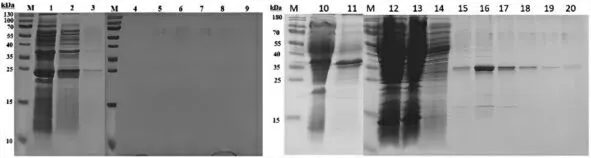
图6 p GEX-pEGF蛋白纯化结果
3.5 纯化蛋白浓度测定
由标准蛋白测定得出标准曲线,对纯化得到的蛋白进行测定得其吸光度,依次为0.610A、0.916A、0.832A、0.707A,将其分别带入标准曲线的公式y=0.6735x+0.5505(其中y为测得的样品吸光度,x为样品蛋白浓度)计算可得其浓度,依次为0.088mg/mL、0.542mg/mL、0.418mg/mL、0.232mg/mL。具 体结 果 见 表1。其 中E1、E2、E3、E4分 别 是pGEX-pEGF洗脱第1、第2、第3、第4次所得到的只含有目的蛋白的洗脱液。其中,E2目的蛋白浓度最高,为0.542mg/mL,E1目的蛋白浓度最低,为0.088mg/mL。该结果均与图6中②号纯化结果图显示的目的蛋白含量基本一致。
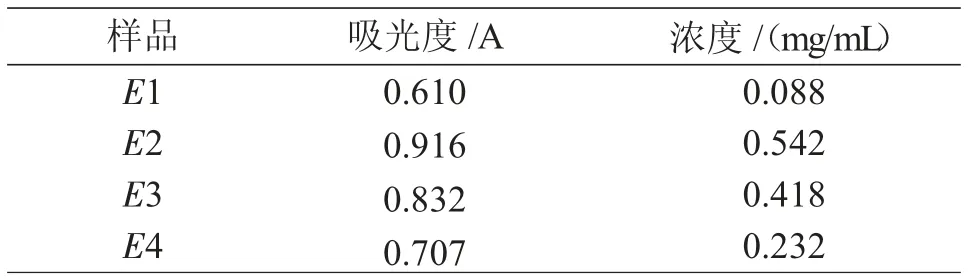
表1 纯化产物的浓度测定
4 讨论
猪表皮生长因子(pEGF)具有激发细胞分裂、增殖与分化,促进离子交换、物质转运、糖代谢和细胞外基质的合成的功能。此外,pEGF还通过促进断奶仔猪的生长,提高仔猪免疫力[17],其在养猪业的应用前景十分广阔。
为pEGF能在养猪业得到良好而稳定的应用,本研究对pEGF基因进行了构建、表达以及纯化。不同于枯草芽孢杆菌[18]和毕赤酵母[19],遗传背景清楚、易操作、生长繁殖速度快、可大量培养的大肠杆菌[20]更适合作为本研究的表达系统。本研究直接对人工合成的重组质粒PMD18-T Vector-pEGF进行双酶切,将核酸电泳回收的pEGF与质粒载体pGEX4T-1进行连接,得到重组质粒pGEX-pEGF,与史飞等大部分的研究不同的是pEGF基因没有进行PCR扩增,而是直接与原核表达载体进行连接得到重组质粒,避免了因PCR扩增引起的基因突变[21]。本研究采取GST-pEGF融合表达,由邱淑彬的研究可知,有His-Tag的表达系统,目的产物的表达量高不易纯化,有GST-Tag的表达系统,目的产物产量高易纯化,且GST-Tag能增加外源蛋白的可溶性,但是GST-Tag比较大,对后续的影响也会较大,可根据后续研究目的进行酶切试验[22]。诱导表达重组菌株Rossetta(DE3)-pGEX-pEGF并进行SDS-PAGE检测可知基因pEGF诱导表达成功,但发现产物中目的蛋白主要以包涵体的形式存在,可溶性表达产物含量极低,胞内可溶性蛋白的表达量与诱导条件有关[23]。为了提高目的蛋白的可溶性表达,减少在包涵体中的表达,对其进行表达条件优化,分别进行了诱导剂IPTG浓度、诱导温度和诱导时间的诱导条件优化。且纯化试剂盒只能用于纯化可溶性蛋白,因此,要做到诱导表达后上清中目的蛋白含量尽量多。最终探索出最佳诱导表达条件为IPTG终浓度0.01 mmol/L、诱导温度15℃和诱导时间24h。表达产物中杂蛋白极多,需对其进行纯化,但GST标签蛋白纯化试剂盒对蛋白的活性要求极高,对于菌体冰上超声的温度和破碎的时间需严格控制,超声时菌体温度过高或超声时间过长都会导致蛋白变性而无法与凝胶结合。超声方案一的超声时间过长且条件剧烈,易导致蛋白变性,相比之下方案二的超声条件温和,能较好地纯化出目的蛋白,蛋白纯化后进行的SDS-PAGE电泳检测和蛋白浓度的定量检测均显示出E2目的蛋白含量最高,E3次之。史飞等对收集的菌体进行进行超声破碎的参数设置为:功率1200W、超5秒停9秒、共90次[21],超声条件无温度要求,无法判断是否对纯化后蛋白的活性有要求,相较而言本研究的超声条件更为温和,更能保证后续纯化目的蛋白的活性。王强等的研究没有进行表达条件优化获得更多的目的蛋白,目的蛋白以包涵体形式存在,用Ni亲和层析柱进行纯化,此种方式纯化的目的蛋白需要复性[24],操作较为繁杂。而本研究进行了表达条件优化,提高可溶性目的蛋白的表达量,采用GST标签蛋白纯化试剂盒进行纯化,纯化所得的目的蛋白具活性,不需要进行复性,操作上更为简便。但是这两种纯化方法的成本都偏高,不利于大规模生产,应当再摸索成本低效果好的纯化方法,为pEGF在养猪业的应用上提供技术支持。
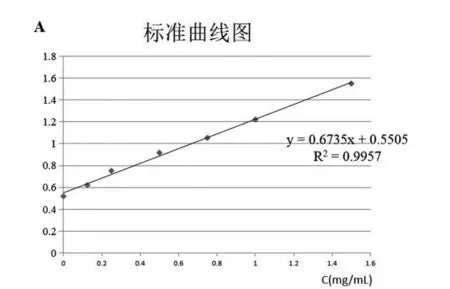
图7 蛋白标准曲线
本研究对表达条件及超声条件进行了优化,最大程度地提高了pEGF的表达量,摸索出了良好的纯化工艺,纯化所得蛋白最高纯度为0.542mg/mL,但纯化量较小且成本高,后续应摸索低成本纯化量大的批量纯化方法,推进pEGF蛋白的工业生产以及在养殖业中的应用。
5 结论
本研究人工合成、克隆及表达了pEGF基因,通过GST-tag亲和层析纯化方法提高了pEGF的纯度,为pEGF的后续研究、开发以及应用提供了依据。 □
