赣南早’脐橙在干旱胁迫下的生理及转录组研究
2022-06-02刘林芝欧阳欢李兴涛陈健美
刘林芝 欧阳欢 李兴涛 陈健美


‘
摘 要:我國脐橙产区的季节性干旱对脐橙产量和品质影响较大。‘赣南早脐橙作为一个新品种脐橙,目前在我国脐橙产区已大面积推广。为深入了解这个新品种的耐旱性,探究早熟品种‘赣南早脐橙应对干旱胁迫的调控机制,以‘赣南早脐橙与‘纽荷尔脐橙(对照)为材料,测定比较不同干旱胁迫程度下二者光合作用、干旱相关生理指标等差异,并通过RNA-Seq分析比较转录水平差异及抗氧化物酶基因表达调控。结果表明:干旱胁迫下‘赣南早脐橙净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)均显著高于‘纽荷尔脐橙;随着干旱胁迫程度增加,‘赣南早脐橙叶片较‘纽荷尔脐橙更舒展,‘赣南早脐橙相对电导率和丙二醛含量显著低于‘纽荷尔脐橙,而保护酶超氧化物歧化酶(SOD)和过氧化物歧化酶(POD)活性变化幅度更大;‘赣南早脐橙和‘纽荷尔脐橙叶片可溶性糖含量无显著性差异,复水后,‘纽荷尔脐橙叶片中可溶性糖含量极显著高于‘赣南早脐橙。转录组测序分析表明,干旱胁迫0、10、20 d时,‘赣南早脐橙和‘纽荷尔脐橙间DEGs数量分别为1266、683、658个。GO富集分析显示,在干旱胁迫过程中‘赣南早脐橙差异基因主要集中在细胞蛋白修饰过程、高分子修饰作用、含磷化合物代谢过程、蛋白修饰过程等通路,而‘纽荷尔脐橙未见明显富集。KEGG富集分析显示,除了富集于淀粉及蔗糖通路和氨基酸及核苷酸糖代谢途径,‘赣南早脐橙其他差异基因富集途径与‘纽荷尔脐橙基本一致。差异基因转录因子分析显示二者在ERF家族、MYB家族、NAC家族、MYB_related家族、WRKY家族、bHLH家族、HB-other家族、HSF家族、B3家族和bZIP家族均有分布,此外,‘赣南早脐橙特异分布于GRAS家族。根据转录组分析筛选出抗氧化酶相关基因30个,其中上调表达48%,下调表达52%。本研究结果为‘赣南早响应干旱胁迫的生理变化提供理论依据,并为其抗旱性研究提供分子基础。
关键词:脐橙;干旱胁迫;光合作用;酶活性;丙二醛;转录组分析中图分类号:S666.4 文献标识码:A
Physiological and Transcriptome Analysis of ‘Gannan Zao Navel Orange under Drought Stress
Abstract: The seasonal drought in the navel orange producing areas in China has a great impact on the yield and quality of navel orange. ‘Gannan zao navel orange, a new variety, is widely popularized in navel orange producing areas in China. In order to deeply understand the drought tolerance of ‘Gannan zao and explore its regulation mechanism on drought stress, the differences of photosynthesis and drought related physiological indexes between ‘Gannan zao and ‘Newhall under different drought stress were measured, and the transcriptional differences and the regulation of antioxidant enzyme gene expression were compared by RNA-seq analysis. The results showed that the net photosynthetic rate (Pn), stomatal conductance (Gs) and transpiration rate (Tr) of ‘Gannan zao were significantly higher than those of ‘Newhall under drought stress. With the increase of drought stress, the leaves of ‘Gannan zao were more stretched than that of ‘Newhall, and the relative conductivity and malondialdehyde content of ‘Gannan zao were significantly lower than that of ‘Newhall, while the activities of protective enzymes superoxide dismutase and peroxide dismutase changed more. There was no significant difference in soluble sugar content between ‘Gannan zao and ‘Newhall. After rehydration, the soluble sugar content of ‘Newhall was significantly higher than that of ‘Gannan zao . Transcriptome sequencing analysis showed that the number of DEGs between ‘Gannan Zao and ‘Newhall was 1266, 683 and 658 respectively at 0, 10 and 20 days of drought stress. Go enrichment analysis showed that the differential genes of ‘Gannan zao were mainly concentrated in the process of cell protein modification, protein modification, polymer modification and phosphorus compound metabolism, while ‘Newhall was not significantly enriched. KEGG enrichment analysis showed that the differential gene concentration pathways of ‘Gannan Zao and ‘Newhall were basically the same, while ‘Gannan zao was also enriched in starch and sucrose pathway and amino acid and nucleotide sugar metabolism pathway. ‘Gannan zao was also enriched in starch and sucrose pathway and amino acid and nucleotide sugar metabolism pathway. Both transcription factors were in ERF family, MYB family, NAC family, MYB_Related family, WRKY family, bHLH family, HB-other family, HSF family, B3 family and bZIP family were distributed. In addition, ‘Gannan zao was specifically distributed in GRAS family. According to the transcriptome molecular results, 30 antioxidant enzyme related genes were screened, of which 48% were up-regulated and 52% were down regulated. The results of this study would provide a theoretical basis for the physiological changes of gannanzao in response to drought stress, and provide a molecular basis for the study of its drought resistance.9A12BED8-D238-43C5-A21B-7259BF963ED4
Keywords: navel orange; drought stress; photosynthesis; enzymatic activity; malondialdehyde; transcriptome analysis
DOI: 10.3969/j.issn.1000-2561.2022.05.003
柑橘(Citrus L.)是芸香科、柑橘属植物,是世界上种植面积和产量最大的水果。我国是柑橘的主要原产国之一,正逐渐向区域化、商品化、良种化、专业化、集约化等方向发展[1]。以赣南脐橙为主的江西优势柑橘产业带,季节性干旱频率较高,危害严重,引起柑橘产量和品质下降,是柑橘生产上亟待解决的问题之一[2]。水分是柑橘生长过程中的必要条件[3]。当植物体处于干旱胁迫环境条件下时,可以通过气孔关闭减少水分蒸发,调节可溶性糖含量,以保证植株正常代谢,抵抗逆境带来的危害[4]。随着干旱胁迫程度增加,植物细胞膜过氧化程度增加,丙二醛(malonaldehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化物歧化酶(peroxidase, POD)等保护酶可以反应植物对干旱胁迫的耐受程度[5]。不同的植物其生理物质的活性和含量在干旱胁迫条件下存在差异,有关‘赣南早脐橙在此方面的研究尚未见报道。‘赣南早脐橙(‘Gannan Zaonavel orange, GNZ)是从‘纽荷尔脐橙(‘Newhallnavel orange, NHE)中选育的芽变品种,有其独特的品质,具有转色快、糖积累快、低酸等特性[6],比目前主栽品种‘纽荷尔脐橙早熟30 d以上[7],‘赣南早脐橙是脐橙主产区用于品种结构调整的一个优良早熟品种,在脐橙产区种植面积已超6666.67 hm2。本研究以‘赣南早脐橙与其对照‘纽荷尔脐橙为材料,研究二者在干旱胁迫下的主要生理指标响应差异,并进一步分析其抗旱能力及基因表达差异。本研究有助于深入了解‘赣南早脐橙抗旱性,为新品种‘赣南早脐橙的栽培技术与大面积推广提供参考,同时为柑橘抗旱遗传改良提供重要的基因资源。
1 材料与方法
1.1 材料
1.1.1 植物材料 自然干旱试验材料‘赣南早(Gannan Zao, GNZ)脐橙和‘纽荷尔(Newhall, NHE)脐橙种植于江西省赣州市信丰县正平镇‘赣南早脐橙基地,为4年生枳壳砧脐橙树,同排种植,每个品种各选3株。盆栽控水干旱试验材料来自赣南师范大学国家脐橙工程技术研究中心柑橘种质资源圃,是‘赣南早脐橙和‘纽荷尔脐橙枳壳砧一年半生苗,每个品种各20株苗。对自然干旱材料进行光合指标测定,生理及转录组分析材料均取自盆栽控水干旱试验材料,生理指标测定材料于干旱处理0、5、10、15、20 d和复水5 d(F5)时取‘赣南早和‘纽荷尔脐橙成熟枝条叶片,转录组测序分析材料取干旱处理0、10、20 d的叶片。样品液氮速冻后,迅速带回实验室–80℃保存备用,以上取样均设置3次生物学重复。
1.1.2 干旱处理 自然干旱处理为2019年9—11月田间自然干旱60 d进行光合指标测定,期间赣南地区连续无超10 mm降水且试验用树未人工施水,复水5 d后再次测定。盆栽控水干旱处理材料生长环境一致(盆高38 cm,直径25 cm,基质为园土∶甜叶菊渣∶沙土=1∶1∶1),正常管理6个月后,在处理前正常浇水3 d,最后一次浇透水后进行控水处理,分别处理0、5、10、15、20 d,干旱处理20 d后复水5 d,并拍照记录叶片形态。
1.2 方法
1.2.1 生理指标测定 光合作用参数净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)使用Li-6400XT便携式光合仪测定,设定空气流速为500 mol/s,CO2浓度400 μmol/mol。相对电导率、丙二醛及叶片可溶性糖含量测定操作参考《植物生理学实验指导》[8],用电导率仪(雷磁DDS-307,上海)测定相对电导率值。分别用硫代巴比妥酸法、蒽酮比色法检测并计算丙二醛和可溶性糖含量[9],超氧化物歧化酶、过氧化物酶活性测定[9]采用氮蓝四唑法和愈创木酚法。
1.2.2 转录组测序 由美吉生物科技有限公司(上海,中国)对‘赣南早脐橙和‘纽荷尔脐橙干旱处理0、10、20 d叶片,共18个样品进行转录组分析,以甜橙基因组为参考基因组进行序列比对分析。参考基因组来源:Citrus_sinensis, http://citrus.hzau.edu.cn/orange/download/index.php,參考基因组版本:hzau。Illumina平台通过将测序图像信号经CASAVA碱基识别(base calling)转换成文字信号,并将其以fastq格式储存起来作为原始数据。根据index序列区分各个样本的数据,以便进行后续分析。原始数据已上传NCBI数据库,SubmissionID:SUB10857158,BioProjectID: PRJNA792482。9A12BED8-D238-43C5-A21B-7259BF963ED4
1.2.3 转录数据质量控制 为保证后续分析的准确性,使用SeqPrep和Sickle软件处理原始数据,去除reads中的接头序列,将序列末端(3'端)低质量(质量值小于20)的碱基修剪掉,如剩余序列中仍然有质量值小于10的碱基,则将整条序列剔除,去除含N(模块碱基)的reads,舍弃去adapter及质量修剪后长度小于30 bp的序列,并对质控后的数据进行质量评估。
1.2.4 转录数据分析 利用表达定量软件RSEM分别对转录本的表达水平进行定量分析,差异基因表达量及筛选,使用DESeq2软件对样本进行分析,参数:P-adjust<0.05 & |log2FC|≥1。采用软件Goatools对DEGs进行GO富集分析,Fisher精确检验,用Bonferroni方法对P值进行校正,P值(FDR)<0.05。采用R脚本对差异基因进行KEGG PATHWAY富集分析,Fisher精确检验,P值(correctedP-value)以0.05为阈值,满足此条件的KEGG通路定义为在基因集中显著富集的KEGG通路。采用PlantTFDB 4.0(http://planttfdb. cbi.pku.edu.cn/)对差异基因进行转录因子分析。
1.3 数据处理
利用Microsoft Excel 2007软件对实验数据进行整理、分析和作图,并用SPSS Statistical 23.0软件分析差异显著性。
2 结果与分析
2.1 自然干旱脅迫下‘赣南早和‘纽荷尔脐橙叶片形态及光合指标差异
叶片卷曲程度是植物受干旱胁迫最直观的表现,从表型观察来看(图1),干旱胁迫15 d时,‘纽荷尔脐橙叶片已出现卷曲,但‘赣南早脐橙叶片仍舒展,在干旱胁迫20 d时,‘赣南早脐橙叶片出现轻微卷曲,‘纽荷尔脐橙叶片卷曲程度更加严重,复水后叶片均恢复舒展。
在自然干旱60 d时测定田间‘赣南早脐橙和‘纽荷尔脐橙叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),与复水后光合作用参数,结果表明,自然干旱下‘赣南早脐橙的Gs和Tr值极显著高于‘纽荷尔脐橙,Pn显著高于‘纽荷尔脐橙。复水后,‘赣南早脐橙的Pn值极显著高于‘纽荷尔脐橙,‘赣南早脐橙的Tr值显著高于‘纽荷尔脐橙,而Gs、Ci值无显著性差异(表1)。
2.2 干旱胁迫下‘赣南早和‘纽荷尔脐橙叶片电导率、丙二醛及可溶性固形物含量
相对电导率、丙二醛含量等可判断柑橘干旱胁迫下细胞膜受损伤程度。结果表明,干旱处理前‘赣南早和‘纽荷尔脐橙叶片相对电导率差异不显著,干旱处理中二者相对电导率值均呈上升趋势,且在复水后下降(图2A)。在干旱胁迫10 d,‘纽荷尔的相对电导率显著高于‘赣南早脐橙,干旱胁迫15、20 d和复水5 d后极显著高于‘赣南早脐橙。
如图2B所示,干旱处理下,‘纽荷尔脐橙叶片丙二醛含量呈上升趋势,而‘赣南早脐橙在干旱胁迫5~10 d时呈下降趋势,后又迅速积累。干旱胁迫0、10、15 d时‘纽荷尔脐橙的丙二醛含量极显著高于‘赣南早脐橙,干旱胁迫5、20 d时‘赣南早脐橙丙二醛含量显著高于‘纽荷尔脐橙,复水后均下降。
可溶性糖含量检测结果表明(图2C),二者叶片可溶性糖含量在干旱胁迫0~5 d时呈下降趋势,且‘纽荷尔脐橙在干旱处理15 d时显著高于‘赣南早脐橙,二者在干旱胁迫15、20 d时含量均增加,复水后均下降,但‘纽荷尔脐橙叶片可溶性糖含量极显著高于‘赣南早脐橙。
2.3 干旱胁迫下‘赣南早和‘纽荷尔脐橙叶片保护酶活性
保护酶活性检测结果表明(图3A),在干旱处理中,‘赣南早和‘纽荷尔脐橙叶片SOD活性均呈先降后升趋势,‘赣南早叶片SOD活性在干旱处理5 d后呈上升趋势,而‘纽荷尔脐橙在10 d后呈上升趋势,且均在复水后下降。
如图3B所示,在干旱处理0 d时,‘纽荷尔脐橙叶片POD活性显著高于‘赣南早脐橙,0~10 d时POD活性均下降,10~20 d时POD活性均增强,且干旱处理10、15 d时‘赣南早脐橙叶片POD活性极显著高于‘纽荷尔脐橙,复水后,‘赣南早脐橙叶片POD活性仍增强,而‘纽荷尔脐橙叶片POD活性下降。
2.4 测序数据质量控制
对‘赣南早和‘纽荷尔脐橙在干旱胁迫0、10、20 d下的18个转录组样本进行测序(表2),共获得130.96 Gb clean reads,各样本过滤后碱基数均在6.12 Gb及以上,GC含量均在44.50%左右,较稳定,Q20≥97.71%,Q30>93.19%,错误率在0.025%左右,表明此测序结果及质控效果较好,可用于后续转录组分析。9A12BED8-D238-43C5-A21B-7259BF963ED4
2.5 干旱胁迫下‘赣南早脐橙和‘纽荷尔脐橙的差异表达基因
将干旱胁迫0、10、20 d的转录组测序数据进行分析(图4),在相同胁迫时间点进行比较,‘赣南早和‘纽荷尔脐橙间获得了大量差异表达基因(DEGs),分别为1266、683、658个,
其中上调基因数为350、231、410个,下调基因数为916、452、248个。以干旱胁迫0 d为对照,‘赣南早脐橙在胁迫10、20 d时差异基因数为3942、3304个,‘纽荷尔脐橙在胁迫10、20 d时分别有236、2041个差异表达基因。干旱胁迫10 d和20 d比较,‘赣南早脐橙鉴定出3752个差异表达基因,而‘纽荷尔脐橙差异基因为2108个,以上筛选出的差异基因均为下调表达更多。
2.6差异表达基因GO富集分析及KEGG富集分析
为阐明差异表达基因行使的基因功能,采用软件Goatools对差异基因进行GO富集分析,按P-adjust<0.05的条件选取top20的富集结果,干旱胁迫0 d和10 d差异基因对比分析发现,‘赣南早脐橙2组间的差异基因主要集中在细胞蛋白修饰过程(cellular protein modification process)、蛋白修饰过程(protein modification process)、高分子修饰作用(macromolecule modification)、含磷化合物代谢过程(phosphate-con taining compound metabolic process)、磷代谢过程(phosphorus metabolic process)和小分子代谢过程(small molecule metabolic process)(图5A),而‘纽荷尔脐橙未见明显富集。干旱胁迫0 d与20 d差异基因对比发现,‘赣南早和‘纽荷尔脐橙差异基因均集中于生物学过程(biological process)。此外,‘赣南早脐橙还特异性富集于氧化还原酶(oxidoreductase activity)、蛋白质丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)、磷酸化作用(phosphorylation)和氧己酸代谢过程(oxoacid metabolic process)等通路中(图5B、5C)。
采用R脚本对样本差异基因进行KEGG PATHWAY富集分析,功能分类及PATHWAY注释显示(图6),按P-adjust<0.05的条件选取top20的富集结果,干旱胁迫0 d和10 d差异基因对比分析发现,‘赣南早脐橙差异基因主要集中在植物MAPK信号通路(MAPK signaling pathway- plant)、植物激素信号转导(plant hormone signal transduction)和苯丙烷生物合成(phenylpropanoid biosynthesis)(图6A),而‘纽荷尔脐橙主要集中在苯丙烷生物合成、倍半萜和三萜生物合成(sesquiterpenoid and triterpenoid biosynthesis)和内质网蛋白加工(protein processing in endoplasmic reticulum)通路(图6C)。干旱胁迫0 d和20 d差异基因对比分析发现,‘赣南早脐橙还富集在
植物-病原相互作用(plant-pathogen interaction)通路中(图6B),而‘纽荷尔富集在光合作用(photosynthesis)、光合生物的固碳作用(carbon fixation in photosynthetic organisms)和糖酵解/糖异生(glycolysis/glucon eogenesis)途径(图6D)。此外,‘赣南早脐橙特异性富集于淀粉及蔗糖通路(starch and sucrose metabolism)和氨基酸及核苷酸糖代谢(amio sugar and nucleotide sugar metabolism)途径。
2.7转录因子分析及抗氧化保护酶相关基因的转录调控
植物响应干旱胁迫过程中,转录因子(transcription factor, TFs)发挥着重要的调控作用。本研究对4组比较组获得的差异基因进行了
转录因子分析,结果显示,‘赣南早脐橙和‘纽荷尔脐橙转录因子在ERF家族、MYB家族、NAC家族、MYB_related家族、WRKY家族、bHLH家族、HB-other家族、HSF家族、B3家族和bZIP家族均有分布。二者比较发现,‘纽荷尔脐橙特异性分布于LBD(AS2/LOB)家族、ARF家族和AP2家族,‘赣南早脐橙特异性分布于GRAS家族。干旱胁迫0 d和10 d对比分析发现,‘赣南早脐橙差异基因主要分布于ERF家族(29个)(图7A),‘纽荷尔脐橙为WRKY家族(7个)(图7C),干旱胁迫0 d和20 d对比分析表明,‘赣南早脐橙差异基因主要分布于MYB家族(23个)(图7B),‘纽荷尔脐橙为bHLH家族(17个)(图7D)。
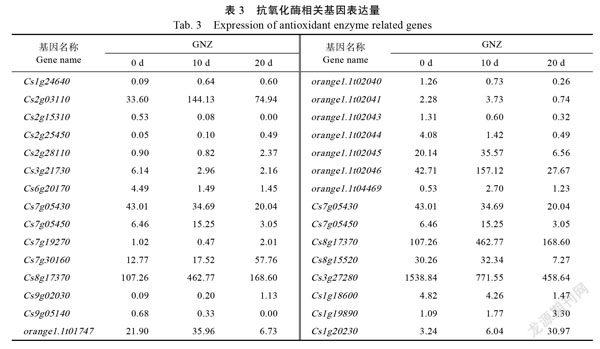
根据差异基因富集分析及转录因子分析结果,从转录组差异表达基因中挖掘出30个编码抗氧化保护酶基因(表3),过氧化物酶(POD)基因Cs8g17370、Cs7g05450、Cs2g25450和Cs2g03110等上調表达,Cs3g21730、Cs6g20170、Cs7g19270、Cs1g18600和Cs9g05140等下调表达。编码抗坏血酸过氧化物酶(aseorbateperoxidase, APX)基因Cs8g17370和Cs7g05450上调表达,而Cs7g05430下调表达。编码超氧化物歧化酶(SOD)基因Cs8g15520和过氧化氢酶(catalase, CAT)基因Cs3g27280均下调表达。9A12BED8-D238-43C5-A21B-7259BF963ED4
3 讨论
净光合速率反应植物的光合能力的大小[10],随着净光合速率增大,植物消耗CO2量增大,胞间CO2减少,植物就通过增大气孔导度获取更多的CO2[11]。在自然干旱条件下,‘赣南早脐橙净光合速率及气孔导度均高于‘纽荷尔脐橙,说明‘赣南早脐橙在干旱胁迫下的光合作用能力强于‘纽荷尔脐橙。通常细胞膜能维持细胞内稳态,但干旱胁迫会导致植物细胞膜破坏导致大量电解质外渗,因此可以根据植物在干旱胁迫下的相对电导率来评估其抗旱性。同时,当植物在逆境条件下,往往发生膜脂过氧化作用,丙二醛是其产物之一,通常利用它表示植物对逆境反应的强弱[12]。本研究结果表明,随着干旱胁迫天数增加,‘赣南早和‘纽荷尔脐橙叶片相对电导率值均上升,且‘赣南早脐橙的相对电导率值
均低于‘纽荷尔脐橙,说明干旱胁对‘纽荷尔脐橙叶片细胞损伤程度大于‘赣南早脐橙。二者叶片丙二醛含量也均呈上升趋势,在胁迫10、15 d时‘纽荷尔脐橙叶片丙二醛含量高于‘赣南早脐橙,说明‘纽荷尔脐橙叶片膜脂过氧化程度比‘赣南早脐橙高,细胞膜受损更严重。
SOD、POD是植物中防止膜脂过氧化的重要酶,因此SOD和POD活性能较好地反映植物对逆境的耐受能力[13-14],植物为避免细胞遭到氧化损伤,通过自我调节启动一系列抗氧化酶清除过量的活性氧物质,超氧化物歧化酶(SOD)是第一个参与植物细胞内活性氧清除的抗氧化酶,当SOD催化超氧根阴离子发生歧化反应后将产生H2O2和O2,由POD和CAT等保护酶负责进一步将H2O2分解成H2O和O2[15]。本研究发现,在干旱胁迫5 d时‘赣南早脐橙叶片SOD活性增强,而‘纽荷尔脐橙叶片SOD酶活性在干旱胁迫10 d时增强,且干旱胁迫10 d后‘赣南早脐橙叶片SOD活性显著高于‘纽荷尔脐橙,而二者叶片POD活性变化较为一致,干旱胁迫10 d后活性均上升,且‘赣南早脐橙叶片POD活性极显著高于‘纽荷尔脐橙,说明与‘纽荷尔脐橙相比,‘赣南早脐橙对干旱胁迫环境刺激更敏感,干旱胁迫加剧时,通过提高保护酶活性来抵御干旱逆境能力更强。
转录因子通过调控靶基因表达,在植物抵抗生物及非生物胁迫中起重要作用[16]。‘赣南早脐橙和‘纽荷尔脐橙转录因子分析比较发现,‘赣南早脐橙特异性分布于GRAS家族,GRAS家族基因具有促进分生组织发育,光敏信号传导和GA代谢调节等作用[17],说明‘赣南早脐橙抗干旱能力可能还与植物激素类代谢有关。干旱胁迫0 d和10 d对比发现,‘赣南早脐橙有29个差异基因分布于ERF家族,‘纽荷尔脐橙有7个差异基因分布于WRKY家族。干旱胁迫0 d和20 d对比分析表明,‘赣南早脐橙有23个差异基因分布于MYB家族,‘纽荷尔脐橙有17个差异基因分布于bHLH家族。ERF家族和MYB家族均为复杂的转录因子家族,不仅在种子萌发等植物发育过程中起重要作用,而且一些基因已被证明在干旱、高温等非生物胁迫中起重要作用[18-21],而WRKY家族通过调节激素类物质代谢帮助植物抵抗逆境[22]。bHLH家族则以结合作用,与其他蛋白互作响应干旱胁迫[23],说明干旱胁迫下ERF家族、MYB家族、WRKY家族和bHLH家族在调控网络中起重要作用,‘赣南早脐橙和‘纽荷尔脐橙对干旱胁迫耐受能力不同可能与转录因子调控有关,有待进一步发掘与考证。
参考文献
[1] 马小焕, 赖九江. 赣南脐橙产业现状浅析及对策研究[J]. 現代园艺, 2021, 44(17): 49-51.MA X H, LAI J J. Analysis and countermeasures of navel orange industry in southern Jiangxi[J]. Modern Horticulture, 2021, 44(17): 49-51. (in Chinese)
[2] 樊卫国, 李庆宏, 吴素芳. 长期干旱环境对柑橘生长及养分吸收和相关生理的影响[J]. 中国生态农业学报, 2012(11): 76-85.FAN W G, LI Q H, WU S F. Effects of long-term arid environment on citrus growth, nutrient absorption and related physiology[J]. Chinese Journal of Ecological Agriculture, 2012(11): 76-85. (in Chinese)
[3] 王凤丽. 持续高温干旱对果树的影响及高产栽培管理措施[J]. 现代农业科技, 2020(24): 67-68.WANG F L. Effects of continuous high temperature and drought on fruit trees and high-yield cultivation and management measures[J]. Modern Agricultural Science and Technology, 2020(24): 67-68. (in Chinese)
[4] 杨建莹, 霍治国, 王培娟, 邬定荣, 毛红丹, 孔 瑞. 中国北方苹果干旱等级指标构建及危险性评价[J]. 应用气象学报, 2021, 32(1): 25-37.YANG J Y, HUO Z G, WANG P J, WU D R, MAO H D, KONG R. Construction of drought grade index and risk assessment of apple in northern China[J]. Journal of Applied Meteorology, 2021, 32(1): 25-37. (in Chinese)9A12BED8-D238-43C5-A21B-7259BF963ED4
[5] 姜露露, 于 坤, 刘冬冬, 王军武, 包兴成, 郑 重. 干旱胁迫对无花果叶片生理特性的影响[J]. 中国农学通报, 2021, 37(28): 62-67.JIANG L L, YU K, LIU D D, WANG J W, BAO X C, ZHENG Z. Effects of drought stress on physiological characteristics of fig leaves[J]. Chinese Agronomy Bulletin, 2021, 37(28): 62-67. (in Chinese)
[6] 陈健美, 谢丽红, 周 娟, 江小美, 钟八莲, 李淑惠, 杨斌华, 喻芳琴.‘赣南早脐橙早熟性状回复型突变体的生理与转录组分析[J]. 果树学报, 2019, 36(4): 401-409.CHEN J M, XIE L H, ZHOU J, JIANG X M, ZHONG B L, LI S H, YANG B H, YU F Q. Physiological and transcriptome analysis of revertant mutant of early maturing trait of ‘Gannan Zao Navel Orange[J]. Journal of fruit trees, 2019, 36(4): 401-409. (in Chinese)
[7] 鐘八莲, 赖晓桦, 杨斌华, 米兰芳, 谢上海, 黄彩英, 杨文侠, 张 湟. 纽荷尔脐橙芽变早熟品种—赣南早脐橙[J].中国南方树, 2013, 42(2):48-51.ZHONG B L, LAI X H, YANG B H, MI L F, XIE S H, HUANG C Y, YANG W X, ZHANG H. Early maturing variety of ‘Newhall Navel Orange-Gannan early navel orange[J]. Fruit Trees in Southern China, 2013, 42(2): 48-51. (in Chinese)
[8] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 74-77, 144-148, 210-219.GAO J F. Experimental guidance of plant physiology[M]. Beijing: Higher Education Press, 2006: 74-77, 144-148, 210-219. (in Chinese)
[9] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 260-261.LI H S. Principles and techniques of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press, 2000: 260-261. (in Chinese)
- 刘怀年, 邓晓建, 李 平. 水稻品种资源光合速率研究[J]. 四川农业大学报, 2007, 25(4): 379-383.LIU H N, DENG X J, LI P. Study on photosynthetic rate of rice variety resources[J]. Journal of Sichuan Agricultural University, 2007, 25(4): 379-383. (in Chinese)
- 张效星, 樊 毅, 贾 悦, 崔宁博, 赵 璐, 胡笑涛, 龚道枝. 水分亏缺对滴灌柑橘光合和产量及水分利用效率的影响[J].农业工程学报, 2018, 34(3): 143-150.ZHANG X X, FAN Y, JIA Y , CUI N B, ZHAO L, HU X T, GONG D Z. Effects of water deficit on photosynthesis, yield and water use efficiency of Citrus under drip irrigation[J]. Journal of Agricultural Engineering, 2018, 34(3): 143-150. (in Chinese)
- 王海珍, 梁宗锁, 韩蕊莲, 韩 路. 土壤干旱对黄土高原乡土树种水分代谢与渗透调节物质的影响[J]. 西北植物学报, 2004(10): 1822-1827.WANG H Z, LIANG Z S, HAN R L, HAN L. Effects of soil drought on water metabolism and osmoregulation substances of native tree species in the Loess Plateau[J]. Journal of Northwest Botany, 2004(10): 1822-1827. (in Chinese)
- 张珊珊, 康洪梅, 杨文忠. 干旱胁迫下水杨酸浸种对云南蓝果树幼苗生理响应的影响[J]. 东北林业大学学报, 2016, 44(9): 34-39.ZHANG S S, KANG H M, YANG W Z. Effects of Seed soaking with salicylic acid under drought stress on physiological response of Yunnan blue fruit tree seedlings[J]. Journal of Northeast Forestry University, 2016, 44(9): 34-39. (in Chinese)
- 徐迎春, 陈尚武. 水分胁迫期间及胁迫解除后苹果树源叶碳同化物代谢规律的研究[J]. 果树学报, 2001, 18(1): 1-6.XU Y C, CHEN S W. Study on the metabolism of carbon assimilates in source leaves of apple trees during and after water stress[J]. Journal of Fruit Trees, 2001, 18(1): 1-6. (in Chinese)
- 尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报, 2007(1): 115-120.YIN Y Q, HU J B, DENG M J. Research progress on antioxidant system of plant leaves and its response to stress[J]. Chinese Agronomy Bulletin, 2007(1): 115-120. (in Chinese)
[16] WANG Y, XU W, CHEN Z, HAN B, HAQUE M E, LIU A Z. Gene structure, expression pattern and interaction of Nuclear Factor-Y family in castor bean (Ricinus communis)[J]. Planta, 2018, 247(3): 559-572.
[17] 李桂英. 植物GRAS家族转录因子的研究现状[J]. 安徽农业科学, 2014(14): 4207-4210.LI G Y. Research status of plant GRAS family transcription factors[J]. Anhui Agricultural Science, 2014(14): 4207-4210. (in Chinese)
[18] TSUBASA S J, LING Y. ERF gene clusters: working together to regulate metabolism[J]. Trends Plant Science, 2021, 26: 23–32.
[19] 崔喜艳, 张莹莹, 周 莹. 植物响应干旱胁迫转录因子研究进展[J/OL]. 吉林农业大学学报: 1-7[2021-11-27]. http:// kns.cnki.net/kcms/detail/22.1100.S.20210412.1425.006.html.CUI X Y, ZHANG Y Y, ZHOU Y. Research progress of plant transcription factors in response to drought stress[J/OL]. Journal of Jilin Agricultural University: 1-7[2021-11-27]. http://kns.cnki.net/kcms/detail/22.1100.S.20210412.1425.006.html. (in Chinese)
[20] 李嘉哲, 田广宇, 张敬鑫, 茶新有, 杨建坤, 董晨肖, 张荣沭. 山新杨MYB4基因在胁迫条件下的组织表达分析[J/OL]. 分子植物育种: 1-9[2021-12-04]. http://kns.cnki.net/ kcms/detail/46.1068.S.20211111.1502.004.html.LI J Z, TIAN G Y, ZHANG J X, CHA X Y, YANG J K, DONG C X, ZHANG R S. Tissue expression analysis of MYB4 gene of Shanxin poplar under stress[J/OL]. Molecular Plant Breeding: 1-9[2021-12-04]. http://kns.cnki.net/ kcms/detail/46.1068.S.20211111.1502.004.html. (in Chinese)
- 柯玉洁, 陈明堃, 马山虎, 欧 悦, 王 艺, 郑清冬, 刘仲健, 艾 叶. 兰科植物MYB转录因子研究进展[J/OL]. 园艺学报: 1-10[2021-12-04]. https://doi.org/10.16420/j.issn. 0513-353x.2020-0843.KE Y J, CHEN M K, MA S H, OU Y, WANG Y, ZHENG Q D, LIU Z J, AI Y. Research progress of MYB transcription factors in Orchidaceae[J/OL]. Journal of Horticulture: 1-10 [2021-12-04]. https://doi.org/10.16420/j.issn.0513-353x.2020- 0843. (in Chinese)
- 陳林英, 李佳佳, 王 博, 杜婉清, 高梦雪, 刘 慧, 檀淑琴, 邱丽娟, 王晓波. WRKY转录因子在大豆响应生物和非生物胁迫中的功能研究进展[J/OL]. 植物遗传资源学报: 1-11[2021-12-04]. https://doi.org/10.13430/j.cnki.jpgr.2021 1011001.CHEN L Y, LI J J, WANG B, DU W Q, GAO M X, LIU H, TAN S Q, QIU L J, WANG X B. Research progress on the function of WRKY transcription factor in soybean response to biological and abiotic stress[J/OL]. Journal of Plant Genetic Resources: 1-11[2021-12-04]. https://doi.org/10.13430/ j.cnki.jpgr.20211011001. (in Chinese)
- 刘晓月, 王文生, 傅彬英. 植物bHLH转录因子家族的功能研究进展[J]. 生物技术进展, 2011, 1(6): 391-397.LIU X Y, WANG W S, FU B Y. Research progress on the function of plant bHLH transcription factor family[J]. Biotechnology progress, 2011, 1(6): 391-397. (in Chinese)
