傣药龙血竭对脑缺血大鼠的脑保护作用
2022-06-01张晓燕蔡宇宇王玉瑶孙海珍
张晓燕,蔡宇宇,王玉瑶,孙海珍
(黑龙江中医药大学 药学院,黑龙江 哈尔滨 150000)
龙血竭是一种红色的树脂,1972年在中国云南省发现的龙血竭(Longxue Jie)来源于百合目龙舌兰科剑叶龙血树 Dracaena cochinchinensis(Lour.)S.C.Chen 的树脂提取物,亦称“广西血竭”,是民族傣药“龙血竭”的主要来源。其药理作用有抗炎作用:临床上龙血竭合用美沙拉嗪能降低TNF-α、IL-6及CRP的水平,从而治疗结肠炎[1],龙血竭能抑制肺组织的炎症程度和胶原过度沉积达到急性炎症治疗[2];活血化瘀作用:研究表明PAI-1 能增加动静脉血栓形成的风险,龙血素B能有效的阻止uPA/PAI-1复合物的形成,抑制PAI-1的活性,而产生活血化瘀作用[3-4];抗肝/肺纤维化作用:龙血竭抑制 IL-2和上调 IL-5等炎症因子,降低透明质酸和转氨酶而产生降低肝/肺纤维化的作用[5-6]。降糖、降脂作用:龙血竭的有效成分总黄酮能降低三酰甘油、总胆固醇,降低 IL-6,提高胰岛素产生降糖降脂的作用[7]。目前临床应用于心血管疾病[8],皮肤科疾病[9-11],妇产科疾病[12-13],消化系统疾病[14-15]和肛肠科疾病[16-17]等。
脑缺血(Cerebral Ischemia,CI)是微循环障碍性疾病。临床显示,老年人是缺血性脑卒中的易患人群,可能与并发症高血压,高血脂有关[18]。脑卒中具有较高发病率、致死率、致残率、复发率特点[19],中医认为,脑和五脏具有密切的联系,产生脑卒中病症时,有害物质可运送到重要器官,导致器官损伤。中药多成分,多靶点和良反应少[20],因此在临床生有着重要意义。本文研究中药龙血竭抗脑缺血药效作用,为今后龙血竭在心脑血管疾病和神经保护领域奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 药品与试剂
龙血竭(龙血竭制成粉末,批号:20191106):广西中医药研究院;脑心通胶囊(规格0.4 g/粒,批号:1911166):陕西步长制药有限公司;2%TTC染液(批号 20190925):北京索莱宝科技有限公司;羧甲基纤维素钠(CMC-Na,批号:20090514):天津市光复精细化工研究所;GSH-Px(批号:A005-1)、SOD(批号:A001-3)、MDA(批号:A003-1)、CAT(批号:A007-1-1)试剂盒:南京建成生物工程研究所;苏木精-伊红染液(HE,批号202105):武汉赛维尔生物科技有限公司。
1.1.2 试验动物
Sprague-Dawley大鼠,SPF级,雌雄各半,9周岁,体质量(260±20) g,由黑龙江中医药大学试验动物中心提供,合格证号:SCXK(黑)2018-007,饲养条件:温度 25 ℃,湿度 50%,昼夜间隔12 h,自由饮水。
1.2 仪器与设备
XW-80A涡旋混合器:上海琪特分析仪器有限公司;CM-36型圆形水浴氮吹仪:北京成萌伟业科技有限公司;M200 PRO酶标仪:瑞士帝肯集团公司;YD1508R轮转式病理切片机:德国徕卡公司;TB-P1自动包埋机:上海名元实业有限公司。
1.3 试验方法
1.3.1 造模
大鼠术进食供水12 h,以10%水合氯醛溶液腹腔注射大鼠,将四肢和头部固定在试验台上,颈正中剪开皮肤约2 cm切口,钝性分离,暴露左侧颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)。分离出CCA,找到动脉Y型分叉,取缝合线于左侧CCA远心端和近心端及ECA处挂线备用。用微动脉夹暂时夹闭 ICA,然后近心端结扎CCA、ECA。在CCA分叉处,近心端约4 mm处倾斜45度剪切口,将线栓(鱼线剪成5 cm长的线段,5 mm以下蘸取石蜡)从切口处朝 ICA入颅方向插入,感到有轻微阻力即停止。扎紧,缝合,将鱼线尾部露出体外。用灯照射保持肛温为37 ℃,90 min后将鱼线拔出约2 cm并剪去露出体外部分。假手术组仅将大鼠皮肤切开,剥离暴露CCA、ECA及ICA后缝合。
1.3.2 模型判断指标
采用Zea Longa5 级评分标准评价(无神经功能损伤(0分),对侧前肢伸展障碍(1分),向手术对侧打圈(2分),行走时向手术对侧倾倒(3分),意识昏迷(4分)),筛选成功模型(大于0分),未入选大鼠弃之。
1.3.3 动物分组与给药
将有效造模大鼠随机分为六组,分别为假手术组(Sham)、模型组(Model)、龙血竭组(高(DBH)、中(DBM)、低(DBL)组)和脑心通胶囊组(NXT),每组20只,灌胃剂量按照1 mL/100g计算,灌胃 1次/d,连续灌胃14 d。
假手术组(Sham)和模型组(Model)给予生理盐水。
龙血竭组:将其分为高(DBH)、中(DBM)、低(DBL)组,是通过取适量龙血竭混悬于0.5%羧甲基纤维素钠水溶液中,配制成浓度的分别2.16、1.08、0.54 g/kg的混悬液。
脑心通胶囊组(NXT):规格为每粒 0.4 g,根据剂量换算,用纯水配制成浓度为54 mg/kg的混悬液。
1.3.4 检测指标
1.3.4.1 神经功能评分 在术后第 1、4、7、14 d参照改良神经功能缺损评分(mNSS),神经功能评分在0~18分之间,0分为正常;1~6分为轻度神经功能缺损;7~12分为中度缺损;13~18分为重度缺损。具体评分标准见表1。

表1 神经功能评分标准Table 1 Nerve function scoring criteria
1.3.4.2 脑组织含水量(%)及脑梗死体积测定脑组织含水量:各组随机选取6只大鼠,于第7 d灌胃给药后进行断头取脑,精密称湿重,后80 ℃干燥至恒重,称三次取均值。
脑组织含水量(%)=(脑组织湿重–脑组织干重)/脑组织湿重×100%
脑梗死体积(%)=(非缺血侧半球面积–缺血侧半球未梗死面积)/全脑面积×100%
1.3.4.3 HE染色和 TTC染色 将各组大鼠在术后第 14 d行神经功能缺损评分后,随机选取 12只,随机取6只用水合氯醛腹腔麻醉,打开胸腔、暴露心脏,剪开右心耳,自左心尖灌注0.9%氯化钠溶液,当右心耳流出无血色液体,断头取脑,大鼠的脑组织于–20 ℃冰箱中20 min后进行常规的TTC染色。其余6只进行相同步骤,通过氯化钠处理后,用4%多聚甲醛从左心尖灌注,当全身僵硬,迅速断头,取脑,置于4%多聚甲醛固定液中,进行HE染色。
1.3.4.4 对血清中的氧化应激水平的影响 将各组大鼠禁食供水12 h,水合氯醛腹腔注射麻醉,经腹主动脉采血,置于10 mLEP管室温静置1 h后,4 ℃,4 000 r/min离心10 min,合并同组大鼠血清。采用酶标仪对SOD、MDA、GSH-PX、CAT进行活性检测。
1.4 数据分析
神经功能行为学评分和脑组织含水量采用单因素方差分析(ANOVA),用spss25.0进行计算,结果用均数±标准差(X±S)表示,作图使用Graphpad Prism9,图像分析采用Image Pro Plus 6.0,两组间采用t检验,当P<0.05时,表示有显著性差异,具有统计学意义。
2 结果与分析
2.1 试验结果
2.1.1 对神经功能的影响
Sham组大鼠的神经功能从轻微损伤恢复至正常;Model组的神经功能缺损明显且损伤长期存在。给药组与Model组相比,给药组神经功能评分降低趋势一致,均有显著改善(P<0.01);第14 d DBH/M组的神经受损恢复最好,且优于NXT组,见表2。

表2 各组大鼠神经功能评分比较Table 2 Comparison of neurological function scores in rats
2.1.2 对脑组织含水量及脑梗死体积的影响
相比 Sham 组,Model组大鼠脑组织含水量显著增加(P<0.01)。给药组大鼠脑组织含水量较Model组均低,具有显著的统计学差异(P<0.05或P<0.01),HBH与NXT两者的含水量基本相同,表明龙血竭可降低脑组织含水量,见表3。
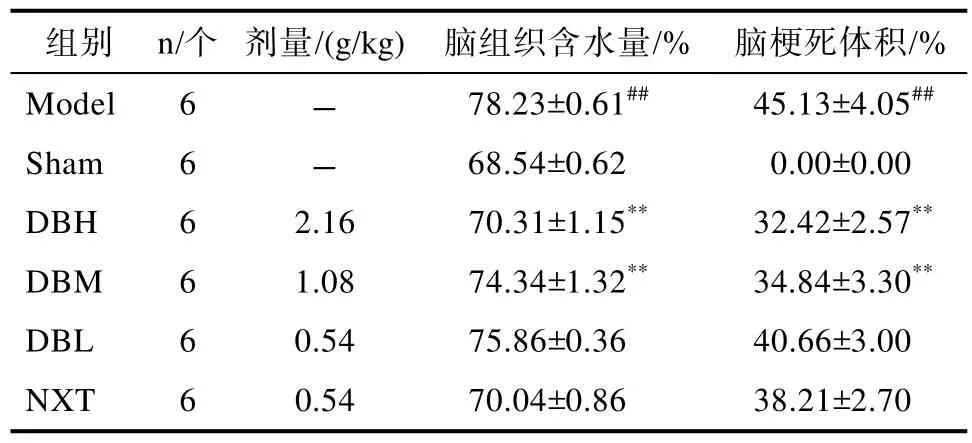
表3 各组大鼠脑组织含水量Table 3 Percentage of brain water content in rats
Sham组可见均匀红色脑组织切片,脑组织切片未见梗死病灶(0.00%±0.00),与Sham组相比,Model组大鼠术侧脑组织梗死明显且体积较大(45.13%±4.05,P<0.01);与 Model组相比,各给药组白色梗死区域均相对减少,尤其是 DBH(32.42%±2.57,P<0.01)和 DBM 组(34.84%±3.30,P<0.05)。治疗效果优于 NXT组。认为龙血竭能够不同程度的改善脑组织供血不足,降低大鼠缺血侧脑梗死体积,见图1。

图1 脑梗死体积Fig. 1 Cerebral infarction volume
2.1.3 对脑组织学的影响
Sham组细胞完整,分布均匀,细胞核居中,核仁清晰。Model组中有明显组织结构异常,结构紊乱,细胞分布不均匀,可见大量细胞核移位及固缩,排列稀疏,血管周围V-R腔增宽。相比Model组,各给药组仅皮层少数细胞固缩,且DBH/M组可见异常变化较少,个别神经元固缩,皮层固缩细胞数量减少,小胶质细胞有显著修复,见图2。

图2 脑组织HE染色切片图Fig. 2 HE stained sections of brain tissue
2.1.4 对氧化应激的影响
与Sham组相比,Model组SOD活力下降显著(P<0.01),GSH-PX及CAT活力有所下降(P<0.05),MDA含量上升不明显(P>0.05)。与Model相比,龙血竭组SOD、GSH-PX活力均有显著提高(P<0.05 或P<0.01),且 DBH组能显著降低MDA含量(P<0.05)。其中,NXT组降低 MDA含量无统计学差异(P>0.05),提高 CAT、SOD活力作用有显著差别(P<0.05),见表4。

表4 对CI大鼠氧化应激水平的影响Table 4 Effects on oxidative stress levels in CI rats
2.2 试验分析
近年来大脑中动脉栓塞模型(MCAO广泛应用于脑缺血动物模型,因为它与人脑缺血相似,不需要颅骨切除,损伤小。脑缺血再灌注能使脑部造成更大的损伤,更好地模拟脑缺血的行为改变和病理特征[21],由于脑缺血复杂的发病机制,包括兴奋毒性、离子失衡、氧化应激和炎性反应等[22],防治脑缺血的问题也在更深层次的探索当中。脑缺血缺氧后,脑组织代谢异常、脑内氧化应激与自由基的过量产生,细胞膜通透性增加,低氧环境导致白细胞渗入低氧组织细胞水肿,引起血脑屏障渗漏和水肿,导致肿瘤坏死因子升高,从而引发细胞炎性因子释放,损伤脑组织中内皮细胞、神经元、胶质细胞,引起细胞酸中毒,能量代谢障碍等。随后导致神经细胞的凋亡,缺血再灌注期间神经功能的下降[23-26]。
当中枢神经系统被破坏,所产生的有害物质超出自生调节,由于脑部对缺血缺氧非常敏感,因此脑组织会产生微循环障碍,细胞膜通透性增加,引起脑组织含水量增加,细胞形态发生改变。HE染色法是组织学、胚胎学、病理学教学与科研中最基本,最广泛的技术方法[27]。苏木精染液为碱性,使细胞核内的染色质与胞质内的核酸显紫蓝色;伊红为酸性染料,使细胞质和细胞外基质中的成分着红色。由试验[28]表明,颈动脉狭窄解除能够降低脑组织含水量,也使血脑屏障的通透性降低含水量。本试验中龙血竭组降低脑组织含水量,其可能是通过降低血脑屏障通透性而产生的效果。根据文献[29]可知,给药组多数神经细胞结构、形态改变相对较轻,核固缩少,排列整齐,这与本试验的结果一致,可推断出龙血竭能改善海马体组织,从而达到脑保护作用。脑缺血再灌注后引起一系列的氧化应激反应[30-31],并且氧化应激负荷时,自由基产生过量,导致有害产物丙二醛(MDA)等水平升高,病情加重。而SOD、CAT、GSH-Px能清除过氧化物,起到保护细胞膜结构和功能的完整性[32]的作用。由研究[33-34]表明,不同浓度羽扇豆醇,能使血清 SOD和 GSH水平升高,MDA水平降低,从而增加抗氧化物酶活性,有效减少氧化应激损伤,与本试验结果一致,且DBH组降低MDA水平远远优于NXT组,表明龙血竭组有较好的脑保护作用。
严重脑缺血能大面积脑梗塞,当达到四分之三梗阻会出现偏瘫、偏身感觉障碍和嗜睡等现象[35],TTC是脂溶性光敏感复合物,1958 年开始用来检测哺乳动物组织的缺血梗塞[36]。正常组织中脱氢酶活性高可与TTC反应显红色,缺血组织显白色。梁萍[37]研究中提到,脑梗死面积减小能恢复脑部神经和记忆,本试验龙血竭组能减少脑阻塞面积,且治疗效果优于 NXT组,有显著性差异(P<0.05),说明也有同样的脑保护作用。
3 结论
龙血竭可降低脑组织含水量和血脑屏障通透性,减轻神经细胞形态和结构的改变,抑制海马体组织的损伤,从而达到脑组织的保护作用;提高机体的氧化应激能力,增强人体的防御力和神经血管的结构和功能,改善脑缺血再灌注组织病理损伤;龙血竭还能缩小脑梗死面积,恢复大鼠的记忆和神经。说明龙血竭对大鼠脑缺血疾病有一定的保护作用。
