基于药物基因组学对《运动员常用治疗药物使用指南(2020版)》的解读*
2022-06-01吴竞鲜何霞边原杜姗刘心霞童荣生王俊丽问媛媛袁梦莹
吴竞鲜,何霞,边原,杜姗,刘心霞,童荣生,王俊丽,问媛媛,袁梦莹
(1.电子科技大学医学院,成都 610054;2.四川省医学科学院·四川省人民医院/电子科技大学附属医院药学部·个体化药物治疗四川省重点实验室,成都 610072;3.西安天隆科技有限公司,西安 710018;4.成都中医药大学药学院,成都 611137)
运动员是一项特殊且高危的职业。一项调查2014年索契冬季奥运会健全运动员的研究报告显示,2780名运动员中有249人患病,占所有参加奥运会运动员总数的8.96%[1]。疾病涉及系统包括呼吸、皮肤、消化等多个系统[2]。为维护运动员的身心健康,维护体育精神的公平性,我国制定《运动员常用治疗药物使用指南(2020版)》[3],为运动员提供用药选择。我国国家体育总局办公厅公布《兴奋剂目录(2022版)》[4],于2022年1月1日起执行。笔者在本文解读的药品均为《运动员常用治疗药物使用指南(2020版》中,未列入《兴奋剂目录(2022版)》的药物。
药物基因组学(pharmacogenomics,PGx)是利用患者特异性遗传变异指导药物选择,在药物疗效和安全性方面都具有重要作用。参赛运动员可能具有不同的遗传背景,运动员的职业时间、赛季等原因对安全用药的要求具有一定的特殊要求,增加其用药的安全性和有效性尤为重要。有关运动员精准用药的研究鲜有报道。本文将基于药物基因组学,系统解读目前《运动员常用治疗药物使用指南(2020版)》中和药物基因组学密切相关的药物,为此次冬奥会运动员的个体化用药提供参考依据。
1 抗病毒药物
运动员常用的抗病毒药物包括利巴韦林、阿昔洛韦、泛昔洛韦、阿糖腺苷、磷酸奥司他韦等。目前利巴韦林与与IFNL3(rs12979860)的研究较多(PharmGKB证据等级为1A)。丙型肝炎病毒(hepatitis virus C,HCV)感染通常采用聚乙二醇化干扰素联合利巴韦林进行治疗,但其疗效存在很大的个体差异,部分患者治疗后出现持续病毒反应,部分患者治疗无效,未能获得持续病毒清除。此外,亚洲人群的持续病毒反应率显著高于高加索人群。位于IFNL3基因上游约3 kb处的SNP rs12979860 C>T 与干扰素联合利巴韦林治疗的病毒治疗应答相关,CC 基因型患者聚乙二醇化干扰素联合利巴韦林治疗24周后70%患者获得持续病毒学应答,而CT 和TT 型患者获得持续病毒应答率只有30%。治疗 24~48 周后,高达90%的CC型患者获得持续病毒学应答,而只有60%的CT 和TT 型患者获得持续病毒学应答。rs12979860C 等位基因频率分布存在种族差异,亚洲人群中大于90%,而非洲人群中为 20%~50%。高加索人群中 CC 基因型频率为 37%。美国肝脏病学会和欧洲肝脏病学会 2011 年 HCV 感染防治指南已将IFNL3基因多态性作为基线预测聚乙二醇化干扰素反应性的主要因素之一[5]。美国食品药品管理局(FDA) 已批准在聚乙二醇干扰素α-2a、聚乙二醇干扰素 α-2b 和利巴韦林说明书中增加在用药前对IFNL3 rs12979860 基因型进行检测的建议。因此,如果运动员需要使用利巴韦林进行HCV治疗时,检测IFNL3 rs12979860 基因型有助于HCV感染的个体化治疗,从而提高治疗水平。
2 麻醉药
使用局部麻醉药(局麻药)局部注射止痛帮助运动员继续完成比赛是竞技运动中常见做法[6]。局麻药通过阻断钠离子通道[7],可以提供100%的疼痛阻滞,因此其镇痛效果在某些损伤下优于其他镇痛药[8]。2016年,美国国家足球联盟的调查显示,几乎所有内科医生都曾对球员使用过局麻药[7]。运动员可使用的局麻药物有利多卡因和罗哌卡因。
在麻醉药物的临床应用中,当不同患者使用同一剂量的麻醉药物时,麻醉深度、不良反应的发生率存在较大的个体差异。美国FDA批准的利多卡因和罗哌卡因的药品说明书中指出,高铁血红蛋白血症与局麻药的使用有关。虽然所有患者都有高铁血红蛋白血症的风险,但葡萄糖-6-磷酸脱氢酶(glucose 6 phosphate dehydrogenase,G6PD)缺陷症、先天性或特发性高铁血红蛋白血症、心脏或肺功能受损以及同时接触氧化剂或其代谢物的患者更容易患高铁血红蛋白血症。如果这些患者必须使用局麻药,建议密切监测高铁血红蛋白血症的症状和体征。虽然CYB5R3基因在药物说明书中没有明确说明,但是该基因突变与先天性高铁血红蛋白血症相关[9](利多卡因或罗哌卡因与G6PD或CYB5R3无PharmGKB和CPIC证据等级,但是FDA批准的利多卡因和罗哌卡因的药品说明书中提出在使用利多卡因和罗哌卡因前需进行G6PD和CYB5R3基因检测),在运动员使用这2种药物时,应予以关注。
3 解热、镇痛、抗炎、抗痛风药
非甾体抗炎药(nonsteroidalanti-inflammatory drugs,NSAIDs)被世界各地的运动员广泛使用。据统计,世界杯比赛中,有超过50%球员在比赛期间至少使用过一次NSAIDs[10]。运动员通过使用NSAIDs来减轻与训练、比赛或软组织损伤相关的疼痛和炎症或获得竞争优势[11]。此前芬兰奥运会,每5人就有1例报道NSAIDs相关的不良反应[12]。并有报道显示,在马拉松等运动期间服用NSAIDs的运动员发生胃肠道痉挛、出血、心血管不良事件和暂时性肾衰竭等严重不良事件的概率是其他运动员的5倍[13]。运动员可使用NSAIDs包括阿司匹林、布洛芬、美洛昔康。
3.1阿司匹林 阿司匹林是一种常用的解热镇痛药,在临床应用广泛。另外,阿司匹林对血小板聚集有抑制作用,能阻止血栓形成,临床上用于预防短暂脑缺血发作、心肌梗死、人工心脏瓣膜和静脉瘘或其他手术后血栓的形成。与阿司匹林药效或不良反应相关的基因位点有HLA-DPB1*03:01:01(PharmGKB证据等级为2B)、PTGS1(rs10306114)、GP1BA(rs6065)、LTC4S(rs730012)、PEAR1(rs12041131)、ITGB3(rs5918)等(PTGS1、GP1BA、LTC4S、PEAR1、ITGB3的PharmGKB证据等级为3)。HLA-DPB1*03:01:01与阿司匹林治疗时哮喘风险增加相关[14],与荨麻疹风险降低相关[15]。阿司匹林抑制 PTGS1 酶活性,从而产生抗血小板效应[16],VERSCHUREN等[17]报道,在ST段抬高型心肌梗死患者中,使用阿司匹林和氯吡格雷治疗时,与PTGS1(rs10306114)的基因型AA相比,基因型AG+GG与心血管事件风险增加相关。在中国人群中,PTGS1的AA、GA和 GG 型的基因频率分别为87%,12%和 1%[18]。MATSUBARA等[19]报道GP1BA基因多态性与患者对阿司匹林敏感性有关,CC型相比于TT型,阿司匹林抵抗风险显著增加。中国人群中,CC型基因频率为5.6%[20]。SANCHEZ-BORGES等[21]报道 LTC4S 的 C 等位基因与阿司匹林导致的荨麻疹相关,其中在健康中国人群中 AC 和 CC 基因频率为28.9%和 0.8%[22]。PEAR1(rs12041131)A 等位基因的携带者不良心血管事件风险增加[23]。ABDERRAZEK等[24]研究发现,ITGB3(rs5918)的TT基因型与CC+CT基因型相比,阿司匹林治疗时血小板抑制率低,患者可能存在阿司匹林抵抗或无反应。另外,ITGB3(rs5918)的等位基因T与阿司匹林或氯吡格雷耐药性有关。在条件允许情况下,建议运动员在服用阿司匹林前进行PTGS1、GP1BA、LTC4S、PEAR1、ITGB3等相关基因多态性检测。
3.2布洛芬、美洛昔康 CYP2C9 是细胞色素 P450(CYP)酶第二亚家族中的重要成员,占肝微粒体P450蛋白总量的20%。CYP2C9参与NSAIDs、抗凝血药、抗高血压药以及利尿药等多种药物的羟化代谢。CYP2C9活性变化可导致这些药物体内浓度出现较大变化,甚至导致严重药物不良反应发生。CYPC2C9*2(rs1799853)和CYP2C9*3(rs1057910)均导致 CYP2C9酶活性降低。中国人群中CYPC2C9*2的频率为0%,CYPC2C9*3的频率为3%。CYP2C9 遗传多态性导致其酶活性变化,从而导致药物代谢种族和个体差异现象。在人体中,布洛芬主要是通过肝脏生物转化而被消除。它主要由CYP2C9在肝脏中代谢[25],CYP2C8也可能在药物的代谢过程中发挥作用[26]。CYP2C8*3和CYP2C9*3变异等位基因纯合或双杂合的个体对布洛芬的清除率极低[27]根据基因型确定CYP2C9可能的表型见表1[28]。[布洛芬或美洛昔康与CYP2C9的PharmGKB证据等级为1A,临床药物基因组学实施联盟(Clinical Pharmacogenetics Implementation Consortium,CPIC)证据等级为A,与CYP2C8的PharmGKB证据等级为3,CPIC 证据等级为C]。
FDA 药品说明中明确提出,对于CYP2C9代谢不良的患者,考虑布洛芬或美洛昔康减小剂量,因为CYP2C9不良代谢患者可能因代谢清除降低而使布洛芬或美洛昔康血浆水平异常高,致使患者发生不良反应的风险增加。
CPIC推荐具有不同基因型的运动员,对药物的代谢能力不同,故而在使用该类药物进行治疗时,应注意剂量的调整[28],见表2。
4 心血管系统用药
运动员可以使用的心血管系统药物主要包括两类,抗高血压药:氯沙坦、缬沙坦、卡托普利、氨氯地平、硝苯地平;调脂药:阿托伐他汀钙片。
4.1降压药 高血压是运动员心血管疾病最常见的危险因素,不同的训练类型和运动强度可能导致血压升高[29]。越来越多的运动员可能发生不同程度的高血压,男性职业足球运动员高血压患病率为7%[30],美国大学生足球运动员为19%[31]。为了不影响运动员正常参赛,应对其进行高血压评估并治疗[32]。对于血压>200/110 mmHg(1 mmHg=0.133 kPa),应禁止体育活动,需进行药物治疗后才可考虑恢复体育活动[32]。

表1 根据基因型确定CYP2C9的表型
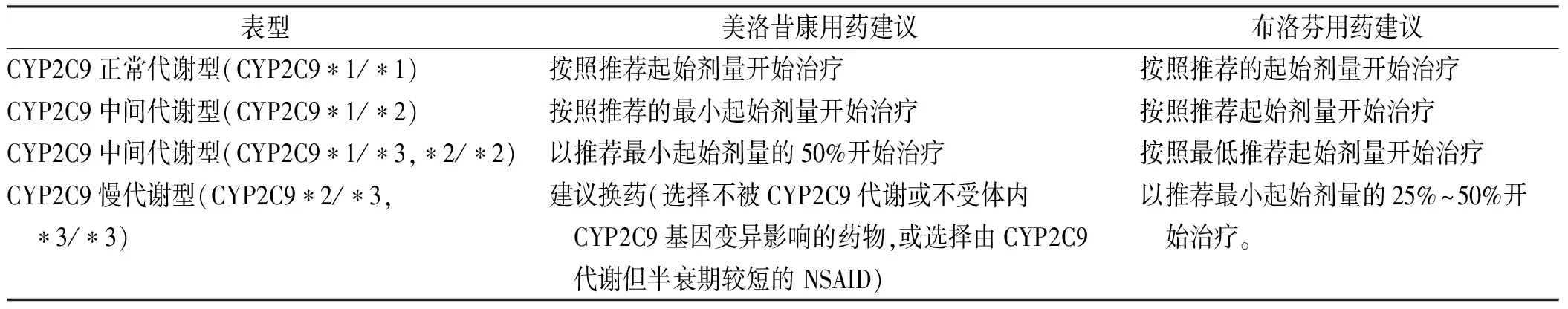
表2 CYP2C9基因多态性指导布洛芬、美洛昔康的使用剂量
针对运动员群体,其患高血压的原因可能包括:力量运动员等体质量指数(BMI)较高、长期滥用非法药物或NASIDs等[33]。对不同高血压病因的运动员,应予以针对性的治疗,在药物治疗时,为了对每位运动员制订个性化的治疗方案,应结合药物基因组信息优化抗高血压药物的选择。
4.1.1血管紧张素Ⅱ受体拮抗剂(angiotensin receptor blocker,ARB) 氯沙坦和缬沙坦是ARB类药物的代表药。CYP2C9通过影响环氧花生酸的合成代谢从而影响血压的调节和血管内皮的功能[34],最终影响原发性高血压的发生。研究表明,CYP2C9*3对氯沙坦的代谢能力减弱[35](氯沙坦和缬沙坦与CYP2C9的PharmGKB证据等级为3)。
血管紧张素Ⅱ-1型受体(angiotensinⅡ receptor type 1,AGTR1)基因是血管紧张素Ⅱ产生生物学效应的关键环节,其编码的AGTR1主要通过与血管紧张素Ⅱ结合而发挥收缩血管、调节血压和控制醛固酮释放等生物学效应[36]。既往研究表明,基因型为AC、CC组人群中,氯沙坦可增加肾小球滤过率,降低平均动脉压,但在AA组中无影响[37](PharmGKB证据等级为3)。
4.1.2血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEI) 卡托普利是ACEI类药物的代表药物之一,也是本类药物中运动员唯一推荐用药。血管紧张素转换酶(angiotensin converting enzyme,ACE)是ACEI的作用靶点,ACE基因的多态性影响着ACEI的作用效果。其多态性主要集中在第16内含子中的288 bp片段的插入(insertion,I)或缺失(deletion,D):II(插入纯合子)、ID(插入缺失杂合子)和DD(缺失纯合子)。亚洲人群中D等位基因频率为39.0%。ACE(I/D) 多态性可影响血浆ACE的水平,DD基因型个体血浆ACE的活性升高。与基因型II相比,基因型ID +DD与对卡托普利的反应增加[38](PharmGKB证据等级为2A,CPIC为D)。
4.1.3钙通道阻滞剂类药物 氨氯地平、硝苯地平是钙通道阻滞剂的代表药物。心房钠尿肽作为利尿剂维持细胞外液容量和电解质稳态,NPPA基因编码心房钠尿肽。因此NPPA基因的多态性可能影响降压药物的疗效[39]。研究发现NPPAT2238C基因变异与心血管病的预后和使用降压药物的疗效相关[40](氨氯地平、硝苯地平与NPPA T2238C的PharmGKB证据等级为3)。
CYP3A5参与临床中>50%常用药物的氧化、还原反应[41]。研究表明,CYP3A5多个突变等位基因中第3个内含子中的6986A→G单核苷酸多态性所影响的酶类,显著影响钙通道阻滞剂类药物氨氯地平、硝苯地平的代谢及血药浓度[42]。CYP3A5*3多态性使其有AA、AG、GG 3种表型,在使用相同氨氯地平治疗方案的情况下,GG基因型降压效果最好,AG基因型次之,AA基因型较差[43]。因此,应充分关注运动员CYP3A5基因多态性。表达功能性CYP3A5的能力弱者,对二氢吡啶类钙拮抗剂代谢减慢,疗效下降,毒副作用增加,可适当调整药物剂量(氨氯地平、硝苯地平与CYP3A5的PharmGKB证据等级为3)。
4.2调脂药 长期运动可以增加运动员的高密度脂蛋白胆固醇、降低其三酰甘油水平。运动员的血脂异常与先天易感性或使用某些禁用的药物有关[44]。他汀类药物是调节治疗血脂异常的常用药物。阿托伐他汀钙片是他汀类药物家族中的一员,也是运动员常用的调脂药。横纹肌溶解、肌炎、肌腱破裂是他汀类药物服用者主要的不良反应,在多中心对照研究中约占5%[45]。SINZINGE等[46]研究显示,在顶级运动选手中,只有约20%的人能耐受他汀类药物治疗而不产生不良反应。
SLCO1B1基因是他汀类药物导致不良反应的关键因素,其编码的蛋白主要参与药物的转运,负责将血液中的药物转移至肝脏中直接发挥药效或代谢转化为有活性的物质。SLCO1B1具有高度多态性,目前已有约20种SLCO1B1基因的突变在不同研究人群中被发现。其中,521T>C和388A>G突变是发生于欧美人群和亚洲人群中分布频率较高且功能意义明显的突变位点。突变型SLCO1B1基因引起自身转运活力减弱,表现为肝脏摄取药物能力降低,引起他汀药物血药浓度上升,增加横纹肌溶解症或肌病的发生风险。全球多个实验室发现,SLCO1B1基因多态性与他汀药物主要不良反应之间存在显著相关性[47](阿托伐他汀与SLCO1B1的PharmGKB证据等级为1A)。
ApoE是一种载脂蛋白,参与血脂的运输、存储和排泄。该基因结构具有多态性,由3种单倍型构成6种不同的基因型(E2/E2、E3/E3、E4/E4、E2/E3、E2/E4和E3/E4)。其多态性与TC水平密切相关,不同的ApoE基因型TC水平不同,最高为E4/4,最低为E2/2,且与性别、年龄等因素无关[48]。有研究表明,ApoE基因与降脂治疗效果相关,E3/3基因型患者他汀治疗效果较好,而E3/4基因型患者他汀治疗效果较差[49](阿托伐他汀与ApoE的PharmGKB证据等级为2B)。目前FDA已将ApoE2列为普伐他汀药物反应相关的生物标记。基因型为APOEE2/E2的高脂血症患者普伐他汀的降脂疗效更好。
阿托伐他汀钙片说明书批准的剂量是10~80 mg,荷兰药物遗传学工作组推荐具有不同基因型的患者,其患肌病风险也不同,故而在使用阿托伐他汀钙片进行治疗时,应注意给药方案的调整,见表3[50]。
SLCO1B1和ApoE基因多态性检测可预先判断运动员对阿托伐他汀的代谢速率类型和药物敏感程度,辅助临床更快调整他汀类用药合理剂量,并降低药品不良反应发生风险。
5 消化系统用药
胃肠道疾病在运动员中很常见,发生率为30%~70%。运动产生的机械力、胃肠道血流改变、神经内分泌改变是引起运动员胃肠道疾病最常见的3个重要因素[51]。胃肠道疾病最常见的症状包括胃灼热、恶心、呕吐和上腹疼痛。在比赛前除停止或谨慎使用NSAID类药物外,对于有明显恶心和胃灼热症状的运动员,可尝试质子泵抑制剂(proton-pump inhibitor,PPI)[52]。运动员可用PPI类药物包括奥美拉唑、泮托拉唑。
运动员常用的PPI类药物主要由CYP2C19代谢。CYP2C19基因型与PPI暴露有关,低暴露与治疗失败相关,高暴露与疗效改善相关,也与不良反应有关。CYP2C19超快代谢患者的PPI暴露水平较低,这些患者的药物剂量应该大于标准剂量。长期服用PPI的CYP2C19中间代谢型或慢代谢型患者持续抑制酸分泌可能使与PPI相关不良事件发生的风险增加,根据CYP2C19基因多态性指导的奥美拉唑、泮托拉唑治疗推荐剂量请见表4[53](奥美拉唑、泮托拉唑与CYP2C19的PharmGKB证据等级为1A,CPIC证据等级为A)。CYP2C19*1/*9、*9/*17、*9/*9为不常见的CYP2C19中间代谢型,其用药建议参照表3中CYP2C19中间代谢型的用药建议;CYP2C19*2/*9、 *3/*9为不常见的CYP2C19慢代谢型,其用药建议参照表3中CYP2C19慢代谢型的用药建议。
CYP2C19*2 (rs4244285,c.681G>A)和CYP2C19*3(rs4986893,c.636G>A)是中国、印度、越南和日本等地区中导致 CYP2C19 酶缺陷的主要等位基因。CYP2C19*2导致剪接缺失,CYP2C19*3为终止密码子突变。正常代谢型个体只携带CYP2C19*1等位基因,中间代谢型个体携带CYP2C19*2或CYP2C19*3杂合子基因型;慢代谢型个体包括CYP2C19*2/*2、CYP2C19*2/*3和CYP2C19*3/*3基因型。东方人群中75%~85%的慢代谢型由CYP2C19*2所致,20%~25%的慢代谢型由CYP2C19*3所致。

表3 SLCO1B1基因多态性指导阿托伐他汀给药建议
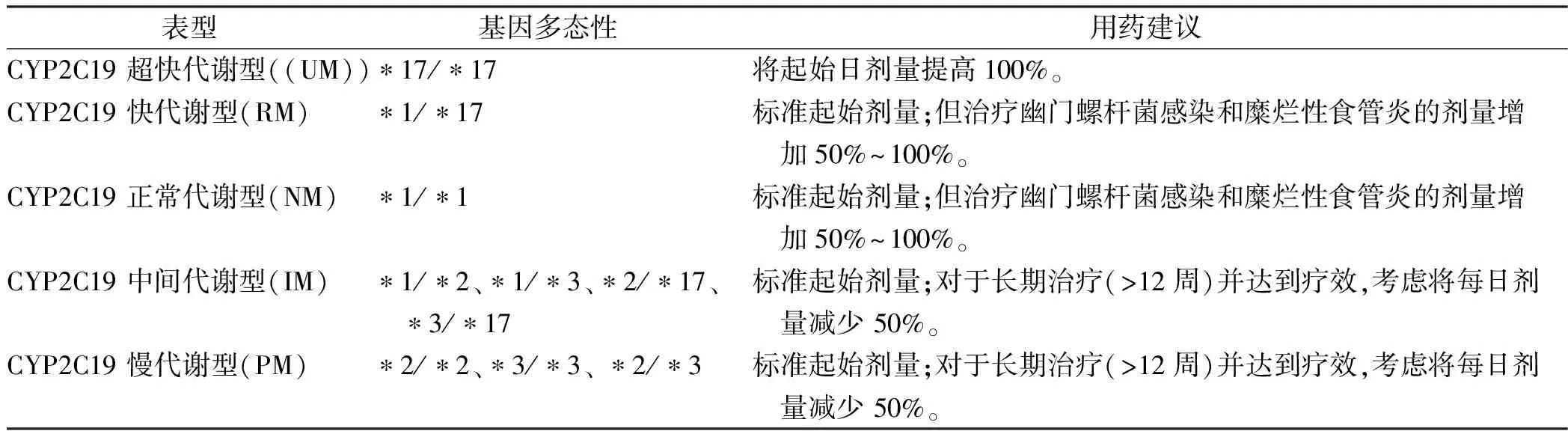
表4 CPIC推荐的奥美拉唑、泮托拉唑的推荐用量
6 结束语
本文结合《运动员常用治疗药物使用指南(2020 版)》,总结与药物基因组学高度相关的抗病毒药(利巴韦林),麻醉药(利多卡因和罗哌卡因),解热、镇痛、抗炎、抗痛风药(阿司匹林、布洛芬、美洛昔康),心血管系统药(氯沙坦、缬沙坦、卡托普利、氨氯地平、硝苯地平和阿托伐他汀钙片),消化系统药(奥美拉唑、泮托拉唑)等14个药物及其对应的基因位点和证据等级。这14个药物基因位点的突变可导致代谢酶、药物受体或转运蛋白的数量或功能发生变化,从而导致不良反应风险增加或治疗效果降低。通过对运动员进行药物基因检测可以帮助医生辨别易发生不良反应的药物,识别治疗失败风险增加的药物,帮助缩小治疗药物的选择范围,协助预测某些药物的剂量,从而对运动员实现个体化用药。
