胆汁酸代谢异常对Raw264.7细胞功能的影响*
2022-06-01周巧玲王鑫铭苏涌程龙浩葛朝亮
周巧玲,王鑫铭,苏涌,程龙浩,葛朝亮
(安徽医科大学第一附属医院药剂科,合肥 230022)
肝硬化是多种慢性肝病的终末期病变。感染是肝硬化患者最常见的严重临床并发症之一,肝硬化伴感染患者病死率较非感染患者提高4倍[1]。研究发现肝硬化患者感染的发病机制包括肠道微生物群、肠道通透性、细菌移位和免疫缺陷等。胆汁酸是在肝脏中由胆固醇合成的内源性类固醇分子,对维持机体葡萄糖和脂类的稳态具有重要作用。法尼醇受体(farnesoid X receptor,FXR)是胆汁酸合成和转运的重要调节因子;肝损伤时,FXR表达下调,导致胆汁酸代谢紊乱[2]。研究表明肝硬化患者伴随胆汁淤积,易继发感染,且具有高病死率。动物实验表明,胆管结扎小鼠模型的感染发生率以及严重程度均显著上升[3]。巨噬细胞是机体重要的免疫细胞之一,作为固有免疫的重要组成部分,是抵御病原体的第一道防线,其通过模式识别受体识别病原体相关分子模式和损伤相关分子模式,介导免疫效应。巨噬细胞M1型极化可清除机体异物,但是在炎症免疫反应异常亢进时,巨噬细胞通过释放大量的细胞因子和趋化因子可引发组织损伤[4]。课题组前期研究发现,肝硬化患者体内的鹅去氧胆酸(chenodeoxycholic acid,CDCA)、胆酸(cholic acid,CA)、脱氧胆酸(deoxycholic acid,DCA)等代谢发生紊乱,其中CDCA和CA浓度升高,而DCA浓度下降[5]。但代谢异常的胆汁酸对机体炎症免疫细胞功能的调控作用尚未阐明。细菌脂多糖(lipopolysaccharide,LPS)是革兰阴性杆菌细胞壁的主要组分之一,是感染后细菌产生毒性反应的主要介质。LPS作为重要的抗原分子被抗原提呈细胞(antigen presenting cell,APC)捕获,从而引起机体的免疫反应。巨噬细胞作为机体重要的APC在LPS的作用下,可显著活化并发生M1型极化[6]。本研究选择肝硬化患者3种主要代谢异常的初级胆汁酸,LPS用于模拟感染时巨噬细胞所处的微环境状态,通过胆汁酸联合LPS刺激巨噬细胞模拟胆汁淤积伴感染的体外模型,初步探究不同胆汁酸在肝硬化伴感染时对巨噬细胞功能的影响,以期为临床肝硬化伴感染患者治疗时维持胆汁酸稳态的重要性提供依据。
1 材料与方法
1.1仪器与设备 SW-CJ-1FD型超净工作台(苏州安泰空气技术有限公司)、Forma3111二氧化碳细胞培养箱(美国Thermo公司)、DMI1倒置显微镜(德国Leica公司)、C100细胞计数仪(山东博科科学仪器有限公司)、ELx800酶标仪(美国Bio-Tek公司)、Cytoflex流式细胞仪(美国Beckman公司)、KDC-1044低速离心机(安徽中科中佳科学仪器有限公司)、HC-3018R高速冷冻离心机(安徽中科中佳科学仪器有限公司)。
1.2药物与试剂 CDCA(美国Sigma公司,货号:C9377)、CA(美国Sigma公司,货号:C1129)、DCA(美国Sigma公司,货号:D2510)、LPS(美国Sigma公司,货号:L2630)、二甲亚砜(DMSO)(Bioforxx,货号:EZ6789B121)、磷酸盐缓冲液(PBS)(Biosharp公司,货号:70115000)、Raw264.7细胞(由实验室刘加涛老师课题组赠送)、RPMI-1640培养基(美国Gibco公司,货号:8120429)、胎牛血清(美国Gibco公司,货号:10270106)、青霉素-链霉素(Biosharp公司,货号:BL505A)、CCK-8(APE×Bio,货号:K101815133EF5E)、PE anti-mouse CD163(美国Biolegend公司,货号:155308)、APC anti-mouse CD86(美国Biolegend公司,货号:105012)、荧光素标记的右旋糖酐(FITC-Dextran,美国Sigma公司,货号:FD40S)、细胞培养瓶(无锡耐思)、96孔细胞培养板(美国costar公司)、6孔细胞培养板(美国costar公司)。
1.3细胞培养 采用含 10% 胎牛血清1640培养基培养Raw264.7 细胞,在 37 ℃,5%二氧化碳(CO2)培养箱中培养至约80%传代。
1.4胆汁酸与LPS配制 分别精密称取CDCA 15.702 8 mg、CA 16.342 8 mg和DCA 15.702 8 mg,加入DMSO 200 μL溶解,配制成终浓度为200 mmol·L-1的母液,分装于200 μL离心管,-20 ℃冻存。使用时用培养基稀释至相应浓度。精密称取LPS 3 mg,加入无菌PBS 6 mL溶解,用孔径0.22 μm微孔滤膜滤过,配制成浓度为0.5 mg·mL-1的母液,分装,置于-20 ℃保存。使用时用培养基稀释至相应浓度。
1.5CCK-8检测细胞活力 取对数生长期的Raw264.7细胞,制成细胞悬液,以每孔2×104接种于96孔板,每孔加入细胞悬液50 μL。将96孔板放在培养箱中培养18~20 h,向孔中加入不同浓度的胆汁酸(25,50,100,150,200,400 μmol·L-1)50 μL,加入等体积培养基作为对照组,放入培养箱中,分别培养4,6和8 h。加入不同浓度的LPS(12.5,25,50,100,200,400,800,1000 ng·mL-1)50 μL,加入等体积培养基作为对照组,放入培养箱中分别培养2,4和6 h,每个浓度梯度设置6个平行复孔,向每孔中加入CCK-8溶液10 μL,将培养板放入培养箱培养1~4 h,用酶标仪检测450 nm波长处吸光度(A值),用A值反映细胞活力。
1.6流式细胞术检测细胞极化 根据CCK-8结果确定胆汁酸和LPS刺激的浓度和时间,分成5组(对照组、DMSO组、LPS组、胆汁酸组、胆汁酸联合LPS组)处理细胞。将培养箱中24孔板取出,收集巨噬细胞1×106个,200×g离心5 min,弃上清液,加入含5%BSA的PBS重悬细胞,200×g离心5 min,弃上清液,加入PBS重悬,向实验组中各加入APC anti-mouse CD86和PE anti-mouse CD163抗体,使CD86和CD163的终浓度分别为1.3和4 μg·mL-1,4 ℃避光孵育30~45 min,加入PBS,200×g离心5 min,重复两次,每管加入PBS 200 μL,流式细胞仪上机检测分析。
1.7流式细胞术检测细胞吞噬功能 将Raw264.7细胞以每孔1×105接种于24孔板,按照上述实验分组处理细胞,24 h后收集细胞,转移至1.5 mL离心管,200×g离心5 min,弃上清液,每个离心管中加入无血清培养基稀释的FITC-Dextran 300 μL,同时设置加入无血清培养基的空白对照组和FITC-Dextran 4 ℃的对照,混匀后将离心管分别放在37 ℃ 5%CO2的培养箱中和4 ℃冰箱中静置90 min,加入PBS,200×g离心5 min,弃上清液,重复3次,加入PBS200 μL重悬,流式细胞仪上机检测分析。

2 结果
2.1LPS对Raw264.7细胞活力影响 结果见图1。与对照组比较,12.5~50 ng·mL-1LPS刺激Raw264.7细胞2 h,对细胞活力没有影响,100~1000 ng·mL-1LPS处理细胞后,显著上调细胞活力。与50 ng·mL-1组比较,100 ng·mL-1LPS处理后细胞活力显著升高,差异有统计学意义(P<0.05)。刺激4和6 h时,25~800 ng·mL-1的LPS处理的细胞活力均升高。100 ng·mL-1LPS在不同的时间点刺激细胞,结果显示与刺激2 h比较,刺激4 h细胞活力显著升高。
2.2CDCA对Raw264.7细胞活力影响 结果见图2。与DMSO组比较,不同浓度CDCA处理Raw264.7细胞4 h时,细胞活力未发生变化。100~400 μmol·L-1CDCA 处理细胞6 h后,细胞的活力显著下降,差异有统计学意义(P<0.05),150 μmol·L-1比100 μmol·L-1CDCA处理组细胞活力下降更为显著。处理8 h时,150~400 μmol·L-1CDCA均可下调细胞的活力。
2.3CA对Raw264.7细胞活力影响 结果见图3。与对照组比较,DMSO处理组细胞活力未发生显著改变,用不同浓度CA处理Raw264.7细胞,4 h时,与DMSO组比较,CA浓度为100和200 μmol·L-1时细胞的活力显著升高,100与50 μmol·L-1CA组比较细胞活力显著升高。处理6 h时,50~200 μmol·L-1的CA处理组的细胞活力均升高;处理8 h时,50~200 μmol·L-1CA组与DMSO组比较细胞活力均升高。
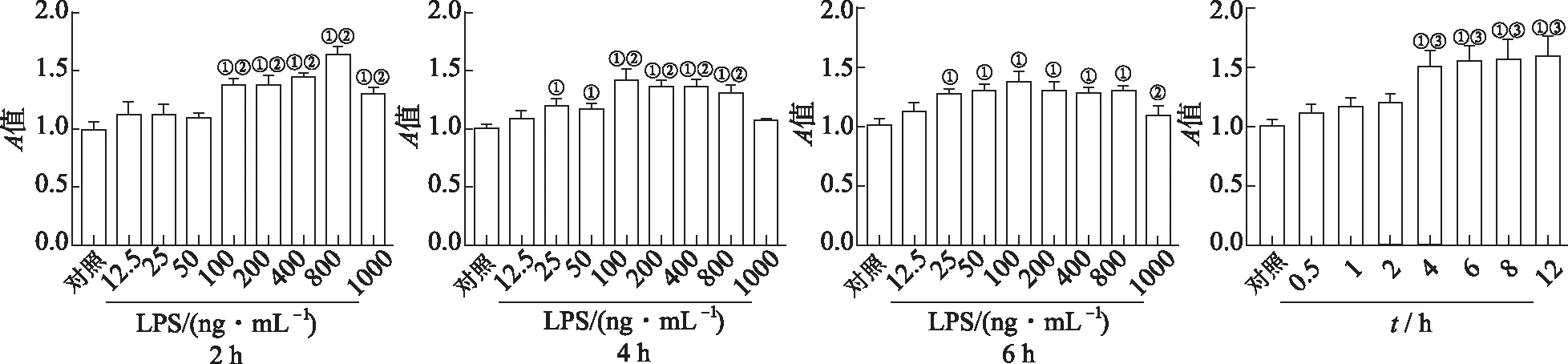
①与对照组比较,t=4.63~15.46,P<0.05;②与LPS 50 ng·mL-1组比较,t=3.32~13.08,P<0.05;③与2 h组比较,t=4.61~6.07,P<0.05。
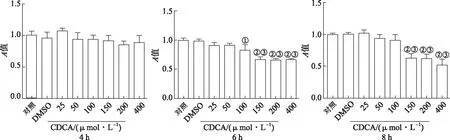
①与DMSO组比较,t=5.83, P <0.05;②与DMSO组比较,t=10.18~13.15,P<0.01;③与CDCA 100 μmol·L-1组比较,t=5.96~10.56,P<0.01。
2.4DCA对Raw264.7细胞活力影响 实验结果见图4。用不同浓度的DCA处理Raw264.7细胞4 h时,与DMSO组比较,200,400 μmol·L-1DCA刺激后细胞活力显著下降,与150 μmol·L-1组比较,200 μmol·L-1DCA组细胞活力显著下降;作用6 h时,150~400 μmol·L-1DCA处理后细胞活力显著下降,差异有统计学意义(P<0.05);作用8 h时,50~400 μmol·L-1DCA处理后均下调细胞活力。
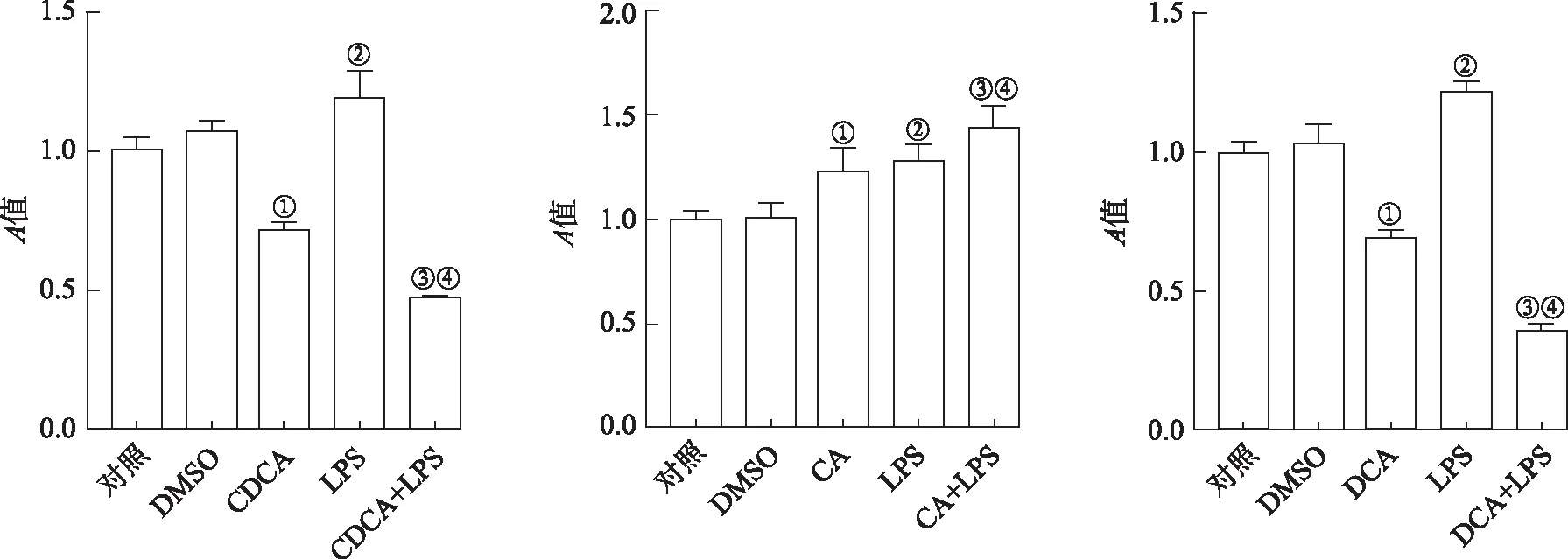
2.5胆汁酸联合LPS对Raw264.7细胞活力影响 根据上述实验结果,选择100 ng·mL-1LPS刺激细胞4 h,用于模拟体外感染。同时分别选择100 μmol·L-1CDCA刺激细胞6 h;100 μmol·L-1CA和200 μmol·L-1DCA分别处理细胞4 h。进一步检测LPS与胆汁酸联合处理Raw264.7细胞,对细胞活力的影响。由图5可知,先用CDCA处理Raw264.7细胞2 h,加入LPS共同培养4 h,模拟胆汁酸淤积的体外模型,与对照组比较,DMSO组细胞活力没有变化,LPS组细胞活力显著增加,与DMSO组比较,经100 μmol·L-1CDCA刺激的细胞活力下降;与CDCA组和LPS组比较,CDCA和LPS联合刺激的细胞活力下降。100 μmol·L-1CA和200 μmol·L-1DCA分别与LPS共同孵育4 h,与对照组比较,DMSO组细胞活力未发生显著变化,LPS处理后细胞活力显著上升;与DMSO组比较,CA组细胞活力上升,DCA处理后细胞活力下降;与CA和LPS组比较,CA与LPS联合处理后增加细胞活力;与DCA组和LPS组比较,DCA与LPS联合作用显著下调细胞活力。
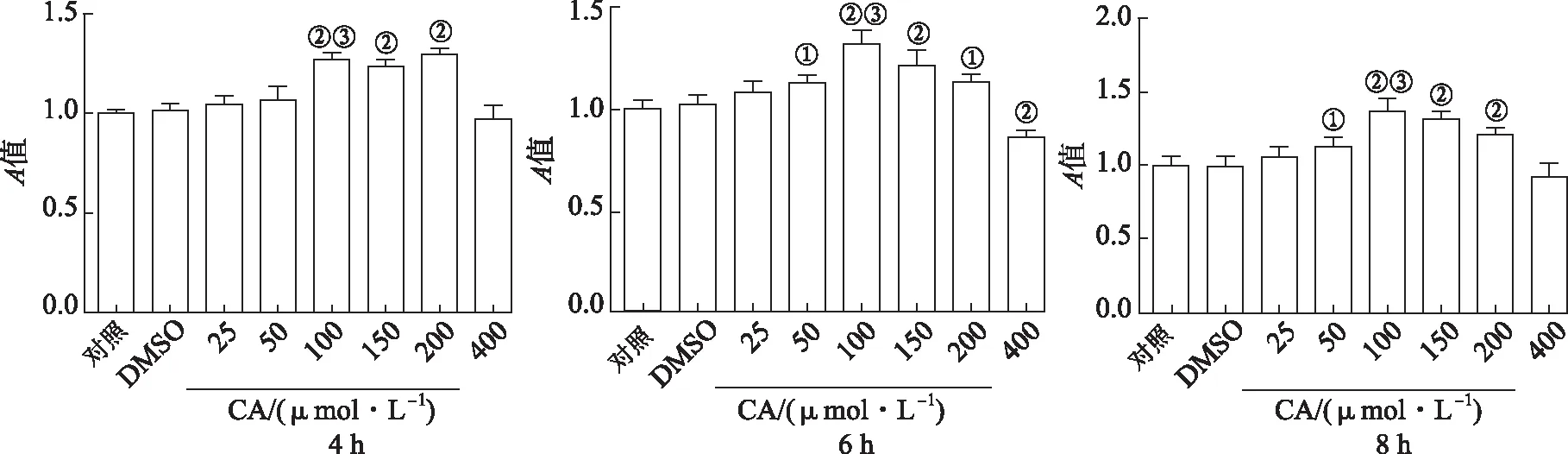
①与DMSO组比较,t=3.59,3.77,P<0.05;②与DMSO组比较,t=5.56~11.31,P<0.01;③与CA 50 μmol·L-1组比较,t=6.10~8.21,P<0.01。
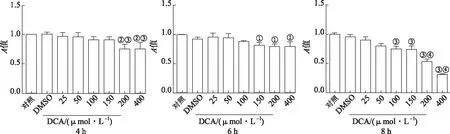
①与DMSO组比较,t=5.70~6.52,P<0.05;②与DCA 150 μmol·L-1组比较,t=3.96,3.97,P<0.05;③与DMSO组比较,t=6.28~16.05,P<0.01;④与DCA 150 μmol·L-1组比较,t=7.86,16.44,P<0.01。
2.6细胞的表型变化 为了进一步研究胆汁酸单独或联合LPS处理对Raw264.7细胞功能的影响,采用流式细胞术检测胆汁酸和LPS刺激的巨噬细胞的表型变化,结果见图6。与对照组比较,单独用胆汁酸刺激细胞的表型未发生变化,差异无统计学意义(P>0.05)。LPS处理后细胞发生M1型极化。胆汁酸与LPS联合作用与胆汁酸单独刺激相比,CDCA和DCA联合LPS可促进Raw264.7细胞发生M1型极化,CDCA和DCA联合LPS刺激与LPS或胆汁酸单独刺激相比可显著提高M1型极化标志物CD86的水平以及M1/M2比值。CA联合LPS对巨噬细胞极化影响不明显。
2.7Raw264.7细胞的吞噬功能 为了进一步研究胆汁酸单独或联合LPS处理对Raw264.7细胞吞噬功能的影响,用流式细胞术检测胆汁酸单独或联合LPS处理后Raw264.7细胞对FITC-Dextran的吞噬情况,结果见图7。与对照组比较,单独用CDCA和CA刺激细胞对细胞吞噬功能没有显著影响,而单独用DCA刺激的细胞的吞噬能力下降,差异有统计学意义(P<0.05),LPS处理后细胞吞噬能力增强。与LPS和相应的胆汁酸处理组相比,CDCA和DCA联合LPS处理显著下调巨噬细胞的吞噬能力,与CA组比较,CA与LPS联合作用使细胞吞噬能力增强。
3 讨论
免疫系统防御病原体,并维持有机体生命的组织稳态,主要由常驻和招募的巨噬细胞参与。CD163是一种在巨噬细胞上特异性表达的清道夫受体,表达上调是巨噬细胞在炎症中向其活化表型M2型转变和清除入侵病原体的标志。巨噬细胞作为专职APC,通过表达CD80/CD86共刺激分子诱导T细胞产生共刺激信号。CD86是M1型巨噬细胞的标志物之一,CD86表达上调提示巨噬细胞发生M1型极化,M1型巨噬细胞促炎细胞因子分泌显著增多,增加巨噬细胞吞噬功能,清除微生物[7]。胆汁酸代谢与免疫调控之间的关系也被广泛研究,FXR和G蛋白偶联受体(TGR5)是胆汁酸重要的受体,FXR和TGR5位于宿主免疫系统中,在固有免疫细胞中表达。胆汁酸作用于巨噬细胞中的FXR和TGR5,参与免疫细胞功能调控,有助于维持机体稳态[2]。
课题组前期研究发现,肝硬化患者体内的胆汁酸代谢谱发生改变,本研究通过体外模拟胆汁淤积对巨噬细胞的影响,选择LPS共同孵育模拟胆汁酸淤积伴感染的环境,以期阐明疾病状态下异常代谢的胆汁酸对巨噬细胞功能的影响。以此评价代谢异常胆汁酸在肝硬化伴感染过程中的重要作用。
实验结果显示,单独用LPS刺激Raw264.7细胞时,100 ng·mL-1LPS在刺激细胞4 h时,细胞活力显著增加,且细胞发生M1型极化,同时细胞的吞噬能力增加。单独用胆汁酸处理细胞时,100 μmol·L-1CDCA刺激细胞6 h后,可下调细胞的活力,对细胞的吞噬功能和表型没有影响。100 μmol·L-1CA在处理细胞4 h后可上调细胞活力,对细胞的表型和吞噬功能均无影响。200 μmol·L-1DCA刺激细胞4 h时,细胞活力下降,对细胞的表型无影响,但可下调细胞的吞噬能力。病理浓度的CA处理Raw264.7细胞对细胞因子的分泌没有影响,而CDCA和DCA可直接激活巨噬细胞的NLRP3炎症小体,发挥促炎作用[8]。FXR和TGR5受体均为胆汁酸受体,通过与胆汁酸相互作用激活多种细胞内信号通路。不同类型的胆汁酸对巨噬细胞中的FXR和TGR5的亲和力不同,其中对FXR受体亲和力的顺序:CDCA>DCA>CA,对TGR5激活能力顺序:DCA>CDCA>CA,胆汁酸激活TGR5和FXR受体后,可抑制免疫细胞功能,如抑制其吞噬和分泌细胞因子的能力。而在感染状态下,LPS介导巨噬细胞FXR表达下调,胆汁酸无法与FXR结合发挥抑炎作用,从而促进了巨噬细胞活化;另一方面,胆汁酸可通过与TGR5结合,诱导巨噬细胞中ROS生成,促进其向M1型转化[8-9]。因此不同类型的胆汁酸对巨噬细胞的影响可能依赖于FXR、TGR5的表达平衡。由此推测,胆汁酸对二者影响不同,可能是本实验中CDCA、 DCA、CA对巨噬细胞活力不同影响的原因。
①与DMSO组比较,t=4.32~14.84,P<0.01;②与对照组比较,t=5.54~9.23,P<0.01;③与胆汁酸组比较,t=4.01~15.42,P<0.01;④与LPS 100 ng·mL-1组比较,t=2.96~37.18,P<0.01。
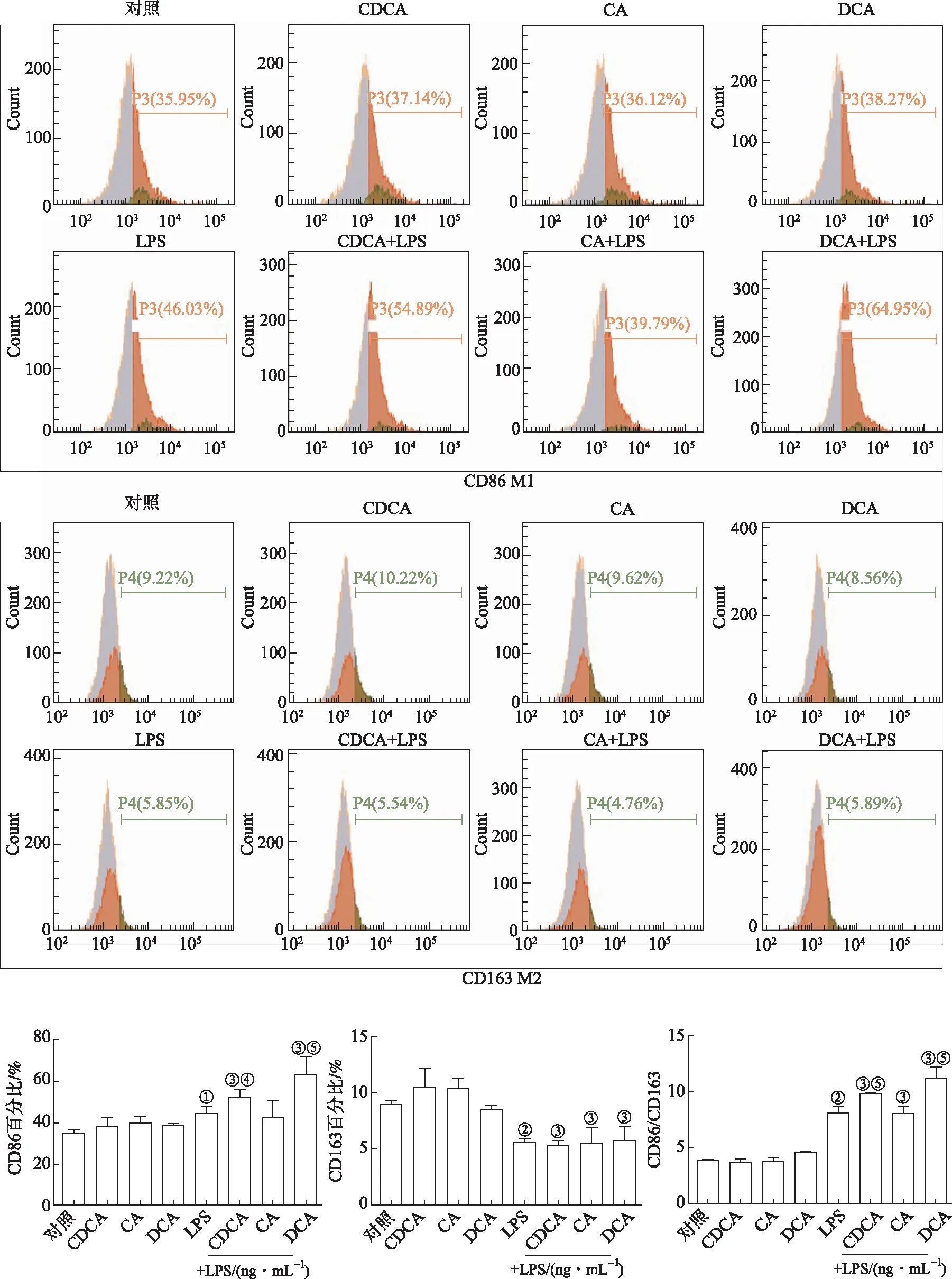
①与对照组比较,t=2.44,P<0.05;②与对照组比较,t=4.23,10.17,P<0.01;③与胆汁酸组比较,t=3.35~16.12,P<0.01;④与LPS 100 ng·mL-1组比较,t=1.86,P<0.05;⑤与LPS 100 ng·mL-1组比较,t=4.35~7.58,P<0.01。

①与对照组比较,t=2.21,P<0.05;②与对照组比较,t=6.69,P<0.01;③与胆汁酸组比较,t=5.23,2.43,P<0.05;④与胆汁酸组比较,t=3.01,P<0.01⑤与LPS 100 ng·mL-1,t=11.53,11.33,P<0.01。
巨噬细胞具有可塑性,根据局部微环境调整其表型,这使得它在损伤的进展和消退过程中发挥多种甚至相反的功能。在肝硬化状态下,M1型巨噬细胞分泌促炎细胞因子,进而加重炎症反应,同时产生活性氧,诱导肝细胞凋亡,加重肝损伤的严重程度;M2型巨噬细胞发挥抗炎和组织修复的调节机制,分泌大量促纤维化因子和转化生长因子,促进肝脏纤维化进程,巨噬细胞的极化状态对肝硬化的进展具有重要的作用[10]。本研究中CDCA和DCA联合LPS处理的巨噬细胞向M1型极化,这可能与在LPS的作用下,FXR的表达下调,促进Ca2+内流,激活NLRP3炎症小体,释放白细胞介素-1β(IL-1β)有关[8]。
有研究发现,与健康对照组比较,肝硬化患者体内巨噬细胞吞噬能力受损,这与肝病严重程度、随后的感染发展和死亡率呈正相关[11]。吞噬和杀死病原体的能力被认为是巨噬细胞的主要功能。肝硬化时,巨噬细胞上Fc和清道夫受体(如CD163)表达下调,用于识别和清除外来病原体的模式识别受体(PRRs)表达受损,使巨噬细胞无法有效清除凋亡细胞、细胞碎片和免疫复合物等[12-13]。本研究结果显示,CDCA、DCA与LPS联合作用下调Raw264.7细胞的吞噬能力,这可能与两者联合作用使细胞活力下降有关。此外文献显示CDCA和DCA可使巨噬细胞的细胞膜和细胞器发生改变,同时产生的超氧化物减少,从而降低细胞的胞饮作用和清除细菌的能力[14]。
综上所述,本研究结果显示,在LPS诱导的体外细胞模型中,3种胆汁酸对细胞活力、极化以及吞噬能力均存在明显改变,提示在病理状态下,胆汁酸参与调控巨噬细胞活力、极化以及吞噬功能。实验表明胆汁酸可能是肝硬化伴感染的潜在治疗靶点,在后期的研究中,仍需要进一步通过体内实验阐明维持胆汁酸稳态对肝硬化并发感染的临床治疗价值。
