白细胞介素-33对巨噬细胞羧酸酯酶作用的体外研究*
2022-06-01李敏徐艳娇张程亮祖越高前艳王熙敏陈云舟
李敏,徐艳娇,张程亮,祖越,高前艳,王熙敏,陈云舟
(华中科技大学同济医学院附属同济医院药学部,武汉 430030)
羧酸酯酶(carboxylesterases,CESs)是一类重要的丝氨酸水解酶,也是重要的I相药物代谢酶,可催化水解内源性和外源性物质,在药物代谢和脂质代谢中发挥重要作用[1]。研究发现在肝脏、肠道、肺脏等器官中CESs高表达[2],在脑、胃、肾、脾等组织中有少量表达[3]。CESs的表达和活性与基因多态性、核受体和疾病等多种因素相关[4-5]。如其活性发生变化,将会影响药物以及外源性毒物的代谢,造成药物蓄积影响用药安全性。
炎性细胞因子对于药物代谢酶的表达和代谢活性的影响多有报道[6-7]。YANG等[8]研究发现,炎性因子白细胞介素(IL)-6可显著抑制人原代肝细胞以及HepG2细胞中CES1和CES2的表达水平和代谢活性。笔者前期研究发现,免疫性肝损伤中多种炎症因子的升高伴随肝脏羧酸酯酶的下降,从而对药物代谢造成潜在的影响[4]。同时还发现溃疡性结肠炎中结肠部位IL-6等炎性因子可以经过门静脉入肝,下调肝细胞的CESs表达和活性[9]。巨噬细胞等免疫细胞也表达CESs,并在药物代谢、胆固醇及脂肪酸代谢和运输过程中发挥重要作用[2,10-11]。巨噬细胞作为几乎遍布机体全身的重要免疫细胞,不仅在免疫方面起着关键作用,还可以维持胆固醇的摄取、酯化和外排的动态平衡[12]。巨噬细胞具有异质性和可塑性,其表型和功能受不同环境影响可极化为M1和M2型巨噬细胞。然而,目前有关炎性因子是否可以调控巨噬细胞CESs笔者尚未见报道。因此,本研究选择前炎症因子IL-33,通过体外处理RAW264.7细胞,探究其对巨噬细胞极化状态的影响和CESs的调控作用。
1 材料与方法
1.1材料 RAW264.7巨噬细胞由华中科技大学同济医学院附属同济医院中西医结合科惠赠;IL-33(PeproTech公司,批号:1106398);胎牛血清(fetal bovine serum,FBS,Gibco公司,批号:16140063);总胆固醇(TC,批号:A111-1-1)、三酰甘油(TG,批号:A110-1-1)、高密度脂蛋白胆固醇(HDL-C,批号:A112-1-1)和低密度脂蛋白胆固醇(LDL-C,批号:A113-1-1)试剂盒购自南京建成生物工程研究所;CCK8细胞试剂盒(MCE公司,批号:68084);小鼠抗CD206抗体(批号:abs141228)、小鼠抗诱导型一氧化氮合酶(iNOS,批号:abs131793)、小鼠抗β肌动蛋白(β-actin)单克隆抗体(批号:abs132184)和小鼠抗受体生长刺激表达基因2蛋白(ST2)抗体(批号:abs132912)购自Absin公司;小鼠抗CES1(Abcam公司,批号:EP1375Y),CES2抗体(RD公司,批号:AF5280)。
1.2细胞培养 将RAW264.7细胞按合适比例分别接种于6孔板和96孔板中,置于含10% FBS的DMEM培养基中,37 ℃、5% 二氧化碳(CO2),95%湿度培养箱中培养。按照实验设计,给予5,10,20 ng·mL-1的IL-33刺激细胞,干预24 h后,收集细胞,提取细胞蛋白和RNA,用于后续实验测定。
1.3免疫荧光实验 将圆形盖玻片预先置于6孔板底,取对数生长期细胞,按合适的密度接种,并在12 h后给予5,10,20 ng·mL-1的IL-33进行干预,培养24 h后取出盖玻片,加入4%多聚甲醛固定15 min,Triton-100通透10 min;1%BSA孵育30 min,加入小鼠抗CD206、小鼠抗iNOS抗体,4 ℃孵育过夜;磷酸盐缓冲液(PBS)清洗3次,加入荧光二抗室温孵育2 h,PBS洗涤后加入DAPI染色剂,37 ℃避光孵育2 h,PBS洗去染料,镜下观察并摄像。
1.4Western blotting检测实验 取对数生长期的细胞以适当密度接种于6孔板中,使用不同浓度IL-33处理细胞。培养24 h后弃上清液,PBS洗涤2次,用Western及IP裂解液提取细胞总蛋白,并测定蛋白浓度。蛋白加入5×上样缓冲液后,于95 ℃加热3 min,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳。
1.5反转录-聚合酶链反应(RT-PCR)的检测 将细胞以适当密度接种于6孔板中,加入不同浓度IL-33培养24 h后,弃上清液,PBS清洗2次,收集细胞,按照TRIzol说明书提取细胞的总RNA,RT-PCR检测细胞M1型标志物IL-1β、TNF-α、iNOS和M2型标志物IL-10、TGF-β、Arg1的表达,各引物序列见表1。PCR反应体系如下:2 μL cDNA、10 μL SYBR Green PCR Master Mix、上下游引物各1 μL、6 μL ddH2O。PCR扩增程序:94 ℃预变性5 min;(94 ℃变性45 s,55 ℃退火45 s)×30个循环;72 ℃延伸45 s,72 ℃,7 min。
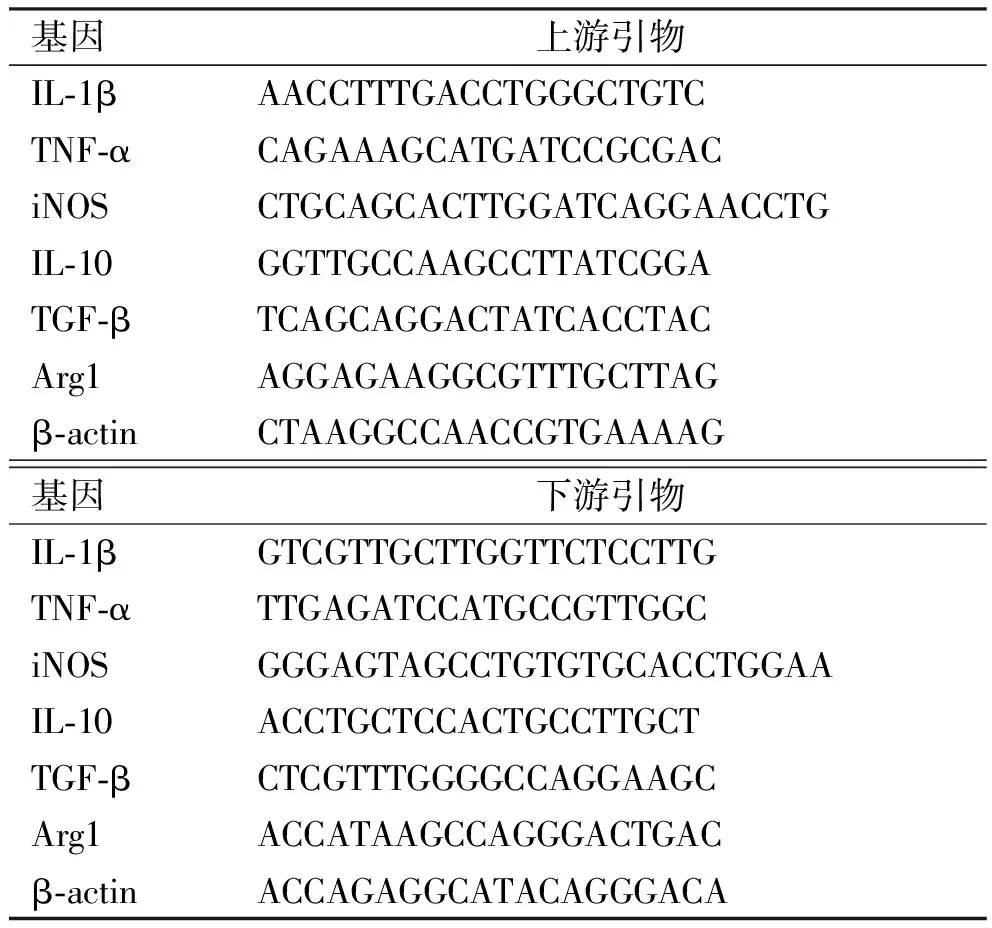
表1 RT-PCR引物序列
1.6CCK-8检测细胞毒性 将RAW264.7细胞接种于96孔板,给予IL-33干预24 h后,分别加入30 μmol·L-1氯吡格雷和伊立替康,置于培养箱中孵育24 h,弃上清液,每孔加入10% CCK-8液100 μL继续培养2 h,每组设置复孔3个。30 min后在波长450 nm处测吸光度(A值),计算细胞存活率,评价细胞CES1和CES2的代谢活性。
1.7油红O染色鉴定细胞脂质沉积情况 以异丙醇溶解并配置质量分数为5%的油红O母液,使用时以油红O母液与去离子水按3∶2混匀即可。制作RAW264.7细胞爬片,以20 ng·mL-1的IL-33干预24 h后,无菌PBS清洗干净后,4%多聚甲醛固定10 min,无菌PBS清洗干净,用60%异丙醇浸洗15 s,油红O染色10 min,体积分数为60%异丙醇分化10 s,去离子水洗净,苏木精染色液染色2 min,洗净甘油封片,于倒置显微镜镜下观察并摄像。
1.8巨噬细胞TC、TG、HDL-C及LDL-C含量测定 将制备的细胞悬液离心,弃上清液,留细胞沉淀,加入PBS进行匀浆。制备匀浆液,按照相应试剂盒说明书分别测定TC、TG、HDL-C和LDL-C的含量。

2 结果
2.1IL-33显著抑制巨噬细胞中CES1蛋白表达水平和代谢活性 不同浓度IL-33干预后,与对照组比较,细胞CES1的蛋白表达水平呈现浓度依赖性下降,差异有统计学意义(P<0.05);而CES2在巨噬细胞中表达微弱,即使经过IL-33处理,其蛋白表达水平无明显变化(P>0.05),见图1。ST2作为IL-33的特异性受体,在多数免疫细胞中都具有一定的表达。通过检测巨噬细胞中ST2蛋白表达发现,与空白对照组比较,10及20 ng·mL-1IL-33处理后表达水平显著升高(P<0.05),提示IL-33可能通过其受体ST2发挥下调CES1的作用。
CCK-8结果也表明IL-33刺激RAW264.7巨噬细胞后显著下调CES1和CES2的代谢活性(P<0.05),见图2。
2.2IL-33刺激后RAW264.7细胞脂质沉积增多 油红O染色显示,IL-33干预后细胞脂质沉积增多,其中20 ng·mL-1的IL-33处理细胞脂滴显著多于空白对照组,结果见图3(红框标记的为巨噬细胞中脂滴数量)。进一步检测细胞TG、TC、HDL-C和LDL-C发现,IL-33导致巨噬细胞TC、TG及LDL-C增多(P<0.05),而HDL-C显著下降(P<0.01),见图4。
①与空白对照组比较,t=2.88,P<0.05;②与空白对照组比较,t=-13.15~-3.07,P<0.01。
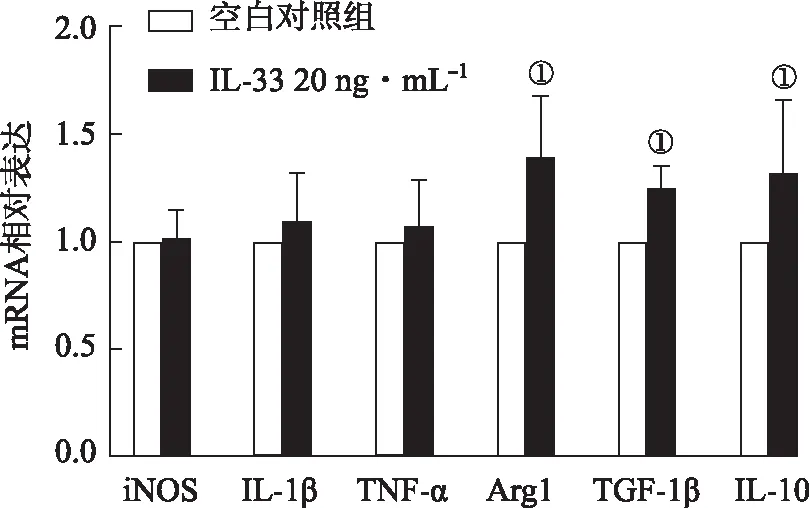
2.3IL-33诱导巨噬细胞向M2型极化 20 ng·mL-1IL-33干预24 h后,其对M1型标志物的mRNA表达差异无统计学意义(P>0.05),而M2型标志物Arg1、IL-10和TGF-β表达显著增多(P<0.05),见图5。进一步进行免疫荧光检测iNOS和CD206(M2型标志物)的蛋白表达,结果发现20 ng·mL-1IL-33刺激后,与空白对照组比较,CD206蛋白表达明显增多,而iNOS蛋白表达无显著变化,见图6。结果表明IL-33干预后诱导RAW264.7细胞向M2型极化。

①与空白对照组比较,t=3.52~3.89,P<0.05。
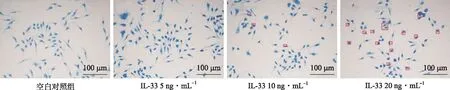
图3 IL-33对于巨噬细胞脂质沉积的影响(n=3)
①与空白对照组比较,t=-3.50~-2.36,P<0.05;②与空白对照组比较,t=11.43~12.06,P<0.01。
3 讨论
炎性因子IL-33属于IL-1家族成员,在细胞或组织初受损时可作为警报素释放[13]。其可通过与免疫细胞表面ST2受体结合诱导免疫细胞释放炎性因子[14],在哮喘、类风湿关节炎、免疫性肝损伤等疾病中发挥重要作用[15-16]。本研究通过IL-33干预小鼠RAW264.7巨噬细胞,研究发现IL-33主要促使细胞分化为M2型巨噬细胞,且下调CES1蛋白表达水平以及代谢活性,抑制胆固醇酯的代谢,造成细胞脂质累积。
巨噬细胞是机体重要的免疫细胞,广泛存在于身体各组织与器官中,参与体内多种生理功能,如维持机体平衡、促进伤口愈合,杀灭外来病原体等。此外,巨噬细胞在维持机体代谢平衡的过程中也起到重要作用。巨噬细胞极化不仅发生在正常生理条件下,还可贯穿疾病的发生、发展以及转归的全过程[17-18]。巨噬细胞极化为M1炎性细胞或M2抗炎细胞不仅在炎症性疾病中发挥重要作用,也参与了许多代谢性疾病、感染、动脉粥样硬化、脓毒症以及癌症等疾病的病理过程[18]。通过免疫荧光以及RT-PCR检测巨噬细胞极化状态标志物发现,M2型巨噬细胞标志物CD206、IL-10等的表达显著升高,而M1型标志物iNOS、IL-1β和TNF-α的表达无显著变化,表明IL-33刺激使巨噬细胞向M2型极化,这一结果与杨笑瑞等[19]研究结果一致。KUROWSKA-STOLARSKA等[20]研究也发现在气管炎中,IL-33协同IL-13促使巨噬细胞向M2型极化,诱导Th2型免疫反应,加速疾病进展。
①与空白对照组比较,t=-4.34~-2.89,P<0.05。
CES1和CES2是研究较为广泛的Ι相代谢酶,CES1在巨噬细胞中有较高的表达。CES1可以调控巨噬细胞中胆固醇的摄取及外排,从而减少细胞中脂质堆积。胆固醇的过量累积不仅是动脉粥样硬化的一大诱因,还将导致肝脏脂肪性病变,而CESs的存在可有效水解胆固醇,缓解疾病[21-22]。氯吡格雷和伊立替康作为CES1和CES2的特异性底物,经过水解后其代谢产物的细胞毒性分别减少和增加,常被用来评价两种CESs的代谢活性[23]。体外细胞毒性实验发现,不同浓度IL-33处理后,氯吡格雷的细胞毒性逐步增加,而伊立替康的细胞毒性依次减少。本研究结果发现给予IL-33显著抑制CES1的蛋白表达和代谢水平。CES2在巨噬细胞中的表达水平较低,IL-33不影响CES2的蛋白表达水平,却显著下调CES2的代谢活性,这一结果提示可能存在其他的蛋白相互作用调控机制。在明确IL-33下调巨噬细胞中CES1的蛋白表达和代谢活性后,通过检测巨噬细胞脂质沉积情况发现,IL-33处理组脂质沉积及脂滴面积显著多于空白对照组。CES1可有效催化水解巨噬细胞中胆固醇酯,增强巨噬细胞中胆固醇逆向转运过程,减少细胞内胆固醇酯的累积。因此,在给予IL-33干预巨噬细胞,观察到CES1的表达和活性下降后进而检测细胞中脂质累积情况。经IL-33处理后的巨噬细胞中TC、TG以及LDL-C水平均显著高于空白对照组,结果表明IL-33下调CES1的表达和代谢活性后抑制了CES1水解胆固醇的功能,造成细胞中胆固醇堆积。巨噬细胞中CES1的表达和代谢活性下降直接影响到脂质稳态,以及药物和毒物的代谢过程,从而影响动脉粥样硬化患者和其他患者的用药安全。
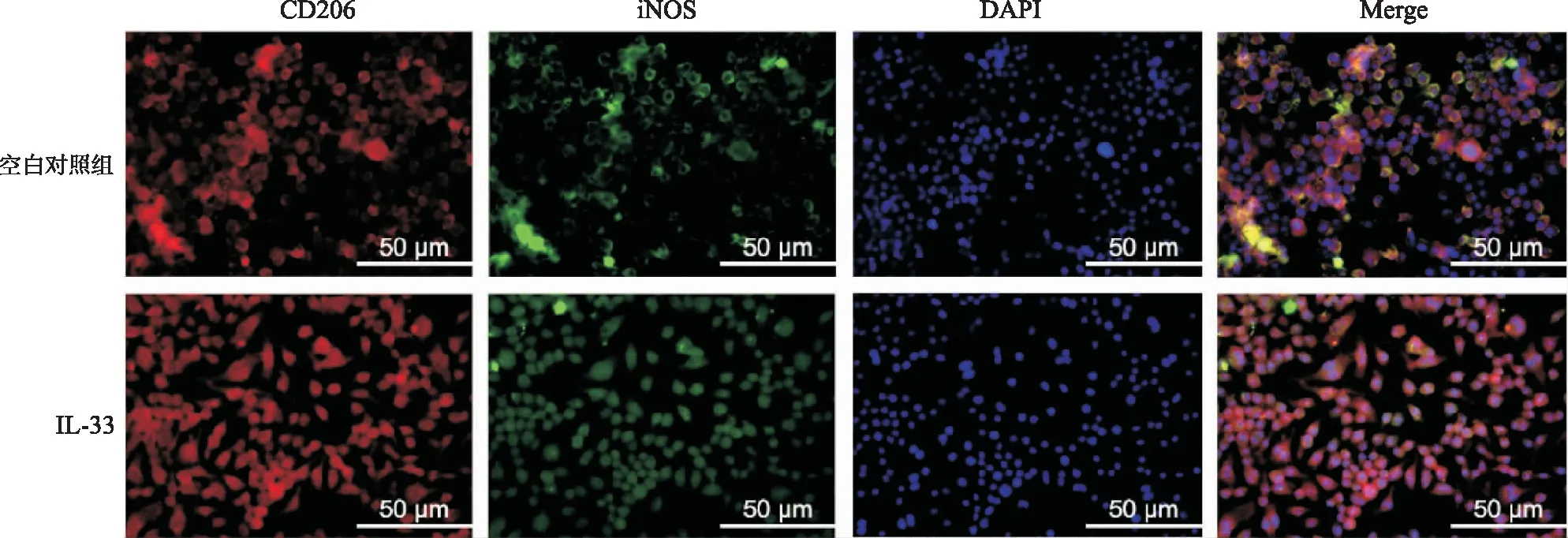
图6 IL-33对RAW264.7细胞CD206和iNOS蛋白表达的影响(免疫荧光细胞化学染色,n=3)
IL-33作为细胞因子主要与其受体ST2结合发挥作用[24]。本研究结果也发现IL-33处理后巨噬细胞中ST2表达显著增多,因此推测IL-33可能通过ST2受体作用抑制了巨噬细胞CESs的表达和代谢活性,但是具体的作用通路还有待未来的深入研究来证实。
本研究表明IL-33显著抑制巨噬细胞中CESs的表达和代谢活性,从而影响细胞中TC、TG等脂质的水解,造成脂质累积,因此可能导致脂质代谢紊乱和药物代谢障碍。本研究结果可为在IL-33大量释放的炎症状态下,对经CESs代谢的药物的疗效和安全性评估,以及动脉粥样硬化和肥胖患者机体脂质代谢评价具有参考价值。
