CGRP和白藜芦醇对脓毒性肾损伤大鼠的治疗作用
2022-06-01杨美宇刘赫迪孙源博于建渤
杨美宇,刘赫迪,孙 蕾,孙源博,于建渤
(1.牡丹江医学院基础医学院;2.黑龙江省肿瘤疾病防治重点实验室;3.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011)
脓毒症主要由细菌感染,导致的急性肾损伤(Acute kidney injury,AKI)死亡率高达28%~90%[1]。脂多糖(Lpopolysaccharide,LPS)是一种由革兰氏阴性菌产生的内毒素,广泛用于构建AKI模型,脓毒症炎性因子产生及释放、肾血流动力学改变和细胞凋亡都参与AKI的发生[2]。降钙素基因相关肽(Calcitonin gene related peptide,CGRP)一种生物活性肽,其具有明显抗炎作用[3-4]。白藜芦醇是一种天然非类黄酮多酚,其也具有抗氧化、抗炎、抗癌及心血管保护等作用[5]。SIRT1(Sirtuin1)可调节多种蛋白质的功能,并证实其在多种肾脏疾病例如AKI中具有保护作用[6]。并有研究显示,CGRP在AKI中可通过增加SIRT1的表达发挥其抗炎作用[7]。而白藜芦醇经证实也是SIRT1有效的化学激动剂[5]。NLRP3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)是炎性小体中研究最多的,其在缺氧、细菌毒素等刺激下会促进Caspase-1、IL-1β炎性因子释放并促进AKI进展,而SIRT1具有抑制NLRP3的作用[8]。本研究通过构建LPS脓毒性肾损伤大鼠模型,检测CGRP和白藜芦醇两种药物对大鼠模型治疗效果;同时研究两种药物是否通过影响SIRT1/NLRP3的表达调节炎性因子释放,从而起到治疗作用。
1 材料与方法
1.1 实验材料
1.1.1 动物 6周龄SPF级雄性SD大鼠,共40只,体重(180~200)g,购于辽宁长生生物有限公司,恒温恒湿[(22±1)°C、(50±1)%],在实验室动物护理设施中进行12 h光照/黑暗循环,可自由获取食物和水。
1.1.2 试剂与仪器 7500实时荧光定量PCR系统购自美国Thermo公司;电热鼓风恒温烘干箱购自上海新苗医疗器械公司;移液器购自德国Eppendorf公司;SpectraMax M3多功能酶标仪购自美国Molecular Devices公司;LPS、CGRP、白藜芦醇、鼠白细胞介素1β酶联免疫吸附检测试剂盒、Western及IP细胞裂解液购自上海碧云天生物技术有限公司;RNA提取试剂盒购自Omega公司;引物购自上海生工生物工程股份有限公司;八连管、逆转录试剂盒购自美国Thermo公司;兔抗鼠β-actin单克隆抗体、SIRT1、NLRP3及Caspase-1购自上海碧云天生物技术有限公司。
1.2 实验方法
1.2.1 建立动物模型 40只大鼠自由摄取食物和水,适应性喂养1周后随机分为四组:以正常饲养未处理大鼠作为对照组;向大鼠腹腔内注射LPS 10 mg/kg建立AKI大鼠模型,即LPS组;CGRP+LPS治疗组:注射LPS前1周及后1 d腹腔注射CGRP 1 nmol/kg;白藜芦醇+LPS治疗组:注射LPS后6 h、12 h分别腹腔注射白藜芦醇15 mg/kg。在所有药物注射完毕后6 h,腹主动脉取血后过量麻醉处死大鼠。
1.2.2 计算肾脏系数及影像学测量肾动脉阻力指数 在大鼠清醒状态下,使用动物超声仪器并选择高频探头,同时利用彩色多普勒超声观察肾内动脉的血流信号及流速情况,测出收缩期峰速(PSV)和舒张末期血流速度(EDV),并计算出肾动脉阻力指数:(PSV-EDV)/PSV。处死大鼠后取出肾脏组织并计算肾脏系数。肾脏系数是指肾脏的湿重与单位体重的比值,通常是每100 g体重中肾脏所占的质量,表为脏器重量(g)/体重(100 g)。
1.2.3 HE染色 取大鼠肾脏组织,将其置于4%多聚甲醛溶液中放置24 h,石蜡包埋,切片5 μm,脱蜡,常规逆梯度乙醇脱水,苏木素-伊红染色,再次顺梯度乙醇浸泡,中性树胶封固,显微镜下观察并拍照。切片机制作石蜡切片,并将石蜡切片放在37 ℃的培养箱中放置24 h。
1.2.4 ELISA IL-1β、肌酐和尿素氮水平使用ELISA试剂盒进行检测。使用酶标仪在450 nm波长处测量吸光度。
1.2.5 Western blot 使用RIPA裂解缓冲液裂解肾组织。使用BCA试剂盒定量蛋白质浓度。通过10%聚丙烯酰胺凝胶(SDS-PAGE),蛋白上样跑电泳,分离后转移至PVDF膜。5%脱脂奶粉室温封闭2 h,加入稀释后的一抗(β-actin、SIRT1、NLRP3及Caspase-1)4 °C冰箱孵育过夜,用TBST液漂洗3次,每次5 min,ECL显影。每个样本重复3次。应用Image J软件分析条带灰度值,计算蛋白相对表达量。
1.3 统计学分析使用SPSS 22.0软件、GraphPad Prism软件通过单因素方差分析和LSD多重检验分析结果,P<0.05为差异有统计学意义。
2 结果
2.1 四组大鼠肾阻力指数、计算肾脏系数情况与对照组相比,LPS组肾脏系数及肾动脉阻力指数增高(P<0.01);与LPS组相比,CGRP+LPS治疗组、白藜芦醇+LPS治组肾脏系数及肾动脉阻力指数减低(P<0.01),差异有统计学意义,见l图1、表1。
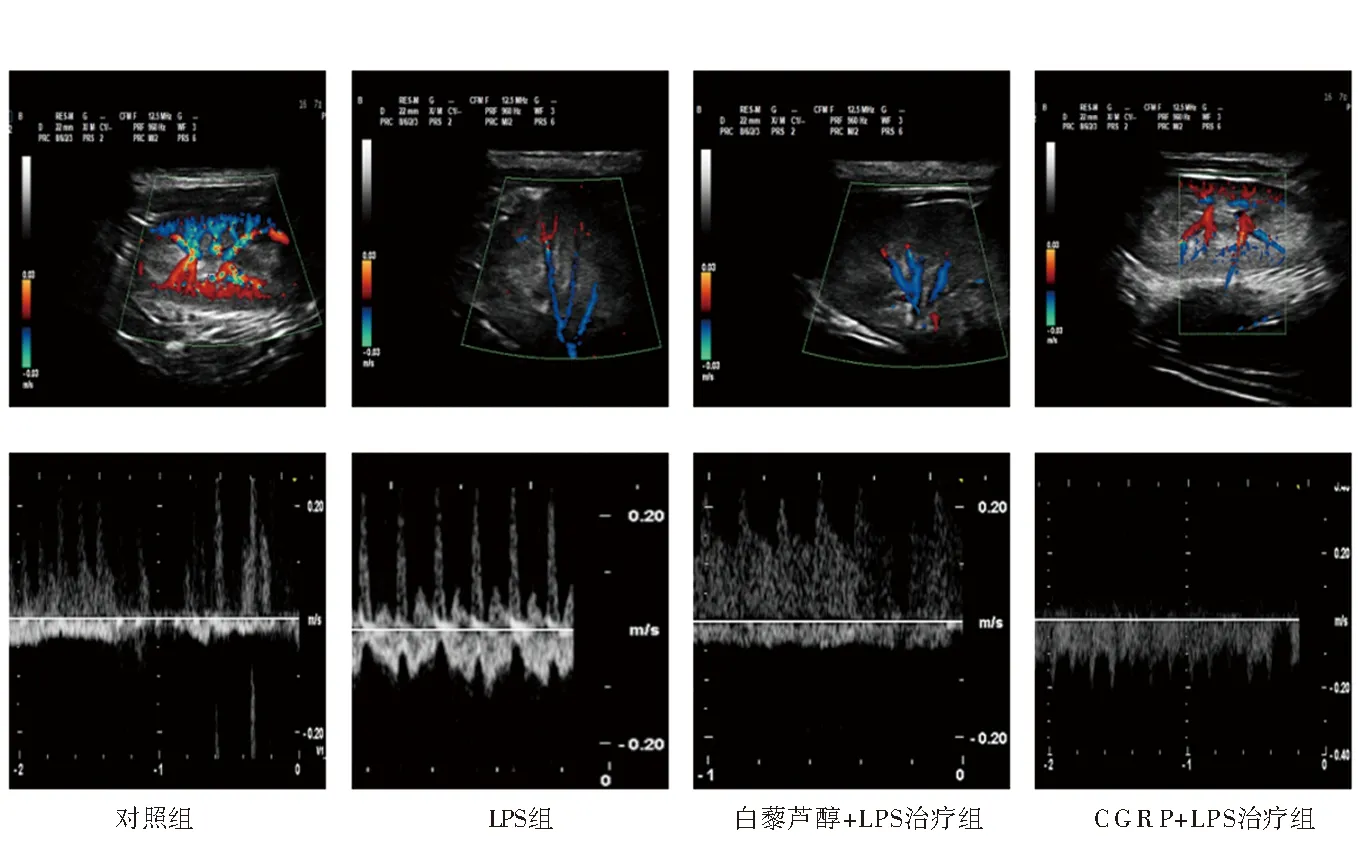
图1 各组大鼠超声影像

表1 四组大鼠肾脏系数、肾动脉阻力指数情况
2.2 四组大鼠肾组织结构变化情况对照组肾小球结构完整;LPS处理的肾组织中肾小球上皮细胞肿胀、间质水肿,肾小管水肿;CGRP和白藜芦醇处理显著减轻LPS 诱导的肾小球和肾小管损伤,见图2。

图2 各组大鼠肾脏HE染色(×200)
2.3 四组大鼠血清肌酐和尿素氮情况结果显示(如表2),与对照组相比,LPS组血肌酐及尿素氮明显升高(P<0.01);与LPS组相比,使用白藜芦醇治疗组,血清肌酐及尿素氮较LPS组有所降低(P<0.05);使用CGRP治疗组血清肌酐及尿素氮较LPS组也有所降低(P<0.01)。

表2 四组大鼠肾血肌酐、尿素氮情况
2.4 IL-1β在四组大鼠血清及肾组织中表达情况结果显示(如表3),与对照组相比,LPS组血清及肾组织IL-1β表达升高(P<0.05);与LPS组相比,白藜芦醇+LPS治疗组血清及肾组织IL-1β表达降低(P<0.05);CGRP+LPS治疗组血清及肾组织IL-1β表达降低(P<0.01)。

表3 四组大鼠血清、肾脏组织中IL-1β(pg/mL)表达情况
2.5 SRIT1、Caspase-1和NLRP3在四组大鼠肾组织中的表达结果显示(如图3、表4),与对照组相比,LPS组中SRIT1表达降低,NLRP3、Caspase-1表达升高;与LPS组相比,CGRP+LPS组和白藜芦醇+LPS组SRIT1表达升高,NLRP3、Caspase-1表达降低。以上差异具有统计学意义(均P<0.01)。
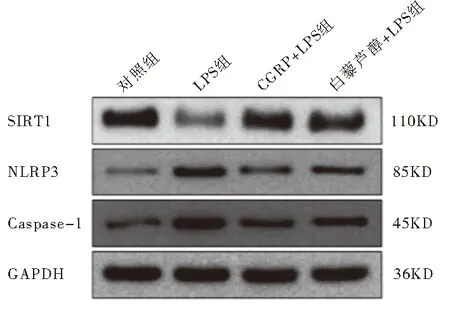
图3 Western blot检测各组SIRT1、NLRP3及Caspase-1蛋白表达情况

表4 四组大鼠肾脏组织SRIT1、NLRP3、Caspase-1表达情况
3 讨论
脓毒血症是由感染引起全身性炎症反应。肾脏是受攻击靶器官之一。脓毒症所致AKI发病机制与肾血流动力学异常、炎症损伤、细胞凋亡和适应性反应密切相关[9]。本研究使用LPS处理大鼠模拟AKI。通过计算大鼠肾脏系数、肾阻力指数以及HE检测发现LPS组肾脏系数及肾动脉阻力指数增高、肌酐和尿素氮明显升高、HE染色显示LPS组肾小球和肾小管水肿损伤。实验证实,经LPS作用大鼠能够较好模拟AKI。
CGRP参与许多生理和病理生理事件[10]。炎症介质和环境因素可以直接刺激CGRP释放。Beihua等发现CGRP预处理可显著改善缺血/再灌注诱导急性肾损伤。CGRP是目前已知最强血管扩张剂,其改善LPS所致急性肾损伤可能是与增加肾血流量、改善肾脏缺血缺氧状态有关。白藜芦醇是一种多酚植物抗毒素并具有抗炎特性,经证实,其对肾脏具有保护作用。本研究通过查阅文献,分别选取CGRP和白藜芦醇的最佳给药方式,旨在研究两种药物是否对AKI大鼠模型起到治疗效果,及可能机制。同时经研究发现,肾阻力指数无论升高还是降低均不利于肾脏灌注,AKI大鼠模型经CGRP和白藜芦醇作用后,肾脏系数及肾动脉阻力指数减低、肌酐和尿素氮降低、HE染色显示肾小球和肾小管水肿损伤情况得到改善。结果提示,CGRP和白藜芦醇能够对AKI起到治疗效果,我们推测两者的治疗作用通过缓解急性肾损伤所致的肾脏灌注不足介导的。
SIRT1在多种肾脏疾病(如AKI)中具有保护作用。可通过抑制促炎性细胞因子释放抑制肾脏疾病进展[11]。NLRP3炎性体是一种新发现的机制,可触发各种炎症反应。SIRT1具有抑制NLRP3炎性体作用[12]。IL-1β是肾脏疾病中重要促炎指标[13],NLRP3炎症小体激活可通过激活Caspase-1后促进IL-1β成熟和分泌。在本研究中,AKI大鼠模型中SIRT1表达降低,NLRP3、IL-1β及Caspase-1表达升高,而使用CGRP和白藜芦醇后逆转上述情况。
综上所述,经过研究证实,CGRP和白藜芦醇对AKI大鼠模型可以起到治疗作用,提示CGRP和白藜芦醇对缓解AKI炎性损伤可能有效。
除此,白藜芦醇和CGRP对AKI治疗作用可能通过调节SIRT1/NLRP3的表达,抑制炎性因子释放,减少炎症反应介导的。另外,本实验有局限性,根据实验结果,CGRP治疗效果似乎优于白藜芦醇,但由于给药时间不统一而无法进行统计学分析,因此无法得知其原因是由于CGRP预防性给药还是CGRP对于AKI治疗效果本身就优于白藜芦醇,这是值得进一步探讨。
