基于增材制造技术的颈动脉仿生血管模型研究现状
2022-05-31陈若梦王成成席晓燕刘晓雯
陈若梦,王成成,陈 静,席晓燕,刘晓雯
(1.唐山学院 a.机电工程学院,b.河北省智能装备数字化设计及过程仿真重点实验室,河北 唐山 063000; 2.沧州市消防救援支队,河北 沧州 061000)
0 引言
2021年12月国家发布的《“十四五”智能制造发展规划》明确提出,智能制造是制造强国建设的主攻方向,其发展程度直接关乎我国制造业质量水平。在此规划的重点任务中,将增材制造技术列在了关键核心技术的首位,由此可见增材制造技术在智能制造中的重要地位。增材制造技术的优势不仅仅体现在智能制造方面,同时在跨学科、跨领域融合创新方面也有着强有力的优势,尤其在人造器官的发展上发挥着很大的作用,其中以增材制造技术为基础的血管化技术是使人造器官“活”起来的关键技术。目前,仿生血管增材制造技术初步解决了微纳米尺度的血管化问题,但是较大尺度的仿生血管制造,仍是未来此项技术的研究难点。
心血管疾病是我国死亡率最高的疾病,占疾病死亡总体人数的40%以上[1-2],相关医疗费用更是每年高达1 100亿元人民币,尽管药物研发和治疗技术不断地发展和改进,但是预测到2030年该疾病的死亡率仍可能达到73%[3]。颈动脉病变是心血管疾病最主要的特征,也是全身动脉病变程度的预测窗口[4-5],从临床需求和生物医学工程角度出发,颈动脉仿生血管模型是研究颈动脉病变及进行药物开发和测试最直观的研究工具,因此,开发颈动脉仿生血管模型从而进行颈动脉病理生理学研究是降低心血管疾病发生率和死亡率的有效手段。
目前,二维细胞培养模型和动物模型是研究颈动脉病理生理学的主要模型。动物模型[6]提供了一个完整的生物环境,但是动物与人类之间的差异限制了动物模型的疾病预测能力。而且,大型动物模型(从狗到非人类灵长类动物)的使用会导致道德伦理和经济方面的问题。相比之下,二维细胞培养模型更加可控,但是由于其结构过于简化,无法再现三维血管的生理特性,使其在颈动脉病理生理学研究方面的意义十分有限。因此,研究能够重现健康或患病的具有生物活性的颈动脉仿生血管模型,对于颈动脉病理生理学的理解和药物的开发具有显著意义。
建立体外具有生物学特性的颈动脉仿生血管模型,需要将医学、材料学和制造学交叉融合,共同实现。近年来,随着交叉学科的不断成熟和血管组织工程技术的发展,出现了一系列仿生血管制造方法,这为体外建立具有生物学特性的颈动脉仿生血管模型提供了技术条件。
1 体内颈动脉结构及其病变原理
颈动脉位于人体颈部两侧,如图1所示,颈总动脉向上分支,分别为颈内动脉和颈外动脉。颈外动脉向喉、舌、面、耳、咽等颅腔外各部分供应血液;颈内动脉垂直上升无分支地到达颅底,然后分支,给眼及颅腔内的脑供血。在颈总动脉末端和颈内动脉起始处的膨大部分,称为颈动脉窦。可见,颈动脉具有特殊的结构特征:弯曲、分叉、直径突变。据研究显示,颈动脉的特殊结构所产生的血液流动形式(紊流和层流共存)既是人体生理的必需,也是颈动脉产生病变的原因之一。
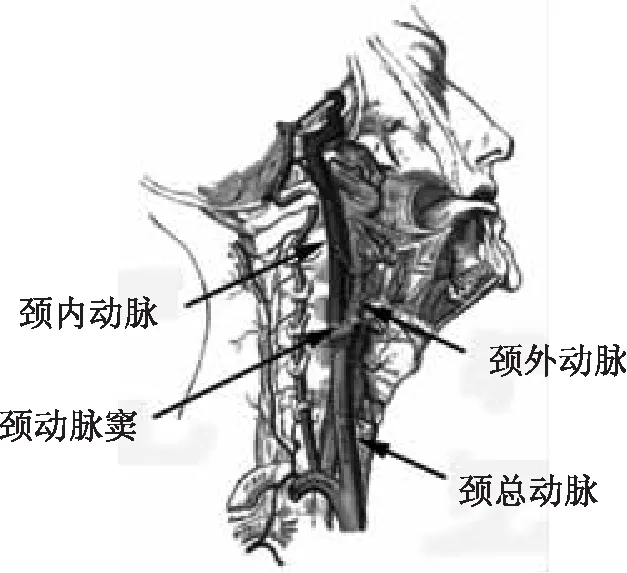
图1 体内颈动脉示意图[7]
根据国内外对人体颈动脉的研究结果可知,其特征尺寸如表1所示。由表1可以看出,颈动脉的直径尺寸在2.5~7.4 mm的较大范围内,属于较大尺度血管,这对于其仿生制造工艺和制造材料有着苛刻的要求。

表1 颈动脉特征尺寸
2 仿生血管增材制造技术的原理
随着不同生物制造工艺以及多种新型材料、复合材料的研发,开发了各种基于增材制造技术的生物制造技术,每种技术都具有独特的优势和应用领域。本文将重点讨论应用在血管组织工程中的仿生血管增材制造技术,主要涉及微制造技术、间接挤出打印技术、直接挤出打印技术、光固化打印技术(SLA)和基于模具制造技术(见图2)。
微制造技术与聚二甲基硅氧烷(PDMS)相结合制造的微流控装置是最早用于研究颈动脉病理生理机制的体外模型,微流控装置易于种植细胞,能够实时成像,并能够检测内皮细胞层在生化或者机械扰动刺激下的反应。

图2 仿生血管增材制造技术
间接挤出打印技术是指使用挤出制造技术将临时材料打印成设计好的三维牺牲模板,之后将牺牲模板包裹在材料内,然后移除牺牲模板,材料中会产生如牺牲模板结构的流道。间接挤出打印技术构建的微流道结构具有较强的力学性能,因此间接挤出打印技术相比直接挤出打印技术具有更加广泛的使用范围。
直接挤出打印技术采用同轴挤出喷嘴,产生独立的流体通道,如图2(c)所示。外喷嘴包含未交联的生物聚合物(例如藻酸盐或壳聚糖),内喷嘴包含相应的交联剂(例如氯化钙或氢氧化钠)。聚合物和交联剂之间界面处的局部交联会产生独立的交联中空通道,其中挤出速率控制通道尺寸。悬浮在预聚物中的内皮细胞被包裹在交联的生物聚合物中并迁移到聚合物的流道边缘,形成内皮单层。因此,直接挤出打印技术可以预制一个内皮化的流体网络。
光固化打印技术是通过在光化学反应中逐层固化液体材料来构建三维结构的。光源在液体起始材料上进行光栅扫描,以将其固化成所需的图案。SLA具有独特技术优势,其分辨率由激光光斑大小或投影仪像素大小决定,因此精度较高,并且避免了由挤压过程中的高剪切应力导致的潜在的细胞损伤/死亡。但是,光化学反应仅限于具有光聚合反应的材料,并且要通过优化打印参数以最大限度地减少光毒性或避免因过度暴露于光引发剂而引起的细胞死亡。
基于模具制造技术最早使用针或杆作为模具,将针或杆从周围的材料中物理移除制造圆柱形通道,从而实现单流道的仿生血管结构。软光刻方法与针模方法相比,具有更复杂的通道排列能力和更高的吞吐量的潜力,是近几年发展起来的模具制造新技术,如图2(e)所示。通常,母版用于水凝胶或弹性体中的模制槽,包含槽的板与第二块板粘合,以创建封闭通道。基于模具制造技术要求材料具有足够的力学支撑,以支持内皮的形成,并能抵抗通道灌注引起的剪切应力和弹性变形。
3 仿生血管增材制造技术的应用
3.1 微制造技术
基于微制造技术构建的微流控装置已在微血管研究中得到了广泛的应用,主要是因为微流控装置能够在二维平面几何状态下对单层血管内皮细胞施加层流,实现在单层剪切应力或其他外部生化和机械扰动实验条件下内皮反应的实时成像。Reinitz等人[8]在2015年使用如图3(a)所示的微流控装置阐明了层流剪切应力在调节内皮细胞形态和排列以及细胞骨架重组和蛋白质/基因表达中的作用。
近年来,研究人员虽然利用微流控模型在一定程度上探索出了颈动脉流体力学刺激内皮细胞的作用机理,但是利用二维平面培养内皮细胞的局限性仍然存在,同时,微流控模型的矩形截面和相对简单的结构不能呈现颈动脉真实的流体力学特性。因此,一些研究人员在微流控模型上作了一定程度的改进。比如,Park等人[9]2020年使用改良的圆形截面微流控装置(如图3(b)所示)研究了层流剪切应力对内皮细胞层生成萌芽直至血管的影响,实验结果比较接近于真实血管中内皮细胞层在力学作用下的状态。

图3 微流控模型[8-9]
3.2 间接挤出打印技术
Dai课题组[10-11]是最早使用间接挤出打印技术构建仿生血管模型的,该研究团队使用明胶作为牺牲模板,在胶原水凝胶中构建了单轴微流体通道(见图4)。主要工艺原理是将明胶纤维包裹在胶原基质中,通过明胶的温敏作用牺牲模板,产生开放的单通道流道以支持流体灌注。此研究团队构建的单轴微流道模型可承受10 dyne/cm2的剪切应力,具有研究三维流动条件下血管功能和血管生成的潜力。
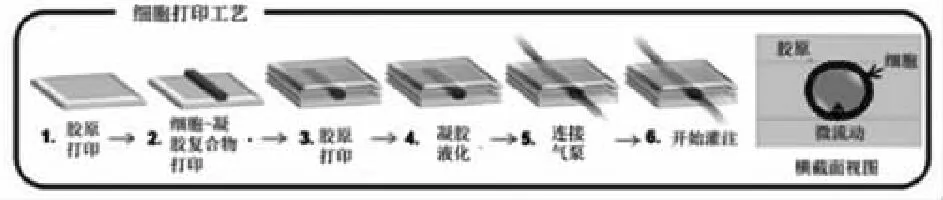
图4 间接挤出打印技术构建 单轴微流道模型[11]
随着间接挤出打印技术的发展,水凝胶分叉微流道模型被制造出来。Christensen团队[12]将藻酸盐液滴喷射沉积到氯化钙支撑浴中,成功构建出分叉流道结构,如图5(a)所示。氯化钙溶液用作藻酸盐的离子交联剂并为分叉流体网络结构提供浮力,从而支持形成复杂的突出结构和跨越结构。所构建的分叉流道直径3 mm,壁厚1 mm,这是最接近颈动脉结构的流道模型。Bertassoni及其同事[13]利用琼脂糖材料制备牺牲模板,在牺牲模板周围灌注水凝胶,琼脂糖在真空下可除去,从而产生开放的可灌注的流道,流道直径范围为250~1 000 μm,如图5(b)所示。在此流道内接种内皮细胞可增殖并形成成熟的内皮层。Lewis等人[14]使用间接挤出打印技术制造出如图5(c)所示的不同直径、不同形状的分叉流道结构,流道直径范围为0.9~2.5 mm。中国科学院团队[15]采用新型材料Pluronic F127作为牺牲模板材料,并在其周围灌注水凝胶,之后去除牺牲模板形成流道,该方法构建的流道直径在1 mm左右,如图5(d)所示。
以间接挤出打印技术构建分叉流道具有较大的灵活性,对制造材料的要求较低,因此此技术有着更加广泛的应用空间,而且具有构建分叉、大尺度直径流道的能力,但是此技术打印的流道直径受限于挤出装置尺寸及挤出速度,是否可以制造直径突变的流道结构,还有待进一步研究。

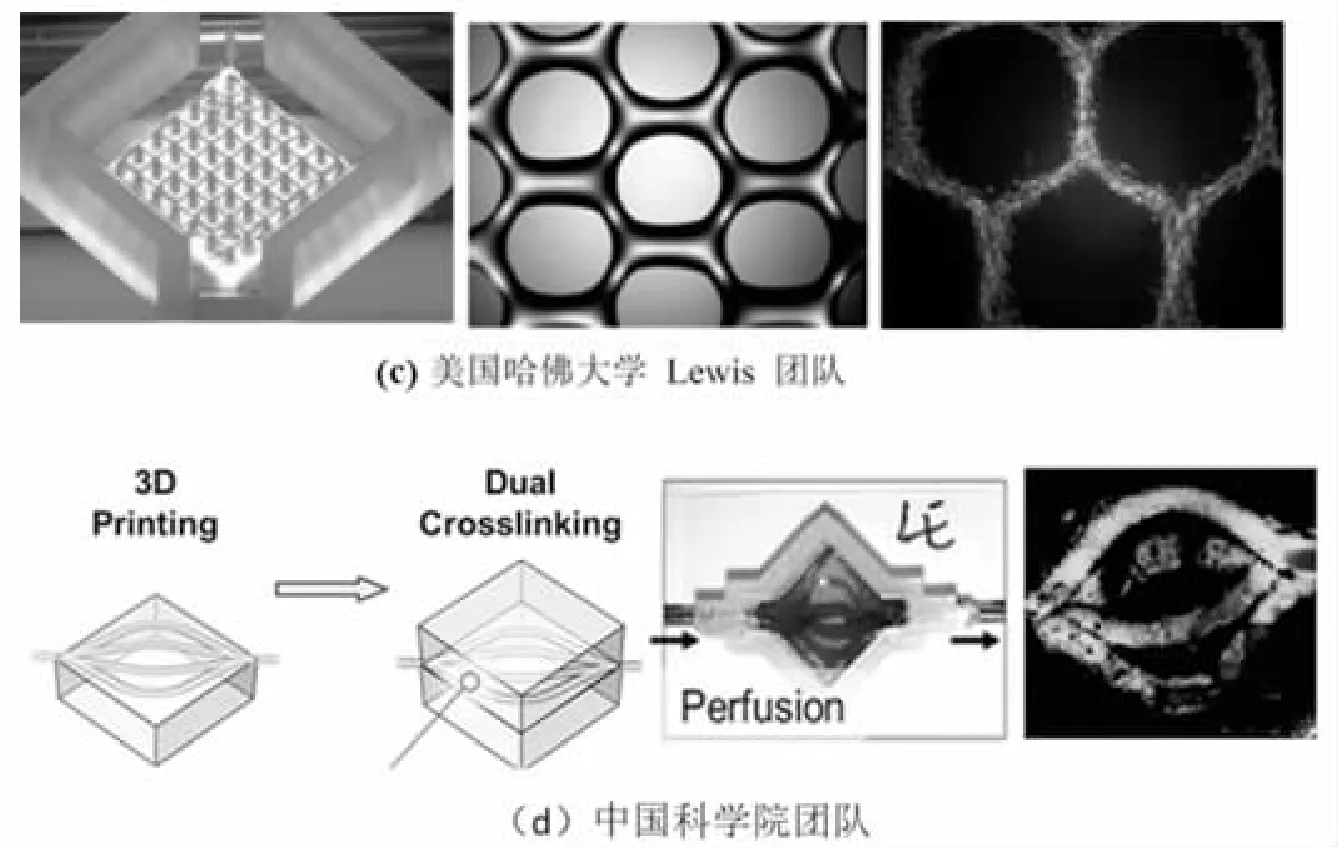
图5 间接挤出打印技术构建分叉流道模型[12-15]
3.3 直接挤出打印技术
直接挤出打印技术是同轴喷嘴直接挤出的打印方式,可打印出具有中空结构的水凝胶流道。Ozbolat及其团队[16-17]使用直接挤出打印技术打印出独立的海藻酸盐流道(如图6所示),流体能够在此流道内传输,同时该团队还尝试打印出了分叉结构。直接挤出打印技术制造的分叉结构的水凝胶流道尺度不能过大,否则会在自身重量作用下产生闭塞或有闭塞的趋势而影响流道结构,而且同轴打印方式受打印喷嘴结构的限制,无法形成直径变化的流道结构。

图6 直接挤出打印技术实物[16]
随着生物材料技术的发展,直接挤出打印技术实现了多分叉流道的打印。这种在流变学上表现为Bingham塑性流体特性的生物材料,在施加的剪切应力超过其阈值时,会从固态静止状态被诱导成流化状态。2015年,Bhattacharjee及其同事[18]使用这种生物材料,混合挤出PDMS、光反应性聚乙烯醇(PVA)和胶原,PVA在打印后交联,并通过浸入水中将这种特殊的生物材料溶解来形成复杂的完全交联的网络结构。使用该生物材料,通过直接挤出打印技术可形成高度复杂的结构,包括多级分叉流道结构,如图7所示。Bingham塑性流体特性的生物材料与直接挤出打印技术结合,具有构建异质内部结构的潜力,但是这个制造过程较为复杂,尤其是在打印材料的制备上,需要大量时间和较高的经济成本,难以在颈动脉仿生血管模型制造方面得到普遍应用。

图7 直接挤出打印技术构建 多级分叉流道结构[18]
3.4 光固化打印技术
随着制造技术和人工合成生物材料的发展,光固化打印技术在构建分叉血管结构方面显示出了技术优势。最早是由Arcaute及其同事[19]使用此技术打印了PEGDA水凝胶定制化的分支通道(如图8(a)所示),显示了光固化打印技术制造分支流体网络架构的潜力。Meyer及其同事[20]在2012年采用光固化打印技术制造了聚合物分叉流道结构,即以其最高分辨率制造出了管腔直径18 μm和壁厚小于5 μm的分支管结构(如图8(b)所示)。浙江大学团队[21]利用PEGDA水凝胶,在光固化条件下构建出多尺度(10 μm到10 mm)的多级分叉仿生血管网结构(如图8(c)所示),并且实现了细胞在仿生血管中的粘附繁殖,这是血管构建技术的一个重大突破。以上研究证明了高分子材料在光固化打印技术下构建血管分支通道的潜力,但由于人工合成聚合物材料存在生物相容性的问题,因此这类研究在血管化方面仍然具有空间。

图8 光固化打印技术构建分叉流道模型[19-21]
基于明胶材料的明胶丙烯酸甲酯(GelMA)实现了天然高分子生物材料在光固化制造工艺上的应用。如图9(a)所示,Miri团队[22]使用DMD光固化打印方式,成型出类似肿瘤的毛细血管形态。Tien团队[23]采用了同样的制造技术和材料构建了如图9(b)所示的分叉仿生血管结构。该工艺方法成型的仿生血管尺度较小(一般小于200 μm),在成型较大尺度流道方面并未见相关报道。

图9 光固化打印技术与天然高分子生物 材料结合构建分叉仿生血管模型[22-23]
3.5 基于模具制造技术
失模铸造法是基于传统制造工艺的模具制造技术,采用失模铸造法制造的PDMS颈动脉模型完美解决了颈动脉完整几何结构的制造问题,如图10所示。Martorell等人[24]利用计算机模拟技术重构了颈动脉模型的几何结构,使用传统失模铸造法制造出如图10(a)所示的颈动脉体外模型。Tamie团队[25]利用同样的方法,制造出如图10(b)所示的颈动脉模型。利用此技术构建的颈动脉模型可以承受流体产生的力学刺激,同时具有优良的通透性,便于后期显微镜观察,因此在研究颈动脉结构中流体状态及剪切应力时多被应用,但是由于PDMS不具有生物相容性,因此无法构建内皮化的颈动脉仿生血管模型。

图10 PDMS颈动脉模型[24-25]
早期应用天然高分子材料基于模具的流道制造工艺是使用针或杆作为模具来制造圆形截面流道,通过将针或杆从生物材料中物理移除获得流道。Thomas研究小组[26]提出了以针为模具的水凝胶微流道成型技术,如图11所示,围绕一根或多根钢针灌注水凝胶,去除钢针后便在水凝胶中产生可灌注的通道(75~150 μm)。Price等人[27]使用此工艺方法制备了胶原微流道,并验证了内皮细胞层在不同剪切应力作用下的渗透性能和细胞功能的变化。Chrobak等人[28]同样采用此工艺方法制备了胶原微流道,在剪切应力10 dyne/cm2的作用下,证明了内皮细胞层在力学刺激和生化刺激共同作用或单一作用下细胞功能的变化。
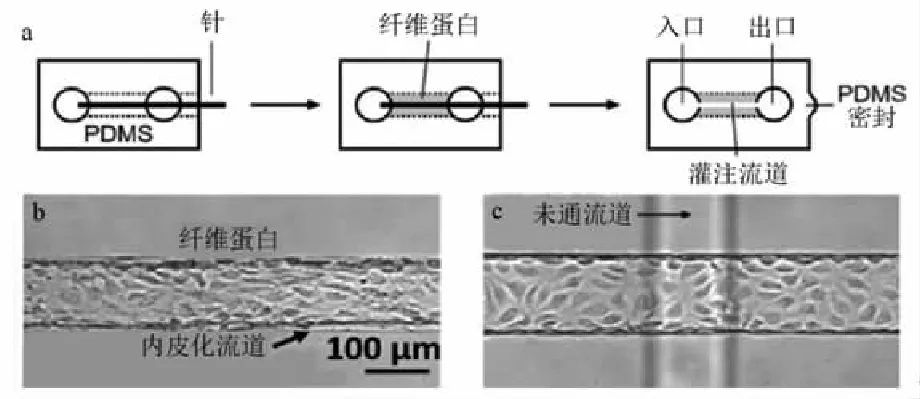
图11 以针为模具的微流道成型工艺[26]
以针为模具的水凝胶微流道成型技术操作简单,而且几乎与所有天然或合成的聚合物生物材料都具有兼容性。应用以针为模具的水凝胶微流道成型技术制造的微血管已经用于血管生物学的相关研究,并证明了此技术在仿生血管制造领域的可行性。但是,因为以针为模具制成的微流道系统受限于单轴通道阵列,所以此技术还不能构建具有分支结构的脉管相关模型。
基于光刻工艺模具的水凝胶成型技术制造的水凝胶微流道具有更复杂的流道结构。通常,制造过程是经光刻形成的模具用于在水凝胶中制成不封闭的流道形态,然后将不封闭的流道形态的水凝胶粘合到无此结构的水凝胶片上以形成封闭的通道。华盛顿大学Zheng等人[29]使用光刻技术制造了硅橡胶模具,然后用其在天然胶原基质中形成内皮化微流体血管,如图12(a)所示,同时他们研究了在剪切应力(0~10 dyne/cm2)作用下的内皮形态,证明了内皮细胞在力作用下具有血管生成活性,展示了微流体和仿生血管模型在炎症、血栓和其他病理的潜在相关性。仿生血管模型在病理研究方面的成功表明了该类模型在心血管生物学和病理生理学研究方面的广泛潜力。西安交通大学团队[30]使用硅橡胶模具构建了酶交联明胶的复杂的分叉流道结构,如图12(b)所示,而且研究了内皮细胞内皮化后对血管的屏蔽作用。
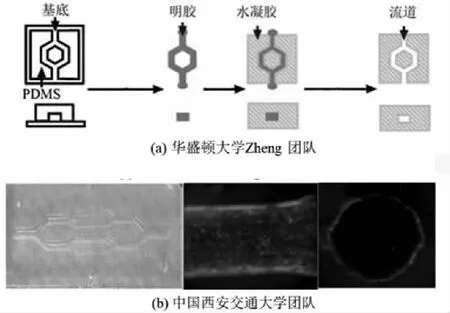
图12 基于硅橡胶模具的微流道成型工艺[29-30]
基于模具的分叉流道的构建具有较高的力学强度,可以承受流道内部液体流动所产生的压力,而且此工艺方法对于材料的选择具有较大空间。同时此工艺方法操作简单,成本较低,适用范围较广。而且到目前为止,基于模具制造技术已经成功制造出具有圆形截面的分叉结构流道。
4 讨论
基于上述对国内外构建流道的制造材料和制造工艺的总结分析,发现制造具有圆形截面分叉结构的仿生血管是迄今为止生物制造技术达到的最大复杂程度,但是此技术在构建较大尺度的复杂几何结构的颈动脉仿生血管模型上还有待发展。
在材料方面,微流控装置制造工艺主要采用的成型材料为硅橡胶,硅橡胶的微观结构和弹性模量与细胞外基质存在很大的差异。Ding等人[31]研究表明,动脉粥样硬化的开始和发展与细胞外基质的弹性模量有着密切的关系。因此,内皮细胞附着的基质材料需要具有与细胞外基质相似的力学性能和微观结构。水凝胶已经被证实具有和细胞外基质相似的力学和生物学特性,对维持内皮细胞的形态和功能有积极作用[32-34]。但是水凝胶具有不稳定的化学物理性质,对成型工艺有着较为苛刻的要求,因此相关的仿生血管增材制造技术多是根据生物水凝胶材料成型特性研发出来的。本文中涉及的这五种技术均可以实现对水凝胶组织工程血管的构建,其中间接挤出打印技术和基于模具制造技术在水凝胶分叉血管结构的构建方面较为成熟,对于构建水凝胶颈动脉仿生血管模型具有一定的潜力。
在制造技术方面,微流控模型的制造一般采用光刻技术,但是光刻技术制造的微流体模型其截面形状为矩形截面,而非与人体血管相似的圆形截面。矩形截面的刚性拐角使流道内部流体形态与人体血液流体形态存在较大差异,而且,矩形流道会产生不均匀的壁面剪切应力,导致内皮细胞受到异常流体的机械刺激[35],无法真实地模拟颈动脉系统的血流紊乱情况。值得注意的是,血流紊乱和内皮早期的功能障碍通常相伴而生,这两者也被证明是心血管疾病的并发症[36]。虽然,Zheng等人[29]观察到在矩形流道内接种的内皮细胞可使流道矩形横截面重新形成椭圆或圆形横截面,减轻矩形截面产生异常流体的问题,但是,这种矩形截面到圆形截面的重塑效果取决于水凝胶材料的刚度,这在研究中尚未完全表征。现有的微流控装置也在持续改进,已制造出与人体血管中内皮细胞生长于血管内表面相似的三维状态装置。
直接挤出打印技术、光固化打印技术和基于模具制造技术都可以构建圆形截面的仿生血管微流道,这三种技术构建的仿生血管微流道均表现出从单通道流道形态到分叉流道形态的发展轨迹。但是这些制造技术在构建颈动脉仿生血管模型结构方面还存在各自的不足。直接挤出打印技术在打印直通流道方面具有很高的灵活性,但是在打印微流道时其主要问题是流道直径在其自身重量下容易闭塞或有闭塞的趋势。颈动脉的直径范围为2.5~7.4 mm,属于较大尺度血管,无法通过直接挤出打印技术使生物材料成型。直接挤出打印技术的缺陷可以通过添加支撑材料或牺牲模板来克服,这也就形成了间接挤出打印技术。间接挤出打印技术成功制造出了具有圆形截面的分叉结构仿生血管流道,但是流道直径受限于挤出打印头的尺寸,无法构建直径突变的流道形态。另外,间接挤出打印技术构建的分叉流道在动态培养方面没有相关报道,因此利用此技术成型的仿生血管流道可承受的流体作用力的范围尚不可知。光固化打印技术具有精确成型的特点,但是此技术制备的仿生血管微流道主要集中于小尺度仿生血管,囿于工艺成型面积和材料力学性能,到目前为止未应用于大尺度血管的构建。颈动脉结构不是由孤立的血管组成的,而是具有分支结构,因此也不能通过以针为模具的水凝胶微流道成型技术构建。牺牲模板法给了很好的帮助,牺牲模板并不仅仅与间接挤出打印技术相关,还可用在基于模具的水凝胶流道构建中制造复杂的流道几何结构。现在应用已经开发出的基于光刻技术制备的硅橡胶模具和基于硅橡胶模具制备明胶牺牲模板的制造方法制备的水凝胶流道均具有较为复杂的流道结构,因此这些方法也具备制造具有弯曲、分叉和直径突变等结构特征的流道形态的能力。
在灌流培养方面,微流控模型主要采用PDMS材质制成,该材质具有较高的力学特性和稳定的化学物理特性,尤其在耦合动态灌流系统时表现出水凝胶不可比拟的可操作性,但是其对内皮细胞功能表达具有一定的影响,因此不用于颈动脉仿生血管模型的构建。挤出打印技术和基于模具制造技术制造的水凝胶组织工程血管具有良好的力学性能,能够承受较大范围的流体力学刺激,这促进了研究人员对流体力学刺激和生化刺激下内皮细胞间相互作用的理解。但是挤出打印技术用于流体力学研究的流道多为单通道流道,而基于模具制造技术制造的多级分叉结构的水凝胶流道用于流体刺激研究的多是单一进出口结构。到目前为止,尚未有分叉结构用于流体力学刺激研究的相关报道,可见分叉结构在耦合动态灌流系统时还存在一定的困难。
5 结论与展望
本文分析了具有构建颈动脉仿生血管模型潜力的仿生血管增材制造技术,主要涉及微制造技术、间接挤出打印技术、直接挤出打印技术、光固化打印技术和基于模具制造技术。仿生血管增材制造技术已经成功地制造出PDMS颈动脉结构模型,具有圆形截面的分叉结构是目前构建的水凝胶类仿生血管的最复杂形态,也是最接近颈动脉形态的水凝胶类模型。其中基于模具制造技术构建的水凝胶流道具有良好的力学特性,同时也可以用于制备具有圆形截面并具有弯曲、分叉和直径突变等结构特征的流道形态。
但是要构建与临床相关的颈动脉仿生血管模型,现有技术不仅要实现仿形而且还有待进一步提高其仿生能力。仿形可满足颈动脉血管的流体力学性能,而实现颈动脉特定的仿生性能则需要进一步优化现有的水凝胶/细胞复合材料,设计出与颈动脉血管相同的特定类型的细胞排列层。此外,制造规模化的临床血管化颈动脉模型还需要进一步提高制造技术的吞吐量和速度。应该相信,随着仿生血管增材制造技术和相关材料的发展,将来肯定会制造出颈动脉仿生血管模型并实现临床应用。
