β-catenin和PD-L1在非小细胞肺癌的表达及其临床意义分析
2022-05-31林允斌李小霞卢爱薇卓德祥朱虹罗碧琚陈龙肖首浩
林允斌 李小霞 卢爱薇 卓德祥 朱虹 罗碧琚 陈龙 肖首浩
肺癌是全球最常见的恶性肿瘤之一,不论在病死率还是在恶性肿瘤死因构成比中,肺癌都呈现逐步上升的趋势[1]。按组织学分类,肺癌分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC占肺癌总数的80%[1],且恶性程度较高。目前,NSCLC的治疗方式主要包括手术治疗、放疗、化疗以及分子靶向治疗[2],手术切除是目前肺癌较为常见的常规治疗方法,然而对于晚期无法手术的NSCLC患者,以铂类为基础的化疗仍然是治疗的主流,尽管铂类化疗和靶向治疗显示出优越的治疗效果,但二者存在耐药或者基因突变阴性等治疗的局限性,且非小细胞性肺癌的5年生存率仍仅为4%~17%,肺癌的早期诊断和治疗是临床医生和科研工作者共同面对的难题,尤其是难治性NSCLC患者的新疗法仍亟待挖掘[3-4]。近几年来,继肿瘤分子靶向治疗之后,肿瘤的免疫治疗成为新的热点,其中以程序性死亡受体1(programmed cell death-1,PD-1)及其配体程序性死亡配体1(programmed death ligand-1,PD-L1)为免疫抑制点的免疫治疗药物在临床药物试验中显示了较好的疗效和耐受性[5-6],肿瘤细胞高表达的PD-L1和免疫T细胞表面的PD-1结合后抑制机体的免疫应答,促进了肿瘤的进展和转移,通过阻断PD-1/PD-L1通路,可恢复机体的抗肿瘤免疫,达到肿瘤免疫治疗的效果[7]。Wnt信号通路广泛参与人类肿瘤的发生发展和肿瘤耐药[8-10]。近年研究表明,Wnt信号通路参与了肿瘤的免疫逃逸,从而减弱了免疫治疗的效果[11-12]。国内外已经对肿瘤中多种信号通路调控PD-L1的表达做了详细的研究,Lorenzo等[13]的研究表明,在三阴性乳腺癌中,Wnt信号通路参与了PD-L1的表达调控,但是在NSCLC中Wnt信号通路对PD-L1的调控尚无报道。本研究旨在通过实时荧光定量PCR和免疫组化的方法研究非小细胞癌中β-catenin和PD-L1mRNA和蛋白质的表达,分析二者之间表达水平的关联,探讨NSCLC中Wnt/β-catenin信号通路参与调控PD-L1的表达进而影响NSCLC的免疫调节的可能性,并为PD-L1抗体在NSCLC的治疗提供新的思路。
1 资料与方法
1.1 临床肿瘤标本
本研究NSCLC肿瘤组织标本来源于2016年1月—2019年1月在三明市第一医院接受手术治疗的NSCLC患者。手术离体肿瘤组织标本和对应癌旁组织标本使用10%福尔马林固定,石蜡包埋。本研究经三明市第一医院医学伦理委员会批准,患者签署知情同意书。
1.2 实时荧光定量PCR(RT-qPCR)
组织总RNA提取按照Trizol(Invitrogen)试剂说明进行。总RNA 2 μg反转录为cDNA并进行实时定量PCR检测。引物如下:β-catenin(up)5′ -CTGCGAGGAGAAGATGGTTA-3′,β-catenin(down)5′ -CTTTGCACAAGTCTCCCAAC-3′;PD-L1(up)5'-CTGCATGATCAGCTATGGTGGTG-3',PD-L1(down)5'-CAGTTCATGTTCAGAGGTGACTGGA-3';GAPDH(up)5′-AGAAAAACCTGCCAAATATGATGAC-3′。基因的表达变化用2-ΔΔCt法计算,GAPDH为内参。
1.3 免疫组化
将甲醛固定的石蜡切片先后经二甲苯脱蜡、分级酒精水化,微波中档修复10 min,3% H2O2阻断内源性过氧化酶15 min,5%正常血清37℃封闭30 min,一抗4℃孵育过夜(PD-L1抗体1∶25稀释,β-catenin抗体1∶3 000稀释),辣根过氧化物酶标记二抗37℃孵育30 min,使用新鲜配制的DAB显色,显微镜下观察结果,细胞浆、细胞膜或细胞核可见棕黄色颗粒为阳性,400倍光镜下随机选取10个视野,计算1 000个肿瘤细胞中阳性细胞所占比率,≥10%为阳性,<10%为阴性;染色强度按阴性、弱、中和强染色评为0~3分。
1.4 统计学分析
用GraphPad Prism 8.0软件进行统计分析。计数和计量资料分别用率(%)和()表示,分别采用χ2及t检验,P<0.05为差异有统计学意义。计量资料比较采用Student's t检验。相关性采用Pearson相关分析。
2 结果
2.1 NSCLC组织β-catenin和PD-L1 mRNA表达相关分析
为探讨NSCLC组织中β-catenin和PD-L1 mRNA表达情况,本研究用实时定量PCR方法检测NSCLC组织和配对的癌旁组织β-catenin和PD-L1 mRNA表达,如图1A和图1B显示,和配对的癌旁组织比较,绝大多数(27/30)NSCLC组织中β-catenin和PD-L1 mRNA表达均明显升高。Pearson相关分析显示,NSCLC组织中β-catenin mRNA表达升高倍数和PD-L1 mRNA表达升高倍数呈明显正相关。见图1。

图1 NSCLC组织中β-catenin和PD-L1 mRNA表达
2.2 NSCLC组织β-catenin和PD-L1蛋白表达水平分析
为进一步探讨NSCLC组织中β-catenin和PD-L1蛋白表达情况及相互关系,采用免疫组化方法分别检测连续的癌组织切片中β-catenin和PD-L1的蛋白表达,在β-catenin表达弱的非小细胞癌组织中PD-L1表达也弱,β-catenin表达强的癌组织中PD-L1表达也相应较强。见图2。
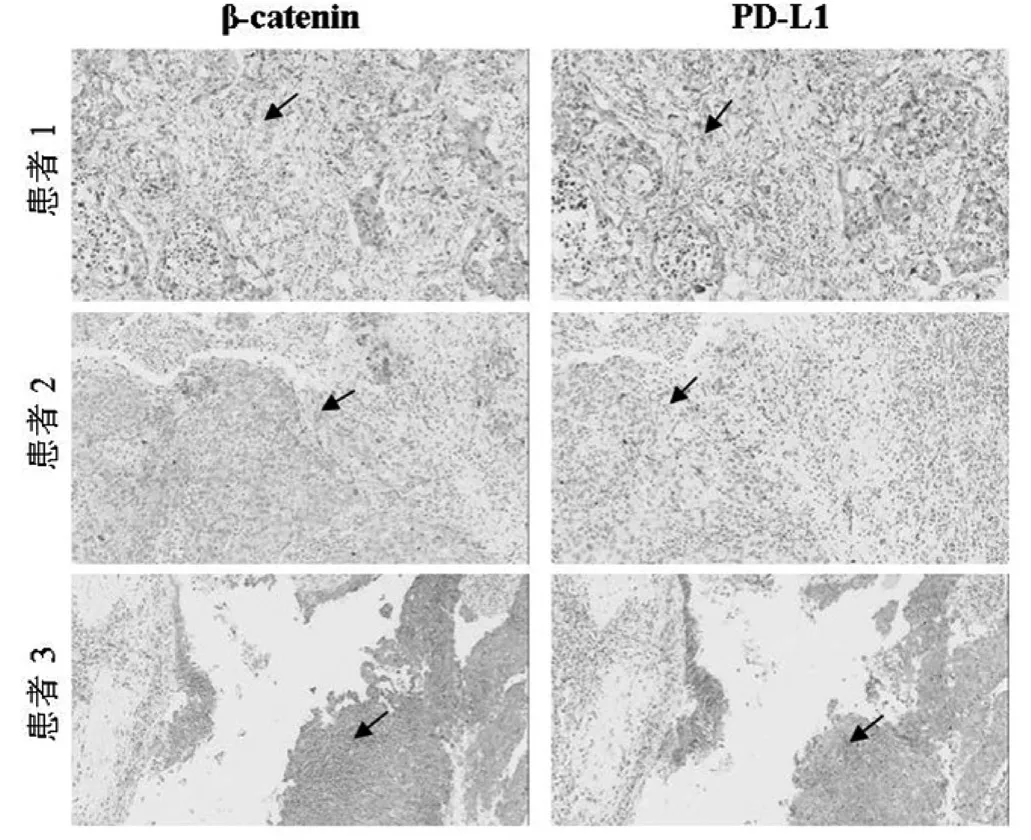
图2 NSCLC组织中β-catenin和PD-L1蛋白表达
3 讨论
据世界卫生组织(WHO)下属的国际癌症研究机构(IARC)公布的数据显示,2020年全球新发肺癌病例大约为220.7万例,发病率居恶性肿瘤第2位[14-15],而在中国,肺癌是目前发病率和病死率最高的恶性肿瘤[16],其中NSCLC是临床中最为常见的肺癌类型之一。NSCLC的发生、发展和转归是一个复杂的且由多种因素共同参与的过程[17],其中较为经典的有Wnt/β-catenin信号通路的异常激活和肺癌细胞表达PD-L1参与免疫逃逸。
Wnt信号通路是与肿瘤的发生发展密切相关的一类信号通路,Wnt信号通路通过调节细胞的增殖、分化、转移、极性、黏附等,参与很多发育过程,如胚胎发育,组织完整性,体轴模式,机体干细胞维持等。在正常成熟的细胞中,Wnt信号通路处于闭合状态。Wnt信号通路分为经典的β-catenin依赖性途径和非经典的β-catenin非依赖性途径[18]。本研究提及的Wnt/β-catenin信号通路即为经典Wnt信号通路[19]。β-catenin是Wnt信号通路的重要调节蛋白,当Wnt信号通路异常激活时,其由细胞浆转入细胞核,调节靶基因的表达并进一步促进细胞的增殖。Wnt/β-catenin信号通路已被证实在多种肿瘤细胞中异常表达,可广泛参与人类肿瘤的发生、发展和肿瘤耐药[8-10],在参与肺癌发生发展的诸多信号通路中,Wnt/β-catenin信号通路对肺癌的调控较为直接且复杂,是肺癌发生发展过程中较为重要的因素之一,其在NSCLC中呈现高表达的状态,在NSCLC的进展与转移中起到关键性作用[19-20]。
PD-1是一种细胞表面受体,在活化的T细胞上高表达,被认为是T细胞衰竭的标志,它可以调节T细胞的活性,激活肿瘤特异性T细胞的凋亡,抑制调节性T细胞的凋亡,从而抑制免疫反应并促进自我耐受[21]。PD-L1是一型跨膜蛋白,可在某些肿瘤细胞和抗原提呈细胞表达,是一种免疫反应的共抑制因子[22],其功能与免疫系统的抑制有关。PD-1与其配体PD-L1结合后,其碳端免疫受体酪氨酸基开关基序发生磷酸化,募集蛋白酪氨酸磷酸酶Src同源蛋白2,使下游的脾酪氨酸激酶和磷脂酰肌醇3激酶发生去磷酸化,从而传递抑制性信号,发挥负性调节作用[2,23-25]。PD-1/PD-L1在肿瘤细胞的高表达促使肿瘤细胞的抗原性降低,机体的免疫系统对肿瘤细胞的识别能力降低,导致抗肿瘤水平下降,促使了肿瘤的发展。马薇等[26]发现PD-L1在47例NSCLC患者的癌细胞及癌间质淋巴细胞和巨噬细胞的表达阳性率水平与肺癌的临床分期、淋巴结转移呈正相关,与患者的预后生存呈负相关,提示PD-1/PD-L1信号通路可能参与了NSCLC的发展进程。
本研究应用实时荧光定量PCR(RT-PCR)和免疫组织化学方法分别探讨NSCLC组织及其癌旁组织中β-catenin和PD-L1在mRNA水平和蛋白水平的表达情况,结果发现NSCLC组织中β-catenin和PD-L1的表达均较其癌旁组织明显升高,且二者的mRNA表达水平呈明显的正相关,这个结果也在蛋白水平中得到了验证。根据获得的研究结果本研究推测,在NSCLC中Wnt/β-catenin信号通路激活后可能有相关基因参与调控PD-L1的表达,而高表达的PD-L1与肿瘤浸润T淋巴细胞表面的PD-1结合,降低了肿瘤局部微环境中T细胞的免疫效应,从而介导NSCLC免疫逃逸的发生,促进NSCLC的进展。
综上所述,本研究结果表明Wnt/β-catenin信号通路的激活可能会诱导NSCLC中PD-L1的表达,而PD-L1又参与了NSCLC的免疫逃逸过程。因此,本研究猜测抑制Wnt/β-catenin信号通路可能会导致PD-L1表达量的减少,并且可能会降低NSCLC免疫逃避的发生,这为NSCLC的免疫疗法提供了新的思路。然而,本研究仅显示Wnt/β-catenin信号通路可能参与调控PD-L1的表达,因实验方法的局限性,仍存在许多的不足,还需进行更为深入、严谨的实验来探究Wnt/β-catenin信号通路可能存在的促进PD-L1表达的分子机制,为Wnt/β-catenin信号通路参与调控PD-L1的表达提供更为可靠的证据。虽然免疫疗法在一些肿瘤的治疗中取得了初步的进展,但是未来临床医生和科研工作者将面临更多的问题和挑战,需要进行更为深入、严谨的基础研究并将其进行临床转化,最大限度地为每一位肿瘤患者提供提高生存率和生存质量的诊疗服务。
