绵羊CREBRF基因克隆、生物信息学及组织表达分析
2022-05-31张丽萌刘爱菊李闰婷李玉华聂晓宁王林青陈龙欣
张丽萌,刘爱菊,李闰婷,李玉华,李 林,聂晓宁,王林青,陈龙欣,
(1.郑州师范学院,分子生物学实验室,郑州 450044;2.郑州师范学院生命科学学院,郑州 450044;3.沧州职业技术学院农牧工程系,沧州 061001)
Luman/CREB3募集因子(LRF或CREBRF)为Luman(或CREB3)的一种细胞转录因子,属于真核转录因子的碱性亮氨酸拉链(bZIP)家族的内质网定位蛋白,普遍存在于多种细胞类型中,可与cAMP反应元件结合并影响细胞生长和增殖[1-2]。CREB3家族成员调节多种基因的表达,在急性期反应、脂质代谢、发育、存活、分化、细胞器自动调节和蛋白质分泌等方面均发挥着重要作用[3-5]。据报道,CREB3与转录共激活因子HCF1、丙型肝炎病毒核心蛋白[6]和树突细胞特异性跨膜蛋白相互作用,主要参与调控细胞增殖、分化和凋亡等多种生物学过程。
CREB3家族成员最初是从小鼠和人中分离出来的,其中CREBRF与果蝇dCREB-A/BBF2密切相关[7],在介导DNA结合和二聚化的跨膜结构域、内质网腔结构域和bZIP结构域内具有较大的一致性[8],而dCREB-A/BBF2是果蝇胚胎发育所必需的,表明CREB3蛋白可能在繁殖中发挥作用。Yang等[9]研究表明,CREBRF基因在怀孕小鼠发育的各阶段均显著表达,且主要定位在着床部位。Zhao等[10]研究发现,通过shRNA沉默小鼠GC细胞中CREBRF基因mRNA和蛋白的表达,可能控制类固醇生成基因的表达,从而影响小鼠GC细胞周期活性,促进细胞增殖,减少雌二醇和孕酮的合成,推测CREBRF可能通过与这些蛋白相互作用来抑制卵泡闭锁。另外,敲低CREBRF基因也会对小鼠GC细胞中基因表达产生影响,CREBRF基因在调节卵泡发生、排卵和黄体组织形成中都发挥着重要作用。CREBRF基因作为一种在山羊妊娠早期子宫内膜上皮细胞中自噬的潜在激活剂,干扰其表达可阻碍细胞增殖,使细胞周期阻滞在S期阶段,同时还可通过CREBRF-mTOR-自噬途径增加CREBRF基因表达,从而显著抑制子宫内膜功能[11]。
目前国内外对CREBRF基因的研究主要集中在小鼠上,对于其他哺乳动物研究较少。鉴于此,本研究拟克隆绵羊CREBRF基因,对CREBRF蛋白的理化性质、结构及功能特性进行生物信息学分析,并对CREBRF基因在绵羊不同组织中的表达水平进行检测,以期为深入探索CREBRF基因在哺乳动物中的生物学功能及绵羊繁殖调控等提供参考。
1 材料与方法
1.1 样品采集
从河北省某养殖场选取3只健康的1岁左右的小尾寒羊,屠宰处死后立即采集心脏、肝脏、脾脏、肺脏、肾脏、淋巴结、子宫、卵巢及输卵管组织,迅速置于液氮中,带回实验室后-80 ℃保存备用。
1.2 主要试剂
质粒提取试剂盒、大肠杆菌DH5α感受态细胞、TransStart®FastPfuDNA Polymerase、Trans2K Plus DNA Marker、ReverAid First Strand cDNA Synthesis Kit均购自北京全式金生物技术有限公司;T4 DNA连接酶购自NEB公司;SYBR Green RT-PCR荧光染料酶购自南京诺唯赞生物科技有限公司;TRIzol购自Invitrogen公司。
1.3 引物设计与合成
根据NCBI中已公布的羊CREBRF基因序列(GenBank登录号:NC_040267.1),利用Primer Premier 5.0引物设计软件设计特异性引物及实时荧光定量PCR引物,以绵羊GAPDH基因(登录号:NC_019460.2)作为内参基因,引物序列见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物序列信息
1.4 RNA提取及cDNA合成
将-80 ℃保存的绵羊各组织分别剪碎并分装于2 mL无酶离心管中,置于预先准备的液氮中冷冻。采用常规TRIzol法分别提取绵羊各组织总RNA,利用NanoDrop 2000分光光度计测定RNA浓度及D260 nm/D280 nm值,1.0%琼脂糖凝胶电泳检测RNA完整性。以提取的总RNA为模板,按照ReverAid First Strand cDNA Synthesis Kit反转录试剂盒合成cDNA,反转录程序:42 ℃ 15 min,85 ℃ 5 s,冰上孵育2 min。cDNA于-20 ℃保存备用。
1.5 绵羊CREBRF基因克隆及测序
利用Pfu高保真酶以cDNA为模板PCR扩增绵羊CREBRF基因。PCR扩增体系20 μL:上、下游引物各1 μL,cDNA模板1 μL,Pfu酶1 μL,5×PfuBuffer 4 μL,2.5 mmol/L dNTP 2 μL,ddH2O 10 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸30 s,共30个循环;72 ℃延伸10 min;4 ℃保存。1.0%琼脂糖凝胶电泳检测后切胶回收,回收后的目的片段与PUC57-T载体混合后16 ℃连接3 h,转化大肠杆菌DH5α感受态细胞,冰浴30 min,42 ℃水浴热激70 s,再冰上孵育2 min,加入提前准备好的1 mL无菌无抗性的LB液体培养基,37 ℃、260 r/min培养1 h,取200 μL菌液涂布于含有卡那抗性的LB固体培养基平板上,37 ℃倒置培养16 h。挑取3个单克隆菌落摇菌并利用1.0%琼脂糖凝胶电泳检测,将条带正确的阳性克隆送测序。
1.6 生物信息学分析
在NCBI中下载山羊(登录号:XP_017921086)、牛(登录号:XP_015314532)、人(登录号:NP_001161866)、小鼠(登录号:NP_084146)、猪(登录号:XP_020932555.1)、犬(登录号:XP_038519270)、马(登录号:XP_008508125)、鸡(登录号:XP_040538972)、鸭(登录号:XP_038042449)和斑马鱼(登录号:XP_005170343)的CREBRF基因氨基酸序列,利用DNAStar Lasergene(MegAlign)进行多序列比对,分析绵羊与不同物种CREBRF氨基酸序列的相似性,并利用Mega 6.0软件构建系统进化树;利用生物信息学在线软件预测CREBRF蛋白的结构及功能(表2)。

表2 蛋白预测分析工具
1.7 CREBRF基因在绵羊不同组织中的表达水平
以绵羊GAPDH基因作为内参,选用SYBR Green酶对CREBRF基因进行实时荧光定量PCR检测。PCR扩增体系10 μL:cDNA模板1 μL,上、下游引物各0.5 μL,2×SYBR Green Mix混合液5 μL,ddH2O 3 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性15 s,56/60 ℃退火15 s,72 ℃延伸30 s,共45个循环;72 ℃延伸10 min。每组选3个样本,设置3个重复。采用相对定量2-△△Ct法计算CREBRF基因在绵羊不同组织中的表达水平。
1.8 数据统计分析
采用SPSS 19.0统计软件中独立样本t检验进行显著性分析,数据以平均值±标准误表示,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 绵羊CREBRF基因克隆及测序
对绵羊不同组织RNA样品采用紫外分光光度法测定,D260 nm/D280 nm值约为1.9,经1.0%琼脂糖凝胶电泳检测显示,5S、18S和28S条带清晰,RNA质量较好,可满足试验要求。以绵羊卵巢组织cDNA为模板进行PCR扩增后,产物通过1.0%琼脂糖凝胶电泳检测,获得片段长约1 920 bp(图1),与预期大小相符。测序后经 MegAlign 软件比对发现,与羊CREBRF基因序列(GenBank登录号:NC_040267.1)相似性达到100%。

图1 绵羊CREBRF基因PCR扩增产物Fig.1 PCR amplifiation product of CREBRF gene in Ovis aries
2.2 相似性比对及系统进化树构建
相似性比对结果显示,绵羊CREBRF基因氨基酸序列与山羊、牛、人、小鼠、猪、犬、马、鸡、鸭和斑马鱼的相似性分别为99.8%、99.1%、95.4%、93.6%、98.3%、97.5%、98.4%、88.0%、87.5%和61.3%(图2),表明在不同物种间该蛋白序列具有较高的保守性。系统进化树分析结果显示,绵羊与山羊、牛的亲缘关系最近,与人和小鼠次之,与斑马鱼亲缘关系最远(图3)。

图2 绵羊与其他物种CREBRF基因氨基酸序列相似性比对Fig.2 Similarity alignment of amino acid sequences of CREBRF gene between Ovis aries and other species

图3 CREBRF基因氨基酸序列系统进化树Fig.3 Phylogenetic tree of amino acid sequences of CREBRF gene
2.3 生物信息学分析
2.3.1 理化性质分析 利用ProtParam在线软件预测绵羊CREBRF蛋白理化性质,共编码639个氨基酸,其中谷氨酸(Glu)含量最多(10.6%),色氨酸(Trp)含量最少(0.9%),肽链N-端为蛋氨酸(Met),带负电荷的氨基酸残基(Asp+Glu)共115个,带正电荷的氨基酸残基(Arg+Lys)共76个(表3)。CREBR蛋白分子式为C3126H4914N858O1056S21,分子质量为72.08 ku,由9 975个原子构成,理论等电点(pI)为4.77,半衰期为30 h,不稳定性指数为54.83(>40),表明该蛋白结构不稳定;亲水性平均值(GRAVY)为-0.894,脂溶指数为65.74,说明绵羊CREBRF蛋白属于亲水性蛋白。

表3 绵羊CREBRF蛋白的氨基酸组成
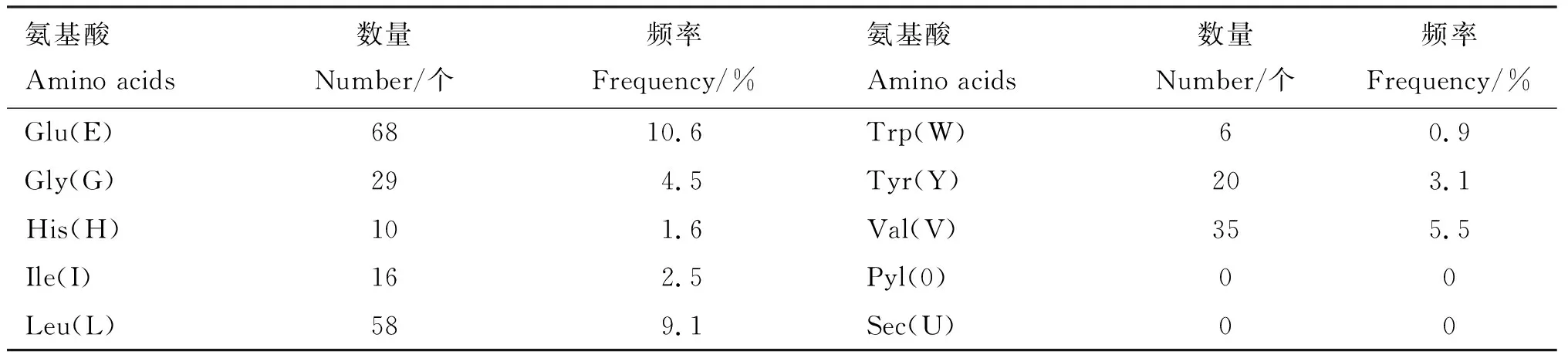
续表
2.3.2 亲/疏水性预测 使用ProtScale工具分析CREBRF蛋白的亲/疏水性,结果见图4。由图4可知,其疏水性最强位置为566位的丙氨酸(Val),得分为1.756;而亲水性最强位置分别是359、385、386、387位的谷氨酰胺(Gln),得分均为-3.500。另外,CREBRF蛋白亲水性区域(负分值)明显多于疏水性区域(正分值)。表明CREBRF蛋白为亲水性蛋白。
2.3.3 磷酸化位点和信号肽预测 通过NetPhos 3.1 Server在线软件分析绵羊CREBRF蛋白的磷酸化位点,结果显示,丝氨酸、苏氨酸和酪氨酸磷酸化位点分别为49、25和13个(图5)。通过SingnalP-4.1软件预测绵羊CREBRF蛋白信号肽,发现不存在信号肽(图6)。
2.3.4 亚细胞定位和跨膜结构域预测 采用Cell-Ploc 2.0在线软件预测CREBRF蛋白在细胞内的具体位置,绵羊CREBRF蛋白主要定位在细胞核中。利用TMHMM Server v.2.0在线软件对绵羊CREBRF蛋白跨膜区进行预测,发现该蛋白不存在跨膜结构(图7)。
2.3.5 保守结构域预测 利用Conserved Domains软件对CREBRF蛋白保守结构域进行预测,结果显示,该蛋白525-563位氨基酸处属于碱性亮氨酸拉链(bZIP)转录因子结构域或bZIP超家族成员(bZIP transcription factor),类似人CREB3调节因子,可作为内质网应激(ERS)或未折叠蛋白反应(UPR)的负调节因子(图8)。
2.3.6 二级结构和三级结构预测 利用ExPASy在线软件预测绵羊CREBRF蛋白二级结构,结果显示,α-螺旋、延伸链、β-转角、无规则卷曲占比分别为37.09%、10.33%、5.01%和47.57%(图9)。 利用SWISS-MODEL在线软件建立CREBRF蛋白三级结构,结果显示,建模的三级结构与4kqt.1.A具有很高的相似性,与二级结构预测结果相符,具有90%的可信度(图10)。

图6 绵羊CREBRF蛋白信号肽预测Fig.6 Signal peptide prediction of CREBRF protein in Ovis aries

图7 绵羊CREBRF蛋白跨膜结构域预测Fig.7 Transmembrane domain prediction of CREBRF protein in Ovis aries

图8 绵羊CREBRF蛋白保守结构域预测Fig.8 Conserved domain prediction of CREBRF protein in Ovis aries

线条从长到短依次代表α-螺旋(h)、延伸链(e)、β-转角(t)及无规则卷曲(c)Lines from long to short represents alpha helix (h),extended chain (e),beta turn (t) and random coil (c)图9 绵羊CREBRF二级结构预测Fig.9 Secondary structure prediction of CREBRF protein in Ovis aries

图10 绵羊CREBRF三级结构预测Fig.10 Tertiary structure prediction of CREBRF protein in Ovis aries
2.3.7 CREBRF蛋白质互作分析 运用STRING在线软件分析绵羊CREBRF蛋白的蛋白互作,结果显示,CREBRF与CREB3L4、ZNF395、TRIB2、KLHL24、BNIP1、LOH12CR1、CREBL2、FBXO32、HIPK3、DNAJC16、CREB3L3、CYSLTR1、ACBD5、PJA2、ADNP、CD97、FBXO11、ATP6V0E1、KAT6A和CYSLTR1蛋白彼此间均有紧密联系,图形越大代表蛋白与蛋白之间的互作关系越强(图11)。
2.4 CREBRF基因在绵羊不同组织中的表达水平
采用实时荧光定量PCR方法检测CREBRF基因在绵羊不同组织中的表达情况,结果见图12。由图12可知,CREBRF基因在绵羊各组织中均有广泛表达,其中在心脏、肾脏和卵巢中表达量相对较高,显著高于其他组织(P<0.05),在脾脏、淋巴结、子宫和输卵管中表达量次之,在肝脏和肺脏中表达量最低。

图11 绵羊CREBRF蛋白网络互作分析Fig.11 CREBRF protein network interaction in Ovis aries

肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)Value with different letter superscripts mean significant difference (P<0.05);While with the same superscripts mean no significant difference (P>0.05)图12 CREBRF基因在绵羊不同组织中的相对表达量Fig.12 Relative expression of CREBRF gene in different tissues of Ovis aries
3 讨 论
CREBRF也称为cAMP反应元件结合蛋白3,是一种内质网膜结合转录因子,已被鉴定为多种核受体的新型转录共调节因子[12-13]。关于CREBRF的研究在小鼠上较多,主要是在机体代谢[14-15]、疾病治疗[16-18]和动物繁殖方面发挥着重要作用,对于其他哺乳动物的繁殖调控方面涉及较少。家畜的繁殖性能很大程度上影响着农业生产的经济效益,繁殖性状作为多基因控制的数量性状受到多种转录调控因子和信号通路的共同调控,而卵泡发育则是一个内分泌调控与外部调控相结合的复杂有序过程,卵母细胞和颗粒细胞在卵泡发育的不同阶段都发挥着重要的作用[19]。研究表明,在缺氧、代谢异常、营养不足/过剩[14]等异常情况下,CREBRF通过哺乳动物内质网应激和未折叠蛋白反应中的负反馈调节因子途径引起颗粒细胞凋亡,发生卵泡闭锁,会导致不孕或终止妊娠[6,20]。在小鼠颗粒细胞中通过敲低CREBRF基因的表达,可促进细胞增殖,显著降低雌二醇和孕酮激素的表达水平,导致CREBRF缺陷型小鼠出现低皮质酮、低体重和幼崽存活率降低[21]。目前,虽已发现众多与卵泡发育密切相关的分子调节剂[14]和信号通路[22],但对其生物学功能及具体精确机制仍然未知。
本研究克隆得到绵羊CREBRF基因CDS区全长1 920 bp,编码639个氨基酸。根据不同物种氨基酸序列相似性比对,绵羊与山羊、牛的相似性在98%以上,与斑马鱼的相似性最低,符合生物进化规律,具有广泛的相似性且在哺乳类动物中高度保守。通过构建系统进化树发现,CREBRF蛋白在不同物种的进化过程中高度保守,推测CREBRF基因可能参与众多的生理过程。CREBRF为不稳定的亲水性蛋白,不存在跨膜信号,但具有磷酸化特性,不存在信号肽,表明不是分泌蛋白。亚细胞定位表明,CREBRF蛋白主要定位于细胞核中,在卵母细胞及不同发育时期的卵泡中都能检测到CREBRF基因和蛋白,推测CREBRF可通过内质网应激途径调控GC细胞增殖、分化及凋亡,从而参与卵泡发育的一系列过程。杨延周[23]研究发现,在卵巢的各级卵泡、凋亡的颗粒细胞中CREBRF基因均有不同程度的表达,且在发情期间的小鼠子宫、输卵管及发情后期的卵巢中表达水平较高。通过STRING数据库发现,绵羊CREBRF蛋白与CREB3L4、KLHL24、BNIP1、ACBD5和DNAJC16等蛋白存在互作关系。BNIP1是BH3-only蛋白家族的成员,在多种生物过程中发挥着重要作用,BNIP1显著抑制mTOR、p70S6K1和p-p70S6K1的表达,可通过mTOR信号通路抑制HeLa细胞的增殖、迁移和侵袭,促进细胞凋亡[24]。CREB3L4(也称为AIbZIP、Tisp40或ATCE1)主要在前列腺组织中表达,破坏CREB3L4表达可导致附睾精子核异常、内质网应激和半胱天冬酶激活,使减数分裂/减数分裂后生殖细胞凋亡[25]。另外,当细胞感受某种信号时CREB3和CREB3L4蛋白可转位进入细胞核中,可以激发下游基因的转录,说明该基因可通过不同信号通路发挥调控作用。ACBD5缺陷小鼠表现出长链脂肪酸水平升高和小脑病变,ACBD5还可能维持过氧化物酶体与内质网的接触,以促进合成代谢和分解代谢细胞脂质途径的调节[26]。
研究发现,CREBRF基因在小鼠的心脏、肾脏、肝脏、肺脏、脂肪、骨骼肌和睾丸不同组织中均有表达[20]。本研究利用实时荧光定量分析显示,CREBRF基因在绵羊不同组织中均有不同程度的差异表达,其中在心脏、肾脏和卵巢中的表达量较高。哺乳动物卵巢上有大量处于不同发育阶段的卵泡,但只有少数卵泡能够发育成熟并排卵,卵泡发生过程是受颗粒细胞分泌的各种因子调控的复杂生物过程。研究表明,在小鼠发情周期的不同阶段及卵巢颗粒细胞中CREBRF蛋白呈现时空特异性表达,能够与促凋亡蛋白Caspase-12共表达导致颗粒细胞凋亡,CREBRF基因可能通过内质网应激途径诱导颗粒细胞的凋亡,并在小鼠卵泡选择中起到关键作用[8,23]。因此,在绵羊卵泡发育过程中CREBRF基因可能存在潜在的繁殖调控作用。本研究下一步将利用分子生物学手段进一步阐明CREBRF基因在动物繁殖过程中的具体生物学功能和调控机制,以期为提高家畜繁殖力确定新的靶标,从而提高现代畜牧业生产的经济效益。
4 结 论
本试验克隆获得绵羊CREBRF基因,CDS区序列1 920 bp,编码639个氨基酸,与山羊、牛的相似性高,亲缘关系最近,与斑马鱼亲缘关系最远。绵羊CREBRF蛋白无信号肽,不含有跨膜区,为亲水性非跨膜蛋白,可与CREBRF与CREB3L4、ZNF395、TRIB2、KLHL24、BNIP1、LOH12CR1、CREBL2、FBXO32、HIPK3、DNAJC16、CREB3L3、CYSLTR1、ACBD5、PJA2、ADNP、CD97、FBXO11、ATP6V0E1、KAT6A和CYSLTR1等蛋白发生互作;CREBRF基因在绵羊各组织中均有表达,在心脏、肾脏和卵巢中的表达量相对较高,在肝脏和肺脏中表达量相对较低。
