玫瑰石斛组培快繁体系的建立
2022-05-31许丁帆何远秦刘艳军贺峰
许丁帆 何远秦 刘艳军 贺峰

摘 要:以玫瑰石斛蒴果为外植体,通过种子无菌萌发诱导原球茎、原球茎增殖与丛生芽分化、生根壮苗试验,建立玫瑰石斛组培快繁体系,为玫瑰石斛繁育和优质种苗生产提供了参考依据。结果显示:玫瑰石斛蒴果经外植体消毒后,将蒴果内种子撒播于1/2MS培养基上,种子可快速萌发形成原球茎;玫瑰石斛原球茎增殖与分化最佳培养基为1/2MS+1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA,原球茎的增殖系数达6.04,丛生芽生长速度快;玫瑰石斛最适的生根壮苗培养基为1/2MS+0.2 mg·L-1 NAA+50 g·L-1土豆泥,生根率达100%,平均根数为5.14条,平均株高达5.54 cm。
关键词:玫瑰石斛;组织培养;激素;培养基
中图分类号:S664.1 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2022.05.001
Establishment of Tissue Culture and Rapid Propagation System in Dendrobium crepidatum
XU Dingfan1, HE Yuanqin1, LIU Yanjun1, HE Feng2
(1. College of Horticulture and Landscape Architecture,Tianjin Agricultural University, Tianjin 300384,China; 2. WeixianYiju Planting and Gardening Design Co. Ltd, Handan, Hebei 056800, China)
Abstract:Taking the capsules of Dendrobium crepidatum as the explant, the tissue culture and rapid propagation system of Dendrobium crepidatum was established through the experiment of inducing protocorm, protocorm proliferation, cluster bud differentiation, rooting and strengthening seedlings by aseptic germination of seeds, which provided a reference basis for Dendrobium crepidatum breeding and high-quality seedling production. The results showed that after the capsules were disinfected, the seeds in the capsule were sown on 1/2MS medium, then the seeds could germinate rapidly to form protocorms; the optimum medium for the proliferation and differentiation of protocorms was 1/2MS+1.0 mg·L-1 BA+0.5 mg·L-1 NAA, which the proliferation coefficient of protocorms reached 6.04 and the growth rate of cluster buds was fast; The optimum rooting medium was 1/2MS+0.2 mg·L-1 NAA+50 g·L-1 mashed potato, which the rooting rate was 100%, the average number of roots was 5.14, and the average plant height was 5.54 cm. The results of this experiment laid a foundation for the rapid propagation of Dendrobium crepidatum, and provided a reference basis for Dendrobium crepidatum breeding and high-quality seedling production.
Key words: Dendrobium crepidatum; tissue culture; hormone; medium
玫瑰石斛(Dendrobium crepidatum Lindl.et Paxt.),蘭科石斛属植物,具有滋阴益胃、生津除烦等功效[1]。同时,玫瑰石斛花色艳丽,具有较高的园艺观赏价值,是市场热门的观赏石斛之一。但玫瑰石斛野生资源匮乏,种源成为制约玫瑰石斛人工大规模生产的重要因素。
当前,玫瑰石斛主要以分株、扦插等方式繁殖,生产效率低、繁殖速度慢,不能满足市场的需求;且长期的营养繁殖易导致病毒累积从而使品种退化。以组培快繁技术对玫瑰石斛进行种苗繁殖,可在短时间内获得大量优质种苗,速度快、繁殖系数高,同时还可以解决玫瑰石斛种源问题,在一定程度上保护玫瑰石斛野生资源。然而,目前关于玫瑰石斛的研究主要集中生药学鉴定[2]、主要功能成分分析[3-4]等方面,关于玫瑰石斛的组织培养研究报道较少。白音等[5]最早以玫瑰石斛无菌萌发的种胚苗茎节或茎段为材料建立组织培养及快速繁殖体系;苏江等[6]以玫瑰石斛茎段为外植体诱导原球茎,并对原球茎进行增殖,进而获得玫瑰石斛种苗;许丁帆等[7]以玫瑰石斛叶片为外植体诱导原球茎并增殖,建立了稳定高效的玫瑰石斛原球茎生产体系。这些研究大多局限于某一阶段,未形成系统、可靠的玫瑰石斛快繁技术体系。因此,建立一个完整、系统的组培快繁体系对玫瑰石斛产业的发展具有重要意义。
无菌播种是目前常用的石斛种苗繁育方式。在自然条件下,石斛种子极为细微且无胚乳,只能在适宜环境下与真菌共生才可萌发,自然萌发率不到5%[8]。在使用无菌播种的方式时,通过人工给予丰富的养分及适宜的条件,使种子的萌发率能达到90%以上[9]。在提高种子萌发率的同时,无菌播种也能发挥出兰科植物种子量极大的优势,可以显著提高石斛种苗的繁育速度[10]。使用无菌播种的方式诱导铁皮石斛原球茎的研究较多,也因种子拥有直接成苗的能力,许多研究进一步改进了组织培养技术,形成了三步成苗乃至一步成苗的工艺,极大的简化了铁皮石斛的成苗程序[11-12]。目前尚未见到相关研究在玫瑰石斛组织培养中使用无菌播种的方法。
本研究以玫瑰石斛种子为外植体,研究无菌播种、原球茎诱导、原球茎增殖、丛生芽分化及生根壮苗等组培技术流程,以期建立一套高效的玫瑰石斛组培快繁体系,为玫瑰石斛大规模生产奠定基础。
1 材料和方法
1.1 试验材料
试验所用玫瑰石斛蒴果取自魏县益聚种植园艺设计有限公司玫瑰石斛盆栽苗,盆栽基质为水苔。
1.2 试验方法
1.2.1 无菌播种与原球茎诱导 摘取玫瑰石斛蒴果于烧杯中,滴1~2滴吐温,流水下冲洗30 min,然后在超净工作台中用75%乙醇浸泡45 s, 之后用含2%有效氯的次氯酸钠溶液灭菌20 min, 最后用无菌水浸泡3次,每次浸泡5 min。灭菌之后用无菌滤纸吸干玫瑰石斛蒴果表面水分,并切开蒴果前端,将种子均匀撒播于1/2MS培养基上,接种后每天观察记录种子萌发情况,并采用尼康SMZ25体视显微镜进行观察。
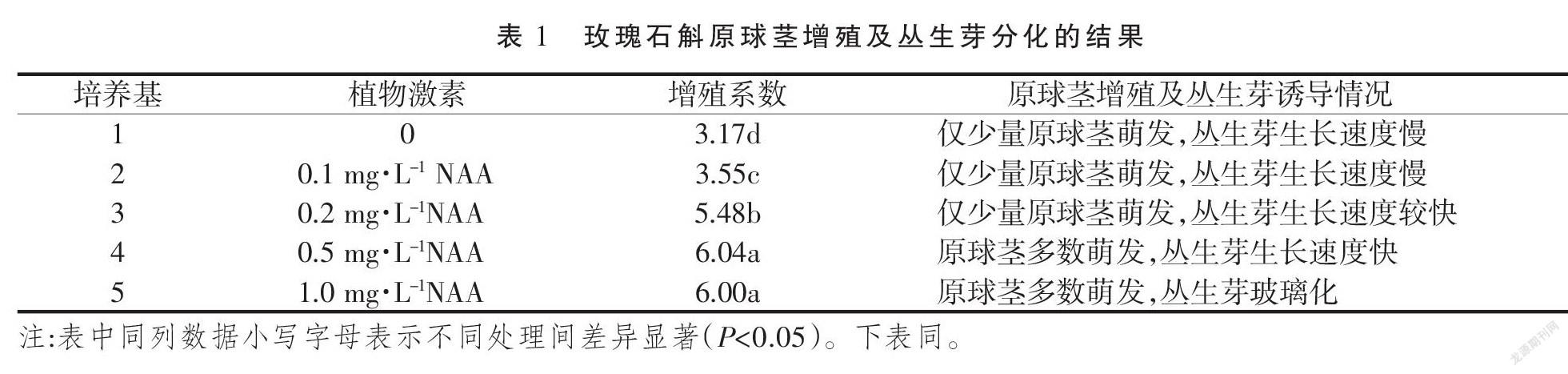
1.2.2 原球茎增殖与丛生芽分化 将种子萌发后获得的原球茎转接到原球茎增殖与丛生芽分化培养基中,培养基以1/2MS+1.0 mg·L-16-BA为基础,附加不同浓度的NAA(0.1,0.2,0.5,1.0 mg·L-1)。每种培养基接种5瓶,每瓶接种约100个原球茎,试验重复3次。培养45 d后观察记录原球茎生长情况并统计增殖系数。
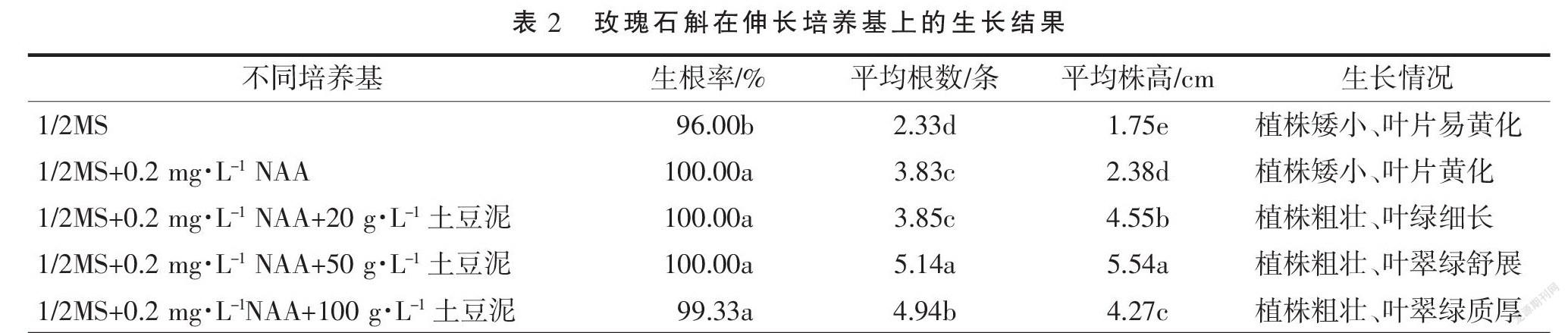
1.2.3 玫瑰石斛的生根壮苗培养 选择长势一致且生长健壮的0.5~1.0 cm的丛生苗接种到生根壮苗培养基上,培养基采用1/2MS为基本培养基,其中附加一定浓度的NAA(0.2 mg·L-1)、土豆泥(20,50,100 mg·L-1)。每个培养基配方接种10瓶,每瓶接种玫瑰石斛丛生苗5个,试验重复3次。培养开始后,每天观察植株生长情况,培养50 d后统计每个处理玫瑰石斛的生根率、平均根数和平均株高。
1.2.4 培养条件 以上培养基均添加6.5 g·L-1琼脂,20 g·L-1蔗糖,灭菌前调节pH为5.8~6.0,121 ℃、0.1 MPa下灭菌20 min。培养条件为25±2 ℃,24 h光照,光照强度1 000~1 500 lx。
1.3 数据统计分析
增殖系数=增殖后的有效原球茎总数/起始接种总数[13];
生根率%=产生根的幼苗数/接种芽数×100%;
试验数据采用Excel 2013和SPSS Statistic 22.0进行数据分析,Duncans新复极差法进行多重比较。
2 结果与分析
2.1 种子萌发及原球茎的诱导
玫瑰石斛播种后逐渐吸水膨胀,5~7 d后种子膨大明显并呈淡绿色,30 d后逐渐形成绿色原球茎。
2.2 玫瑰石斛原球茎增殖与丛生芽诱导
由表1可知,在1/2MS+1.0 mg·L-1 BA的基础上附加一定量的NAA有利于原球茎的增殖,原球茎的增殖系数显著高于未附加NAA的培养基上的原球茎增殖系数。在NAA浓度在0至0.5 mg·L-1范围内时,原球茎的增殖系数随添加的NAA浓度上升而增加。当在1/2MS+1.0 mg·L-1 6-BA的基礎上附加0.5 mg·L-1 NAA时,原球茎增殖系数最高,达6.04,且此时原球茎多数萌发成丛生芽,且丛生芽生长速度快,长势均匀、整齐。当增加NAA用量至1.0 mg·L-1时,原球茎的增殖系数未显著提高,但此时分化的丛生芽出现玻璃化现象。因此,玫瑰石斛原球茎增殖与分化最佳培养基为:1/2MS+1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA。
2.3 玫瑰石斛生根壮苗培养
从表2可以看出,玫瑰石斛在1/2MS培养基上生长缓慢,植株矮小,随培养时间的延长叶片逐渐黄化;当在1/2MS培养基中添加0.2 mg·L-1 NAA时,玫瑰石斛生长速度略有加快,生根率、平均根数和平均株高均有显著提高,但后期仍然停止生长,叶片出现黄化现象。在1/2MS+0.2 mg·L-1NAA培养基中添加一定浓度的土豆泥,玫瑰石斛生根与生长势显著提高,说明添加适量土豆泥较有利于玫瑰石斛生根壮苗;当在培养基中添加50 g·L-1土豆泥时,玫瑰石斛生根壮苗情况最佳,生根率、平均根数和平均株高显著高于其他处理,此时玫瑰石斛植株粗壮、叶翠绿舒展。因此,玫瑰石斛最适的生根壮苗培养基为1/2MS+0.2 mg·L-1 NAA+50 g·L-1土豆泥。
3 结论与讨论
外植体消毒是建立玫瑰石斛无菌体系的关键步骤。在玫瑰石斛组培快繁研究中,前人均以HgCl2为消毒剂进行外植体消毒[5-6]。但目前HgCl2使用受到严格管控,较难获取。因此,本研究以易获取的2%有效氯的次氯酸钠溶液为消毒剂。蒴果的果皮对石斛种子具有保护作用,在外植体消毒过程中可以避免因消毒程度过深而损伤种子,故在石斛无菌播种中,控制污染率的关键在于对蒴果表皮的消毒上。本研究适当的延长了外植体消毒的时间,对蒴果进行了20 min的消毒,以此来降低污染率。试验结果显示种子播种后未见污染现象,可见使用次氯酸钠溶液对蒴果进行长时间消毒的方法可以有效降低污染风险。
在原球茎增殖试验中,本研究讨论了NAA浓度对原球茎增殖率的影响,结果显示NAA对原球茎的增殖具有显著影响,且适宜的NAA浓度为0.5 mg·L-1。而在苏江等[6]的试验结果显示NAA对原球茎增殖的影响不显著,与本试验的结果存在差异。初步推断,产生差异的原因可能在于原球茎的来源不同,本研究中的原球茎直接由种子诱导而来,苏江等使用的原球茎由茎段诱导而来,因此对NAA可能存在敏感性上的差异。具体原因有待进一步的试验来讨论。
本研究在玫瑰石斛的壮苗培养中对土豆泥进行了讨论,分别设置了20,50,100 g·L-1 3种用量梯度,结果显示添加50 g·L-1土豆泥的培养基壮苗效果最佳。土豆泥是在石斛组培中一种常见的有机添加物,对种子的萌发、原球茎的增殖生长以及芽的生长等方面都具有促进作用。目前对于土豆泥对石斛生长促进作用的机理尚不明确,有待进一步的研究讨论。谢寅峰等[14]认为土豆泥等天然有机添加物中的糖类、有机成分、各种维生素及矿物质等微量元素能给组培苗提供生长发育所需要的各种养分,同时提高了组培苗在组培室的弱光环境下的碳代谢的能力,进而促进组培苗壮苗。土豆泥天然有机添加剂存在成分大多不明、含量不稳定等问题,无法确定各种成分中促进组培苗生长的具体有效成分,在进行具体的有机添加剂试验时,应先做预备试验加以验证再进行具体试验[15]。同时有研究显示相较于对照组,添加了土豆泥的培养基褐化现象更加严重,这可能是由于有机添加物的复杂成分里有易引起褐化的物质,在培养的过程中需要及时的继代出现褐化的组培苗[16]。因土豆泥具有成本较低的优势,在春石斛、铁皮石斛等工厂化育苗中土豆泥得到了广泛运用[17-18]。白音等[5]的研究表明土豆泥提取物对玫瑰石斛种子的萌发具有促进作用。苏江等[6]研究了不同有机添加剂对玫瑰石斛原球茎增殖的影响,结果表明椰子汁和土豆提取物的效果较好,其中椰子汁的效果更佳,但是此试验仅对有机添加剂的种类进行了讨论,没有对添加量进行研究,具体的效果有待于进一步试验验证。
本研究对玫瑰石斛完整组培快繁体系进行了探索。以玫瑰石斛种子为外植体,使用无菌播种的方式,经过种子萌发诱导原球茎、原球茎增殖及丛生芽分化,并进行生根壮苗培养,建立了玫瑰石斛组培快繁体系,为玫瑰石斛繁育和优质种苗生产提供了参考依据。研究结果显示:使用无菌播种的方式,将种子撒播于1/2MS培养基上,种子可快速萌发形成原球茎;NAA对玫瑰石斛原球茎的增殖具有显著影响,原球茎增殖与分化最佳培养基为1/2MS+1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA;土豆泥对玫瑰石斛生根壮苗具有显著影响,添加适量的土豆泥可以显著的促进生根壮苗,最适的生根壮苗培养基为1/2MS+0.2 mg·L-1 NAA+50 g·L-1土豆泥。
参考文献:
[1] 娄港归, 夏杰, 杨健, 等. 基于UPLC-Q-TOF-MS/MS代谢组学的铁皮石斛和玫瑰石斛化学成分差异研究[J]. 药学学报, 2021, 56(12): 3331-3344.
[2] 李付惠, 丁长春,李蕾. 玫瑰石斛的生药学鉴定[J]. 文山学院学报, 2011, 24(3): 16-17, 40.
[3] 李振坚, 周文雅, 韩彬, 等. 基于UPLC-Q-TOF-MS技术的玫瑰石斛生物碱研究[J]. 天然产物研究与开发, 2020, 32(3): 482-488, 426.
[4] 赵昕, 张朝凤, 张勉, 等. 玫瑰石斛中的非生物碱类成分研究[J]. 药学与临床研究, 2011, 19(2): 136-138.
[5] 白音, 包英华, 王文全, 等. 玫瑰石斛的组织培养及快速繁殖[J]. 植物生理学通讯, 2006, 42(5): 903.
[6] 苏江, 陈林发, 邓晰朝. 玫瑰石斛原球茎的诱导与增殖研究[J]. 种子, 2016, 35(3): 85-88, 92.
[7] 许丁帆, 刘艳军, 贺峰. 玫瑰石斛葉片培养与原球茎诱导[J]. 天津农学院学报, 2020, 27(1): 24-27.
[8] 张明,夏鸿西,朱利泉,等.石斛组织培养研究进展[J].中国中药杂志,2000,25(6):323-326.
[9] 明兴加, 冯婷婷, 钟国跃, 等. 石斛属植物一种新型种苗快繁途径——种子自然繁殖方法学探讨[J]. 安徽农业科学, 2010, 38(7): 3390-3392.
[10] 李荣珍. 铁皮石斛种子试管苗的快速繁殖研究[J]. 广东农业科学, 2012, 39(14): 22-24, 1.
[11] 任海虹. 铁皮石斛高效快繁技术体系研究[D]. 太原: 山西大学, 2016.
[12] 梁晖辉, 张成才, 高真, 等. 响应面法探究铁皮石斛种子一步成苗[J]. 中药材, 2019, 42(11): 2473-2479.
[13] 任海虹, 王景雪, 聂菁. 铁皮石斛原球茎高效再生体系的研究[J]. 中草药, 2017, 48(19): 4057-4061.
[14] 谢寅峰, 徐丽, 张志敏, 等. 几种有机添加物对霍山石斛试管苗生理特性的影响[J]. 西北林学院学报, 2011, 26(1): 77-81, 118.
[15] 何松林, 孔德政, 杨秋生, 等. 碳源和有机添加物对文心兰原球茎增殖的影响[J]. 河南农业大学学报, 2003, 37(2): 154-157.
[16] 李秋玲,李青,刘燕,等.春石斛继代培养主要影响因素[J].东北林业大学学报,2014,42(7):69-73.
[17] 时晶晶. 春石斛离体繁殖不同成苗途径的研究[D]. 北京: 北京林业大学, 2009.
[18] 徐迎亚, 王艳, 刘宏源, 等. 铁皮石斛原球茎增殖与分化影响因素研究[J]. 广州中医药大学学报, 2015, 32(6): 1091-1097, 1122.
