融合数字化实验与常规实验,促进学生认识发展
2022-05-30李艳何彩霞
李艳 何彩霞

摘要:化学概念原理的学习,重在引导学生认识化学变化所遵循的基本原理和规律,与之相应的实验探究学习活动的设计,需要结合具体教学内容的特点和学生的实际来进行。在高中化学选择性必修1“金属的电化学腐蚀”教学中,围绕钢铁腐蚀的原因、本质和影响因素等内容,将数字化实验与常规实验有机整合设计探究活动,通过实验方案的设计、实验现象的观察、分析与推理等学习任务,调动学生经历思维加工过程,进而促进学生的知识建构和认识发展。
关键词:化学实验;数字化实验:电化学腐蚀;认识发展
文章编号:1008-0546( 2022) 09x-0006-06 中图分类号:G632.41 文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022.09x.002
一、问题的提出
“金属的电化学腐蚀”是化学概念原理类内容的重要组成部分,认识电化学腐蚀的本质和影响因素,有利于选择防腐蚀的措施和方法,[1]对于促进学生认识发展,形成分析、解释和解决相关问题的能力等具有重要价值。
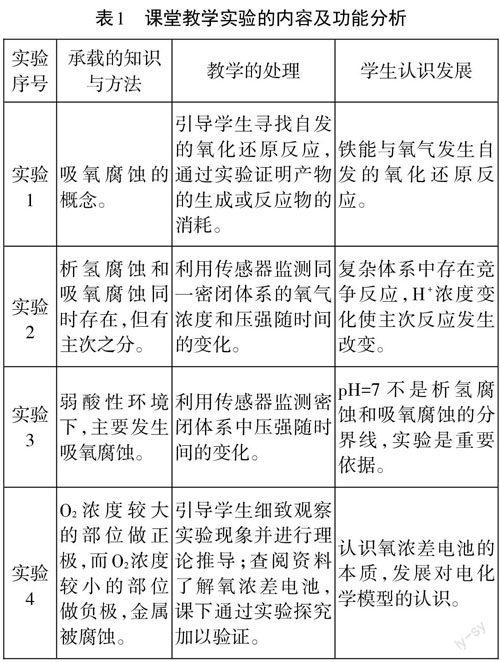
人教版高中化学选择性必修1“化学反应原理”教材[2]主要介绍了金属的两种电化学腐蚀过程——析氢腐蚀和吸氧腐蚀,并编排有“铁钉的吸氧腐蚀实验”。这一实验没有涉及“析氢腐蚀”,教师教学中会补充“析氢腐蚀”的实验。但是难以帮助学生形成以下认识:(1)金属发生析氢腐蚀的同时也进行吸氧腐蚀;(2)金属在弱酸性环境下主要发生吸氧腐蚀;(3)纯净的金属直接放在电解质溶液中主要发生电化学腐蚀。
在以往的教学实践中发现,学生对于“金属的电化学腐蚀”的认识存在以下障碍:(1)对电化学腐蚀的原理认识不清。表现为:学生认为钢铁放在氯化钠溶液中,因不存在自发的氧化还原反应,因此不能形成原电池;对于将纯净的金属直接放在电解质溶液中,学生认为此装置缺少构成原电池的基本要素——两个活性不同的电极材料,因此发生的不是电化学腐蚀;对吸氧腐蚀正极反应原理的分析存在困难,更难系统地分析从腐蚀到生锈的完整过程。(2)对析氢腐蚀和吸氧腐蚀的认识有偏差。表现为:对于析氢腐蚀的实验,学生没有持续地关注实验现象,不能自主想到随着反应的进行溶液中的pH会发生变化,不能主动意识到反应会由以析氢腐蚀为主转变为以吸氧腐蚀为主;学生往往认为pH=7是析氢腐蚀转变为吸氧腐蚀的转折点,且认为析氢腐蚀与吸氧腐蚀是独立存在的。究其原因,學生受先前所学知识的局限,认识角度单一、不系统等影响。
有关“金属的电化学腐蚀”教学的已有研究主要有以下情形:(1)以实际问题情境(如暖宝宝)为载体或以生活中常见的金属腐蚀现象为素材,注重对教材装置进行创新,如利用U型管实验监测酸性环境下体系压强的变化,证明先发生析氢腐蚀后发生吸氧腐蚀;[3](2)运用数字化实验探究弱酸性条件下钢铁主要发生吸氧腐蚀;[4](3)基于高考试题在原电池原理方面进行拓展,揭示“氧浓差电池”的本质。[5]以上教学设计都有各自的创新点和值得借鉴的地方,然而从学生学习角度看,孤立地看析氢腐蚀和吸氧腐蚀不利于学生全面地认识体系中化学反应的复杂性及动态变化,会妨碍学生的知识理解。笔者在“金属的电化学腐蚀”教学中,将数字化实验与常规实验相结合,围绕“金属的电化学腐蚀”的原因、本质和影响因素等展开探究,通过协同发挥不同实验的优势,化解学生认识障碍,促进学生的知识建构和认识发展。
二、教学目标与教学流程
1.教学目标
(1)在教师引导下,能设计和改进探究钢铁腐蚀原因的实验方案;能有意识地建立实验目的一现象—结论之间的关联,能系统分析钢铁发生析氢腐蚀和吸氧腐蚀的原理。
(2)能认真观察实验,通过分析同一密闭体系中,不同pH下压强和氧气浓度随时间变化的曲线,认识金属腐蚀中反应的多样性,形成分析复杂体系化学反应的思路和方法。
(3)基于实验证据揭示氧浓差电池的本质,能解释证据与结论之间的关系,设计实验方案证明氧浓差电池的存在,发展对电化学模型的认识,分析和解释相关问题。
2.教学流程
以上述教学目标为导向,按照课前—课中—课后整体安排学习过程。课前,从学生身边常见的生活情境“钢铁腐蚀”人手,通过问题驱动,调动学生对探究活动的兴趣,引导学生以小组合作的方式设计“探究金属铁腐蚀的原因”实验方案;课上,以学生课前设计的实验方案为研讨的起点,将学生的疑惑设置为导引性问题,借助数字化实验与常规实验,让学生对实验现象及其对应的原理进行深入阐述与推理,多角度认识电化学腐蚀,化解学生的认知障碍;课后,再组织学生进行实验拓展,进一步发挥实验对于学生认识发展的重要作用。具体教学流程见图1。
三、教学过程
1.实验探究钢铁腐蚀的原因
[资料]全球每一分钟就有一吨钢被腐蚀成铁锈,全世界每年由于腐蚀而造成报废的钢铁高达总产量的三分之一,造成的直接经济损失约7000亿美元,是地震、水灾、台风等自然灾害造成损失总和的6倍。不同环境下钢铁受腐蚀的差别是明显的,如工业区高于生活区,沿海高于内陆。
[课前任务]阅读资料,小组合作探究金属铁被腐蚀的原因,提供实验方案(试剂、装置仪器等),实验用具,自主完成实验,提交实验视频或图片,结合图示及化学用语说明实验原理。课上小组汇报实验目的一实验现象一实验结论。
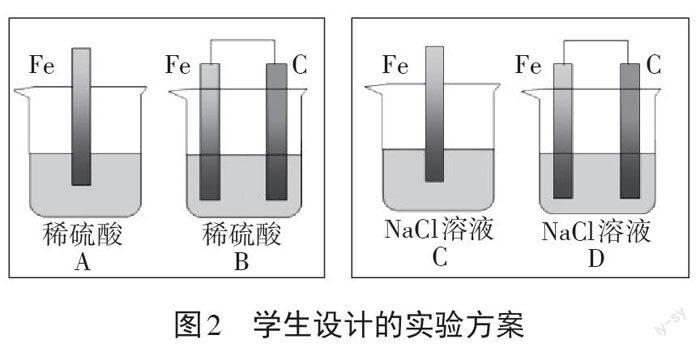
学生设计的实验方案见图2。
向以上溶液中各滴入几滴铁氰化钾溶液,验证Fe2+的生成。有的组在B和D装置中接入电流计。
根据学生的方案,教师提供试剂和装置:铁片(不含杂质)、碳棒、稀硫酸、氯化钠溶液、酚酞溶液、铁氰化钾溶液、烧杯、导线、电流表,学生进行相关实验。
[小组汇报]根据下列问题,各组汇报。你设计以上实验的目的是什么?实验现象分别是什么?通过实验你初步获得哪些结论?
学生回答1:设计A、B实验的目的是证明钢铁在酸性环境下能够被腐蚀。实验现象是:A、B装置中在较短时间内都产生了大量的蓝色沉淀,其中B装置中产生的更多,碳棒上产生了大量的气体,B装置接人电流计,指针发生偏转,应该是形成了原电池,加快了腐蚀速率。
学生回答2:C、D兩个装置腐蚀速率较慢,但是D的反应速率大于C装置,10 min后D装置能明显看到较多的蓝色沉淀,较长一段时间后,发现D装置比C装置生锈更严重。
教师演示D装置接人电流计后指针发生偏转,并归纳B、D装置确实是由于形成了原电池导致钢铁发生了腐蚀,称为电化学腐蚀,B装置的腐蚀由于不断有氢气放出,所以叫做析氢腐蚀。
[问题I]D装置(Fe-C-NaCl溶液)的反应原理是什么?如何证明?
学生回答3:根据实验现象说明D装置形成了原电池,这个装置中发生了自发的氧化还原反应,正极反应物应为O2,产物为OH-,检验正极产物的方案为:在碳棒电极处滴加酚酞观察颜色变化。
教师进行演示实验1:Fe-C-NaCl溶液原电池实验(见图3),碳棒附近的溶液变红。师生共同归纳吸氧腐蚀的原理,由学生系统分析钢铁生锈的过程。
[问题2]吸氧腐蚀的本质为铁与氧气发生自发的氧化还原反应,你还能想到用哪些方法证明氧气参与了反应?
学生回答4:可以设计一个封闭体系,测定体系压强的变化,证明O2是否参加了反应。
教师介绍课本实验装置、创新实验装置(U型管实验)和数字化传感器信息系统。
2.利用数字化实验再认识析氢腐蚀与吸氧腐蚀
[问题3]B装置(Fe-C-硫酸溶液)只发生析氢腐蚀吗?说明理由。
学生回答5:H+消耗完后,溶液呈中性,会发生吸氧腐蚀。
教师播放实验2视频:用数字化实验测量酸性环境下(pH=2.02)的钢铁腐蚀的动态曲线。该实验需进行课前准备(实验装置见图4)。实验仪器及实验试剂包括:数据采集器、气体压力传感器、氧气浓度传感器、pH传感器、铁架台、三口瓶、橡胶塞、胶头滴管、铁粉、碳粉、饱和NaCl溶液、稀盐酸(1 mol/L)。该实验的操作步骤如下:(1)使用pH传感器监测溶液的pH,将饱和食盐水的pH调至酸性(pH=2.02),准备好铁粉、碳粉、药匙等;(2)取5.0 g铁粉和5.0 g碳粉于三口瓶中混合均匀,其中两个瓶口分别与气体压力传感器、氧气浓度传感器连接好,打开电脑显示界面,从另一口中迅速倒人pH=2.02的饱和氯化钠溶液,迅速塞好塞子,得到压强和氧气浓度的变化曲线。
[问题4]图5所示的是实验室模拟pH=2.02的钢铁腐蚀过程,用传感器分别测定同一密闭体系同一时间范围内的氧气浓度和压强变化,你能获得哪些结论?
查阅资料:传感器测定氧气浓度的方法不受体系内其他物质的影响。
学生结合图5描述实验现象为:酸性环境下,氧气浓度一直下降,压强先升高后不变最后降低。由此说明整个过程氧气一直被消耗,而压强变化的原因是氢气的析出与氧气消耗不同,一开始氢气的析出占主导,最后以氧气的消耗为主。
师生共同得出结论:(1)金属的电化学腐蚀中,析氢腐蚀和吸氧腐蚀同时存在;(2)酸性环境下,一开始以析氢腐蚀为主,后来以吸氧腐蚀为主。H+浓度影响物质氧化性及反应速率,浓度改变使主次反应发生逆转。
[追问]是否pH=7时才以吸氧腐蚀为主呢?
教师引导学生认识浓度的相对大小没有严格的界限,不同体系、不同种类、不同浓度电解质溶液的分界线也会有所不同,此时应以实验为依据,确定以吸氧腐蚀为主时的pH。
学生回答6:可以用传感器测定不同pH下压强的变化情况来得出结论。
教师播放实验3视频:数字化实验模拟弱酸性环境下(pH=5.82)的钢铁腐蚀。选择此pH的原因是有关文献表明析氢腐蚀和吸氧腐蚀交替发生的临界pH值在5.6-5.7。[6]
师生共同得出结论:弱酸性环境下,主要发生吸氧腐蚀(见图6)。
3.借助常规实验认识氧浓差电池
[问题5]C装置(纯净的铁片放在NaCl溶液中)发生的是化学腐蚀,还是电化学腐蚀,为什么?
学生回答7:此装置不满足原电池发生的条件,应该是化学腐蚀。
教师演示实验4:纯净的铁片在氯化钠溶液中的腐蚀实验。将铁片放入氯化钠的水溶液中,并滴入几滴铁氰化钾溶液,10 min后开始出现蓝色沉淀,其中直接在底部产生了蓝色沉淀,现象见图7。
通过充分的讨论,论证解释的合理性,教师不断与学生对话、追问。共同发现,底部首先出现蓝色沉淀,应该是底部的铁优先被腐蚀,如果只发生化学腐蚀,应该是界面处(氧气浓度更大)腐蚀更严重,因此合理的解释是底部的铁作负极,发生Fe - 2e-= Fe2+的反应,靠近液面处的氧气浓度大,得电子能力大于底端的氧气,在靠近液面处作正极反应物,构成了原电池,详细原理见图8。
[查阅资料[7]]氧浓差电池腐蚀是由金属与含氧量不同的溶液接触而形成。当金属浸入含氧的溶液中,氧的电极电位与氧气浓度有关,氧气浓度较大的部位电位较高,做原电池的正极;而氧气浓度较小的部位电位较低,做负极,金属被腐蚀。
[教师小结]只要存在自发的氧化还原反应,虽正负电极相同但处于不同环境(O2浓度不同)也能构成原电池,称为氧浓差电池。C装置发生的腐蚀不是化学腐蚀,而是电化学腐蚀,教材中关于化学腐蚀的描述为:金属与接触到的干燥气体(如O2、Cl2、SO2等)或非电解质液体(如石油)等直接发生化学反应而引起的腐蚀,叫做化学腐蚀。
[问题6]如何设计实验证明氧气浓度差异导致发生电化学腐蚀?
学生设计的装置如图9所示,在教师指导下课后完成实验,学生观察到氧气浓度不同时,电流表指针发生偏转,说明这是电化学腐蚀。并从实验过程中体会到氧气的浓度不同会引起2个电极的活性差异,符合原电池的形成条件。
[交流与讨论]你对钢铁腐蚀的原因有哪些新的认识?
学生谈自己的想法,教师最后归纳钢铁腐蚀的主要原因,目的是让学生通过梳理探究过程形成本节课解决问题的基本思维模型,為金属防护方法的设计打下基础。
四、教学反思
化学概念原理的学习,重在引导学生认识化学变化所遵循的基本原理、规律及其应用,[8]与之相应的实验探究学习活动的设计,需要结合具体教学内容的特点和学生的实际来进行。本节课注重以实验为基础,引导学生认识金属电化学腐蚀的原因、本质和影响因素,教学感悟如下:
1.注重发挥实验在概念、原理学习中的作用
概念、原理的学习需要借助丰富的感性材料,通过现象剖析、比较、抽象、概括从而实现对概念、原理本质的认识,实验是向学生提供感性材料的主要途径。本节课将数字化实验和常规实验相结合,共设计有四个实验(见表1),通过这些实验,在激发学生的探究兴趣的同时,让学生在实验中体验与感悟,加深对知识的理解,实现认识发展。
2.针对学生认知障碍引发质疑和探究
“金属的电化学腐蚀”知识较为抽象复杂,学生在学习过程中存在一些困难。对此,课堂上教师在发挥实验提供感性认识的同时,还利用系列驱动性问题引发学生质疑、探究与反思,引导学生反复检验已有认识的不足并重新构建新的知识框架,展示新认识的合理性,最终转变为科学认识。如:学生认为纯净的铁片直接放在氯化钠溶液中,由于该装置不满足原电池的形成条件,因此应该是发生化学腐蚀。此时教师提供引起学生认知冲突的实验事实“烧杯底部的铁片附近先产生蓝色沉淀”,学生经过小组讨论,相互启发,对实验现象进行理论分析发现,铁片在溶液下和溶液与空气交界处的差异主要是氧气浓度,因此合理的解释应该是氧气浓度大的铁片一端为原电池的正极,氧气作正极反应物,氧气浓度小的铁片端为负极,铁被腐蚀。该理论推导是否合理呢?此时教师提供关于氧浓差电池的资料,并引导学生设计实验加以证明,通过理论推导与实验探究发展了学生对原电池形成条件的认识。
3.引导学生多角度分析促成对概念的深刻理解
学生对于化学概念原理的认识发展需要经历感知、分析、推理、结论等思维加工过程。为此,教学中在组织开展实验探究活动时,注重对实验方案、实验现象、实验结论等进行完整论证,系统推理。在“金属的电化学腐蚀”知识的形成过程中,首先,注重引导学生基于实验现象等证据进行分析概括,以此揭示金属的析氢腐蚀与吸氧腐蚀的本质;在此基础上教师又引导学生对实验数据和图像进行分析推理来认识复杂体系中的金属腐蚀情况,加强对概念的迁移应用;最后,通过探讨氧浓差电池拓展了学生对吸氧腐蚀的认识。上述基于多角度的分析、论证丰富了学生对概念的内涵和外延的理解,促使化学概念的学习得以深化和发展。
参考文献
[1] 张宝红,丛文博,杨萍编.金属电化学腐蚀与防护[M].北京:化学工业出版社,2015:3.
[2]人民教育出版社,课程教材研究所,化学课程教材研究中心.普通高中教科书(化学选择性必修1)[M].北京:人民教育出版社,2019.
[3]袁振东,乔腾,葛丽丽,等.“金属的电化学腐蚀”教学设计创新[J].化学教育,2018,39(11):28-33.
[4] 吴晓红,徐建菊.基于传感器探究酸性条件下铁的吸氧腐蚀[J].化学教育,2019,40(1):50-52.
[5]余平平,“钢铁电化学腐蚀原理的再认识”项目式教学[J].化学教育,2019,40(7):23-27.
[6] 林建芬,析氢腐蚀和吸氧腐蚀实验的最佳条件及临界pH值的探究[J].教育与装备研究,2017,33(4):63-66.
[7]孟阿兰,杨宇,刘杰编,物理化学(第四版)[M].北京:化学工业出版社.2019:215.
[8] 中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[s].北京:人民教育出版社,2020.
