Ghsr-/-小鼠黑质ATP敏感性钾通道亚基表达改变
2022-05-30吕吉荣肖雪焦倩陈曦杜希恂姜宏
吕吉荣 肖雪 焦倩 陈曦 杜希恂 姜宏
[摘要]目的 探讨生长激素促分泌素受体1a(GHSR1a)基因敲除小鼠黑质ATP敏感性钾通道(KATP通道)亚基的表达变化。方法 选取5只3月龄GHSR1a敲除(Ghsr-/-)小鼠和5只同窝野生型(WT)小鼠,应用蛋白免疫印迹和实时荧光定量PCR方法检测小鼠黑质KATP通道组成亚基SUR1、SUR2B、Kir6.2的蛋白和mRNA水平。结果 与WT组相比,Ghsr-/-组小鼠黑质KATP通道组成亚基SUR1蛋白表达水平降低(t=3.389,P<0.05),而SUR2B、Kir6.2蛋白表达无明显变化(P>0.05)。两组小鼠黑质KATP通道组成亚基SUR1、SUR2B、Kir6.2的mRNA表达水平差异均无显著性(P>0.05)。结论 GHSR1a基因敲除会导致黑质KATP通道组成亚基SUR1蛋白的表达降低。
[关键词]受体,胃促生长素;黑质;KATP通道;小鼠,基因敲除
[中图分类号]R338.2 [文献标志码]A [文章编号]2096-5532(2022)03-0329-04
doi:10.11712/jms.2096-5532.2022.58.088
CHANGE IN THE EXPRESSION OF ATP-SENSITIVE POTASSIUM CHANNEL SUBUNITS IN THE SUBSTANTIA NIGRA OF GHSR-/-MICE
L? Jirong, XIAO Xue, JIAO Qian, CHEN Xi, DU Xixun, JIANG Hong
(State Key Disciplines: Physiology (in Incubation), Department of Physiology, Qingdao University, Qingdao 266071, China)
[ABSTRACT] ObjectiveTo investigate the change in the expression of ATP-sensitive potassium channel (KATPchannel) subunits in the substantia nigra of mice with growth hormone secretagogue receptor 1a (GHSR1a) gene knockout. MethodsFive GHSR1a-knockout (Ghsr-/-) mice and five wild-type (WT) littermates were selected, and Western blotting and quantitative real-time PCR were used to measure the protein and mRNA expression levels of the SUR1, SUR2B, and Kir6.2 subunits of KATPchannel in the substantia nigra. Results Compared with the WT group, the Ghsr-/-group had a significant reduction in the protein expression level of the SUR1 subunit of KATPchannel in the substantia nigra (t=3.389,P<0.05), while there were no significant changes in the protein expression levels of SUR2B and Kir6.2 subunits (P>0.05). There were no significant differences between the two groups in the mRNA expression levels of SUR1, SUR2B, and Kir6.2 of KATPchannel (P>0.05). Conclusion
GHSR1a gene knockout can reduce the protein expression of the SUR1 subunit of KATPchannel in the substantia nigra.
[KEY WORDS]receptors, ghrelin; substantia nigra; KATPchannels; mice, knockout
生長激素促分泌素受体1a(GHSR1a)是一种广泛分布在下丘脑、垂体、腹侧被盖区、中缝核、海马和黑质致密部等区域的G蛋白偶联受体[1]。ghrelin是其唯一的内源性配体[2]。本实验室前期研究结果证实,ghrelin-GHSR1a可以通过改善线粒体功能,拮抗鱼藤酮和1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的多巴胺(DA)能神经元细胞的死亡[3-4]。同时,GHSR1a还具有本构型活性,即在缺乏配体或激动剂的情况下,受体仍能自发地维持激活并维持下游信号转导通路的活性[5-6]。已有研究结果表明,在小鼠脑内黑质立体定位注射GHSR1a拮抗剂可诱导DA能神经元中GHSR1a表达下调,并导致小鼠运动功能障碍[7]。
ATP敏感性钾通道(KATP通道)作为一种内向整流钾通道,由4个内向整流钾通道Kir6.X亚基(Kir6.1或Kir6.2)和4个磺酰脲受体(SUR)亚基组成,具有改善细胞内能量代谢水平和稳定内环境的作用[8-10]。近年来的研究表明,KATP通道的选择性激活可能参与了帕金森病(PD)中黑质DA能神经元的损伤[11-12]。PD病人尸检结果显示,脑内黑质残存的DA能神经元上虽然同时表达有SUR1、SUR2B和Kir6.2等3种不同类型的KATP通道,但只有SUR1 mRNA水平显著升高,其余亚基表达均无改变[12]。本实验室前期研究结果证实,在3、6和9月龄的PD转基因小鼠黑质中KATP通道SUR1亚基的蛋白和mRNA表达水平均显著上调。亦有研究证实,ghrelin-GHSR1a可以通过激活KATP通道调节迷走神经节状神经核的兴奋性。而GHSR1a是否也参与调节疾病进展过程中KATP通道各亚单位的表达变化尚不清楚。因此,本研究选取3月龄GHSR1a敲除(Ghsr-/-)小鼠和同窝野生型(WT)小鼠,应用蛋白免疫印迹和实时荧光定量PCR方法对黑质的KATP通道各亚基蛋白及mRNA水平进行检测,为阐明GHSR1a与KATP通道在PD发病中的相互作用提供实验依据。
1材料和方法
1.1实验材料
1.1.1实验动物所用Ghsr-/-小鼠均购自上海南方模式生物科技发展有限公司。Ghsr+/-小鼠与Ghsr+/-小鼠杂交得到下一代小鼠,通过基因鉴定得到Ghsr-/-小鼠及相应的同窝WT小鼠。本实验选用3月龄的Ghsr-/-雄性小鼠和同窝WT雄性小鼠作为研究对象,每组5只。小鼠在室温(23±1)℃、12 h昼夜循环光照的环境下进行饲养,可自由饮水与进食。所有动物实验操作均遵循医学伦理学原则。
1.1.2实验仪器及试剂SUR1抗体、SUR2B抗体、Kir6.2抗体均购自美国Abcam公司;β-actin抗体购自中国Bioss公司;山羊抗鼠二抗、山羊抗兔二抗均购自美国Santa Cruz公司;SDS-PAGE分离胶缓冲液和SDS-PAGE浓缩胶缓冲液均购自美国Sigma公司;ECL发光液、PVDF膜购自美国Millpore公司;RIPA裂解液、过硫酸铵(APS)、四甲基乙二胺(TEMED)、BCA试剂盒、Loading buffer均购自中国碧云天公司;TRIzol试剂购自美国Invitrogen公司;逆转录试剂盒购自美国Thermo公司;SYBR Premix Ex Taq(2×)购自日本Takara公司。所用实验仪器包括电泳仪、电转仪、天能GIS凝胶图像处理系统、高速低温离心机、实时荧光定量PCR仪、分光光度计。
1.1.3实验液体配制0.01 mol/L PBS:称取4.0 g Na2HPO4·12H2O、0.4 g NaH2PO4·2H2O以及9.0 g NaCl,用雙蒸水定容至1 L。电泳缓冲液:称取Tris 1.51 g、甘氨酸7.20 g、SDS 0.50 g,使用双蒸水定容至1 L,调节pH值至8.3。转膜缓冲液:称取Tris 3.0 g、甘氨酸14.4 g,分别加入800 mL的双蒸水和200 mL的甲醇,调节pH值至8.3。TBST溶液:称取Tris 2.42 g、NaCl 8.00 g,用双蒸水定容至1 L,加入1 mL Tween-20,调节pH至7.5。封闭液:用TBST溶液配制的50 g/L脱脂奶粉。
1.2蛋白免疫印迹法检测黑质SUR1、SUR2B和Kir6.2蛋白的表达
小鼠用异氟烷深度麻醉后,断头取脑。根据脑图谱,分别取出大脑双侧黑质区域,并置于预冷的1.5 mL EP管中,分别向EP管内加入100 μL的RIPA裂解液。在冰上用电动研磨棒充分研磨至管内脑组织完全溶解,再置于冰上裂解30 min。把裂解好的组织放入离心机中,在4 ℃下以12 000 r/min的速度离心20 min。离心后取出EP管,将上清液转移到新的EP管中,应用BCA法测定波长562 nm处的吸光度,绘制标准曲线,并计算出待测样本的浓度。配制100 g/L分离胶和50 g/L浓缩胶,按照样品上样量准确上样,蛋白经SDS-PAGE电泳后,湿转到PVDF膜上,转膜完成后,将PVDF膜置于50 g/L脱脂奶粉封闭液中,室温摇床孵育2 h;分别加入一抗SUR1(1∶1 000)、SUR2B(1∶1 000)、Kir6.2(1∶1 000)以及β-actin(1∶1 000),于4 ℃摇床上低速摇动孵育过夜;用1×TBST溶液漂洗3次,每次10 min;加入用1×TBST溶液配制的山羊抗兔二抗(1∶10 000)、山羊抗鼠二抗(1∶10 000),室温摇床孵育1.5 h;再用1×TBST溶液漂洗3次,每次10 min。将PVDF膜置于ECL显影液中孵育1 min,再将PVDF膜置于显影仪中显影并拍摄。用Image J 10.0分析软件对条带进行灰度值分析,以SUR1、SUR2B、Kir6.2与β-actin的比值作为目的蛋白的相对表达水平。
1.3实时荧光定量PCR方法检测黑质中SUR1、SUR2B和Kir6.2的mRNA表达
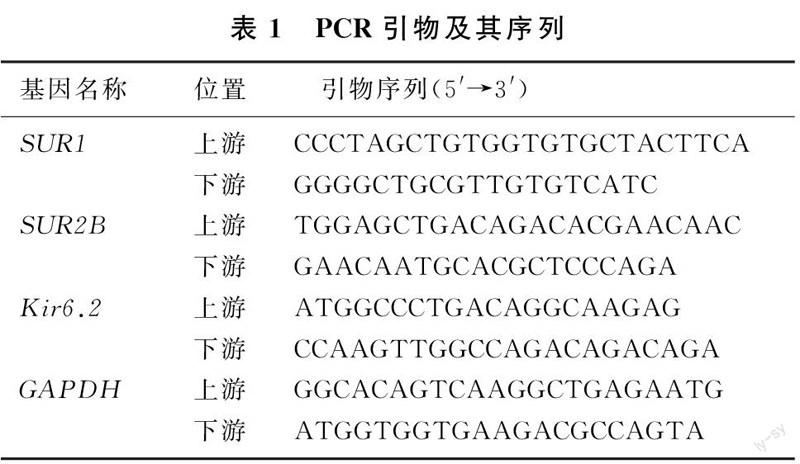
用TRIzol提取小鼠黑质RNA,按照Thermo公司逆转录试剂盒操作说明,配制两步反应体系,先42 ℃变性60 min、25 ℃反转录5 min,然后升温至70 ℃、作用5 min使反转录酶失活,于4 ℃冷却,将mRNA反转录合成cDNA。采用SYBR Green染料法定量检测目的基因SUR1、SUR2B、Kir6.2及内参照基因GAPDH的表达,按照荧光定量PCR说明书配制PCR反应体系,采用两步法经过40个循环完成扩增,采用2-ΔΔCt法计算目的基因的相对表达量。PCR扩增引物及其序列见表1。
1.4統计学分析
应用Graph Pad Prism 8.0软件进行统计学处理。实验结果以x±s形式表示,两组间比较采用t检验。P<0.05表示差异有统计学意义。
2结果
2.1Ghsr-/-小鼠黑质SUR1、SUR2B、Kir6.2的蛋白表达变化
Ghsr-/-组和WT组3月龄小鼠黑质KATP通道亚基SUR1蛋白表达水平分别为0.996±0.120和0.473±0.076(n=5),差异有统计学意义(t=3.389,P<0.05);SUR2B蛋白表达水平分别为0.899±0.142和0.798±0.118(n=5),差异无统计学意义(t=0.492,P>0.05);Kir6.2蛋白表达水平分别为0.827±0.081和0.728±0.065(n=5),差异亦无统计学意义(t=0.860,P>0.05)。
2.2Ghsr-/-小鼠黑质SUR1、SUR2B、Kir6.2的mRNA表达变化
Ghsr-/-组和WT组3月龄小鼠黑质KATP通道亚基SUR1 mRNA的表达水平分别为1.024±0.074和0.990±0.047(n=5),SUR2B mRNA的表达水平分别为1.012±0.082和1.212±0.421(n=5),而Kir6.2 mRNA的表达水平分别为1.137±0.466和1.209±0.118(n=5),两组比较差异均无统计学意义(t=0.294~1.546,P>0.05)。
3讨论
GHSR1a和KATP通道都广泛分布于中枢神经系统[13-14]。GHSR1a主要通过与ghrelin结合发挥作用,但是其在缺乏配体激活时也能够对学习记忆、生长发育等发挥调节作用,这就是GHSR1a的本构型活性[15]。先前有研究结果表明,GHSR1a和多巴胺受体1型(DRD1)结合可以在中脑和海马的神经元亚群中共表达,且可在体外形成异源二聚体,从而进一步修饰G蛋白,扩增DA信号[16-18]。然而,在PD特异性诱导的多能干细胞来源的DA能神经元中GHSR1a的表达显著降低,提示GHSR1a与PD密切相关[19]。本实验选取Ghsr-/-小鼠作为实验对象,通过蛋白免疫印迹法检测到脑内黑质DA能神经元KATP通道SUR1亚基蛋白表达水平显著下调,而SUR2B、Kir6.2亚基蛋白表达均未发生明显改变。本研究同时应用实时荧光定量PCR方法检测了KATP通道各亚基mRNA表达水平变化,结果显示,Ghsr-/-小鼠黑质SUR1、SUR2B及Kir6.2的mRNA表达水平均未发生改变。我们推测这可能与GHSR1a基因敲除后DA能神经元内蛋白质降解异常有关,GHSR1a基因敲除一方面可能引起神经元内自噬的过度激活,另一方面可能引起蛋白泛素化水平异常,使蛋白降解增加。但具体机制还有待于进一步探讨。
SUR1是构成KATP通道的亚基之一,属于三磷酸腺苷结合盒转运体(ABC)蛋白家族,它主要调节KATP通道对ATP、腺苷和药物的敏感性[20-22]。本实验室前期研究证实,携带人A53T突变型α-syn的转基因PD模型小鼠黑质KATP通道的SUR1蛋白表达水平显著上调,而Kir6.2和SUR2B的表达无明显变化。另有研究结果显示,PD病人DA能神经元中SUR1的表达水平比正常人高2倍[23]。KATP通道SUR1亚单位的表达上调能够激活腺苷酸激活蛋白激酶,促进KATP通道的跨膜转运,进而促进其开放[24-25]。但是在PD发病过程中,SUR1的表达异常对于黑质DA能神经元具有何种作用尚不明确。到目前为止,KATP通道在PD中的作用还存在一定的争议。在PD发病早期,KATP通道的激活可以促进DA释放,从而保护神经元。然而,随着疾病的进一步发展,KATP通道会持续激活,造成DA能神经元损伤[26-27]。因此,由GHSR1a基因敲除介导的KATP通道SUR1亚单位表达变化的机制及其在PD中的作用还有待于进一步探讨。本文研究结果为GHSR1a与KATP通道在PD中的作用研究提供了理论依据。
[参考文献]
[1]XIAO X, BI M X, JIAO Q, et al. A new understanding of GHSR1a: independent of ghrelin activation[J]. Ageing Research Reviews, 2020,64:101187.
[2]KOJIMA M, HOSODA H, DATE Y, et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J]. Nature,1999,402(6762):656-660.
[3]DONG J J, SONG N, XIE J X, et al. Ghrelin antagonized 1-methyl-4-phenylpyridinium (MPP(+))-induced apoptosis in MES23. 5 cells[J]. Journal of Molecular Neuroscience: MN, 2009,37(2):182-189.
[4]YU J H, XU H M, SHEN X L, et al. Ghrelin protects MES23. 5 cells against rotenone via inhibiting mitochondrial dysfunction and apoptosis[J]. Neuropeptides, 2016,56:69-74.
[5]BECK B, POURI G. Ghrelin, neuropeptide Y, and other feeding-regulatory peptides active in the hippocampus: role in learning and memory[J]. Nutrition Reviews, 2013,71(8):541-561.
[6]GRAY S M, PAGE L C, TONG J. Ghrelin regulation of glucose metabolism[J]. Journal of Neuroendocrinology, 2019,31(7):e12705.
[7]SUDA Y, KUZUMAKI N, SONE T, et al. Down-regulation of ghrelin receptors on dopaminergic neurons in the substantia nigra contributes to Parkinsons disease-like motor dysfunction[J]. Molecular Brain, 2018,11(1):6.
[8]NOMA A. ATP-regulated K+channels in cardiac muscle[J]. Nature,1983,305(5930):147-148.
[9]ZHUO M L, HUANG Y, LIU D P, et al. KATP channel: relation with cell metabolism and role in the cardiovascular system[J]. The International Journal of Biochemistry & Cell Biology, 2005,37(4):751-764.
[10]FOSTER M N, COETZEE W A. KATP channels in the car-diovascular system[J]. Physiological Reviews, 2016,96(1):177-252.
[11]ZHAO S, WANG M Z, MA Z G. Therapeutic potential of ATP-sensitive potassium channels in Parkinsons disease[J]. Brain Research Bulletin, 2021,169:1-7.
[12]SCHIEMANN J, SCHLAUDRAFF F, KLOSE V, et al. K-ATP channels in dopamine substantia nigra neurons control bursting and novelty-induced exploration[J]. Nature Neuroscience, 2012,15(9):1272-1280.
[13]GROSS J D, KIM D W, ZHOU Y, et al. Discovery of a functionally selective ghrelin receptor (GHSR 1a) ligand for modulating brain dopamine[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022,119(10):e2112397119.
[14]SUN X L, HU G. ATP-sensitive potassium channels: a pro-mising target for protecting neurovascular unit function in stroke[J]. Clinical and Experimental Pharmacology & Physiology, 2010,37(2):243-252.
[15]HOLST B, HOLLIDAY N D, BACH A, et al. Common structural basis for constitutive activity of the ghrelin receptor family[J]. The Journal of Biological Chemistry, 2004,279(51):53806-53817.
[16]BERRY A S, SHAH V D, JAGUST W J. The influence of dopamine on cognitive flexibility is mediated by functional connectivity in young but not older adults[J]. Journal of Cognitive Neuroscience, 2018,30(9):1330-1344.
[17]BERRY A S, SHAH V D, BAKER S L, et al. Aging affects dopaminergic neural mechanisms of cognitive flexibility[J]. The Journal of Neuroscience, 2016,36(50):12559-12569.
[18]NAVARRO G, REA W, QUIROZ C, et al. Complexes of ghrelin GHS-R1a, GHS-R1b, and dopamine D 1 receptors loca-
lized in the ventral tegmental area as main mediators of the dopaminergic effects of ghrelin[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2022,42(6):940-953.
[19]JIANG H, BETANCOURT L, SMITH R G. Ghrelin amplifies dopamine signaling by cross talk involving formation of growth hormone secretagogue receptor/dopamine receptor subtype 1 heterodimers[J]. Molecular Endocrinology, 2006,20(8):1772-1785.
[20]TINKER A, AZIZ Q, LI Y W, et al. ATP-sensitive potas-sium channels and their physiological and pathophysiological roles[J]. Comprehensive Physiology, 2018,8(4):1463-1511.
[21]JHA R M, RANI A, DESAI S M, et al. Sulfonylurea receptor 1 in central nervous system injury: an updated review[J]. International Journal of Molecular Sciences, 2021,22(21):11899.
[22]ALQUISIRAS-BURGOS I, FRANCO-PREZ J, RUBIO-OSORNIO M, et al. The short form of the SUR1 and its functional implications in the damaged brain[J]. Neural Regeneration Research, 2022,17(3):488-496.
[23]DUDA J, PTSCHKE C, LISS B. Converging roles of ion channels, calcium, metabolic stress, and activity pattern of Substantia nigra dopaminergic neurons in health and Parkinsons disease[J]. Journal of Neurochemistry, 2016,139(Suppl 1):156-178.
[24]MIKI T, LISS B, MINAMI K, et al. ATP-sensitive K+channels in the hypothalamus are essential for the maintenance of glucose homeostasis[J]. Nature Neuroscience, 2001,4(5):507-512.
[25]HOLZ G G, CHEPURNY O G, LEECH C A. Leptin-stimulated KATP channel trafficking: a new paradigm for β-cell sti-mulus-secretion coupling[J]? Islets, 2013,5(5):229-232.
[26]KNOWLTON C, KUTTERER S, ROEPER J, et al. Calcium dynamics control K-ATP channel-mediated bursting in substantia nigra dopamine neurons: a combined experimental and modeling study[J]. Journal of Neurophysiology, 2018,119(1):84-95.
[27]KARSCHIN C, ECKE C, ASHCROFT F M, et al. Overlapping distribution of K(ATP) channel-forming Kir6. 2 subunit and the sulfonylurea receptor SUR1 in rodent brain[J]. FEBS Letters,1997,401(1):59-64.
(本文編辑马伟平)