“三步”破解工艺流程题
2022-05-30陈志明


摘 要:工艺流程题主要是以实际工业生产为基础,将化工生产中的生产流程进行简化用框图形式表示出来,试题内容涉及高中化学基本概念与基本理论、元素及其化合物基础知识、物质的转化观、化学实验基本知识,与环境保护和化工生产经济效益相融合.根据流程中涉及到的化学知识设置成系列问题,构成一道完整的化学试题,能力立意,注重考查综合运用能力和化学学科核心素养.
关键词:工艺流程;读题;解题;高中化学
中图分类号:G632 文献标识码:A 文章编号:1008-0333(2022)22-0137-03
工艺流程题在高考化学试卷中已经占据十几年的时间,以真实情境为测试载体,以化学知识作为解决问题的工具,以生产生活中的真实问题为测试任务.试题陌生度高难度大,有明显区分度,对能力要求高,学生容易产生畏惧感.如何高效解答工艺流程题?现以2021年福建省高考化学试卷第12题的变式题为例给大家介绍一种“三步”法.
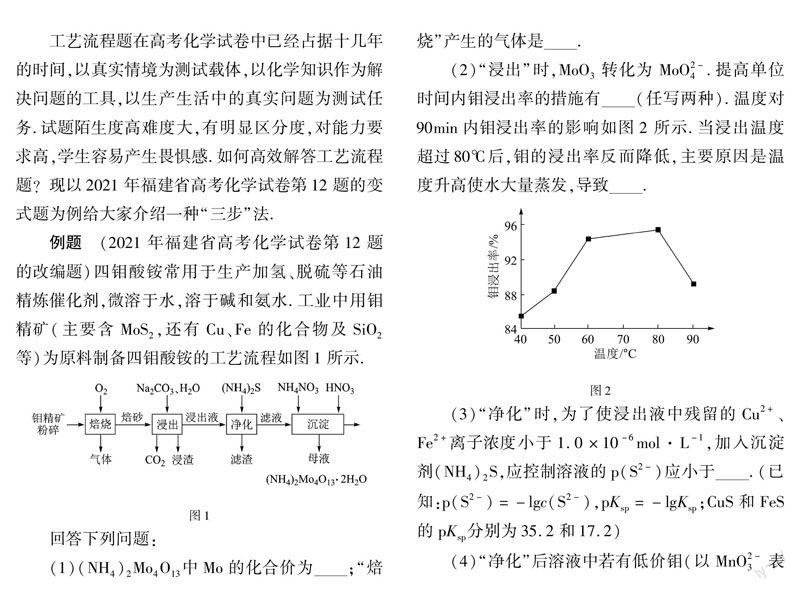
例题 (2021年福建省高考化学试卷第12题的改编题)四钼酸铵常用于生产加氢、脱硫等石油精炼催化剂,微溶于水,溶于碱和氨水.工业中用钼精矿(主要含MoS2,还有Cu、Fe的化合物及SiO2等)为原料制备四钼酸铵的工艺流程如图1所示.
(1)(NH4)2Mo4O13中Mo的化合价为;“焙烧”产生的气体是.
(2)“浸出”时,MoO3转化为 MoO2-4.提高单位时间内钼浸出率的措施有(任写两种).温度对 90min内钼浸出率的影响如图2所示.当浸出温度超过80℃后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致.
(3)“净化”时,为了使浸出液中残留的Cu2+、Fe2+离子浓度小于1.0×10-6mol·L-1,加入沉淀剂(NH4)2S,应控制溶液的p(S2-)应小于.(已知:p(S2-)=-lgc(S2-),pKsp=-lgKsp;CuS和FeS的pKsp分别为35.2和17.2)
(4)“净化”后溶液中若有低价钼(以MnO2-3表示),可加入适量H2O2将其氧化为MnO2-4,反应的离子方程式为.
(5)“沉淀”时,滤液浓缩后加入HNO3的作用是.
(6)工业用H2在高温下还原(NH4)2Mo4O13制备金属钼,反应的化学方程式为.
第一步,粗读试题,了解整道试题的结构.时间控制在40秒以内.具体应该达到以下几点目的:(1)清楚该工艺流程题的所属类型,常见题型有两类:①是以物质制备为载体的工艺流程,确定要制备目标产物,思考核心反应所需试剂实现物质转化,防止副反应发生.②是以物质提纯为载体的工艺流程,主要是对混合物的除杂、分离、提纯,知道杂质物质,思考除杂方法.不同类型的解题思路和方向有所区别,明确工艺流程题的所属类型有助于对整个流程的理解思路,研读流程图时,就能根据每种类型特点来解读流程.(2)清楚原料是什么物质,目标产物是什么物质,了解整道题目的有效信息分布的地方,有些信息是在题头,有些后续设问中的提示性信息可能分布在问答题当中,通过粗读题目就可以把整个信息大概了解,同时用笔在信息下画线做标注,有助于下步精读工艺流程图时对整个流程的理解.比如例题中有效信息分布题头、问答题第(2)、(3)、(4)题目题干中.(3)通过粗读题目,清楚工业流程图中重点流程步骤,涉及问答题的流程步骤相对重要,在第二步精读工业流程图时应全面分析理解,与问题关联度小只需简单了解,节约时间.工业流程图流程步骤一般少则四、五步,多则十几步,每个流程步骤都认真分析会花较长时间,做题过程中是不允许的.如果流程图比较陌生且复杂,知识层面和能力层面达不到相对要求,直接依据问题需要对整个流程大体了解,不必把每个流程的转化环节的原理都弄清.
第二步,细读试题,采集有效信息分析流程.时间控制在3分钟左右.读题要放慢速度,认真分析重要的信息,利用流程图以外的有效信息和后续设问中的提示性信息解读整个流程及每一部分所要达到目的,分析每步流程所加入的物质(注意该物质氧化还原性、酸碱性、稳定性等)、发生的条件、物质的转化以及得到的产物,结合化学知识与化工生产实际问题思考弄清整个流程.首先,通过阅读题头,了解原料或者产物性质,如溶解度、物质的热稳定性和熔沸点等信息,分析原料中哪些元素或物质要到最终产品中,必须除去什么元素.如例题中题头提供的原料钼精矿(主要含MoS2,还有Cu、Fe的化合物及SiO2)中Mo元素要到目标物质中是核心元素, Cu、Fe、S、SiO2等元素或物质为杂质.接着,试题以真实的化工生产过程为背景,主要用框图形式将原料到目标产物的生产工艺流程表示出来,例题由钼精矿为原料制备四钼酸铵.工业流程图要花时间研读,分析流程中的每一步骤,从以下几个方面了解流程:(1)反应物是什么同时生成什么,判断哪些元素或者物质是要在工艺过程中保留的,要除去哪些元素或物质,同时关注这些元素的化合价的变化情况.(2)每步流程发生的化学反应是什么?利用了什么原理?工艺流程一般会涉及氧化还原原理、化学平衡原理、复分解反应、溶液中三大离子平衡原理.(3)加入物质对物质转化有什么作用,可能会产生了什么副产物或杂质,又是如何分离、提纯和循环利用这些物质的?思考问题时始终记住一个非常重要的关键点:一切反应或操作都是得到最后的目标产物,从对产品的影响层面再去理解相关操作或反应物的选择.以例题为例具体做法:将钼精礦(MoS2,Cu、Fe的化合物、SiO2)→通入氧气焙烧得到(MoO3、CuO、Fe2O3、SiO2和SO2)→加Na2CO3、H2O浸出得到(MoO2-4 、Cu(OH)2、Fe(OH)2)→加(NH4)2S净化(滤渣为CuS、FeS滤液主要含MoO2-4)→加NH4NO3、HNO3进行沉淀得到(NH4)2Mo4O13·2H2O.把上述中括号的物质写在相关流程的框图上面,完成后流程根据所写信息重新解读一次,前后意思是否连贯,所有反应和操作是否为获得纯净的产品而服务.
工艺流程主要分为三个阶段:(1)原料预处理阶段:矿物质粉粹、溶解(酸溶、碱溶、水溶及相关化工术语)、初步除杂.(2)核心反应阶段:主要涉及操作措施、物质成分、化学反应、条件控制(充分考虑工艺的酸碱性环境和温度环境),促进核心反应发生,同时又可能会存在哪些副反应发生生产杂质.对反应条件的分析可从影响化学反应速率的因素、影响化学反应平衡因素,同时结合生产综合经济效益要考虑到原料成本、对设备的要求和注意环保、发展“绿色化学”等.箭头处理方法: ①主线——主产品;②支线——副产品;③回头——循环品.(3)产品精制阶段:一般是分离提纯化学实验操作,主要考虑减少产品中的杂质、减少产品损失、防止产品变质问题等.
第三步,解答问题.通过第一步的粗读题目和第二步细读题头、题干工艺流程,全面获取信息、弄清楚整个流程就立即解答问题,答题时看清问题,利用前面两步获取的有用信息来帮助解题,用语要规范,计算要准确.以例题为例谈具体解题过程:(1)根据(NH4)2Mo4O13 的常见O元素化合价和NH+4推算陌生元素Mo为+6价.钼精矿中有三种金属元素Mo、Cu、Fe和非金属Si、S想到“焙烧”产生的气体为SO2.(2)要明白提高单位时间内钼浸出率即提高反应速率,第一空格问题简单化.第二个问题须抓住“水大量蒸发,钼的浸出率反而降低”,结合流程含钼物质要留在滤液中,推出Na2MoO4会因为晶体析出混入浸渣造成损失.(3)将已知CuS和FeS的pKsp分别为35.2和17.2,转换Ksp(CuS)=10-35.2,Ksp(FeS)=10-17.2,依据Ksp(CuS)=c(S2-)×c(Cu2+)公式算出要使Cu2+浓度小于1.0×10-6mol·L-1,则c(S2-)浓度大于10-29.2mol·L-1,要使Fe2+浓度小于1.0×10-6mol·L-1,则c(S2-)浓度大于10-11.2mol·L-1,综述:c(S2-)>10-11.2mol/L,p(S2-)應小于11.2.第(4)、(6)道问题同时考查陌生方程式书写,两道题目涉及两个方程式都为氧化还原反应,工艺流程中氧化还原反应方程式的书写具体步骤如下:步骤一,根据流程图寻找出反应物和生成物,利用元素化合价的变化(或物质氧化还原性)确认氧化剂、还原剂、氧化产物、还原产物四种,同时写出“氧化剂+还原剂→氧化产物+还原产物”模式;(例题第(4)题为例:H2O2+MoO2-3——MoO2-4+ H2O).步骤二,根据得失电子总数守恒规律确定氧化剂、还原剂、氧化产物、还原产物的系数,依据化合价变化可知H2O2→H2O得2个电子,MoO2-3→MoO2-4失2个电子,确定H2O2、MoO2-3的反应系数都为1;步骤三,依据溶液的酸碱性环境完善方程式,完善的顺序一般是使左右电荷总数守恒→化合价未变的金属→酸根离子→H→O.得出第(4)道问题答案:
最后画等号补上高温反应条件.反应式写完后立即检查是否满足守恒观,是否符合溶液酸碱性环境.第(5)道问题根据题头信息和流程变化得到HNO3的作用使溶液显酸性,(NH4)2MoO4转化生成(NH4)2Mo4O13析出晶体.
“三步”解题程序是先了解试题结构和获取信息,再利用已知信息审题会更加科学、精准,最后全面理解试题内容和命题意图.工艺流程题五线(元素线、价类线、反应线、操作线、绿色线)并举,知识落点涉及基本概念、基本原理、元素化合物和基本化学实验操作方法.平时须做好常见考点知识的整理与归纳,熟悉无机化工流程题常见的操作、化工专业名词,适当了解生产、生活和社会实际等内容,注重培养对基础知识、基本技能的整合、推理、应用能力和解题关键能力.
参考文献:
[1]刘全明.化学工艺流程题的结构、特点、分类与解法[J].化学教学,2010(3):57-60.
[2] 洪兹田,陈女婷.陌生氧化还原反应方程式考查的多维视角[J].广东教育(高中版),2019(1):65-67.
收稿日期:2022-05-05
作者简介:陈志明(1976.4-),男,福建省永春人,本科,中学一级教师,从事高中化学教学研究.
